LC-MS/MS测定荷瘤裸鼠血浆中和厚朴酚脂质体浓度及其药代动力学研究
丁士雯 ,马红霞,李娴,刘运龙,陈知航,单成启,程远国,陈俐娟
1.吉林农业大学 动物科技学院,吉林 长春 130118;2.军事医学科学院 微生物流行病研究所,北京 100071;3.四川大学 生物治疗国家重点实验室,四川 成都 610041
厚朴是中国传统中药材,其主要有效成分为厚朴酚、和厚朴酚[1]。现已证明,和厚朴酚具有抑制脂质过氧化[2]、保护脊髓损伤神经[3]、抑制多种细胞增殖和促进肿瘤细胞凋亡[4-6]、逆转鼻咽癌多药耐药性[7]等药理作用,是一种具有开发潜力的抗癌小分子。但由于和厚朴酚结构中含有酚羟基[8],易氧化,且水溶性较差,大大限制了其在临床上的应用。脂质体作为药物的一种递送系统,很好地克服了这一缺点,由于脂质体与细胞膜结构相似,使其更容易入胞。肿瘤部位具有增强渗透与滞留(enhanced permeability and retention,EPR)效应的特性,对脂质体表面进行修饰,可使其具有被动或主动靶向性,减少副作用的发生[9-10]。目前,有关和厚朴酚脂质体的药效学已有报道,其可用于治疗淋巴癌,联合阿霉素抑制4T1细胞的增殖等[11],但是对其进行药代动力学的研究报道不多。
我们建立了快速、灵敏、简便的高效液相色谱-质谱联用(LC-MS/MS)方法,可检测荷瘤裸鼠血浆中不同时间点和厚朴酚的含量,并对其进行了药代动力学分析,以期为临床用药提供参考。
1 材料与方法
1.1 材料
荷瘤裸鼠(16~22 g,由四川大学生物治疗国家重点实验室提供);和厚朴酚(中国食品药品检定研究院生物制品检定所,纯度99.8%,批号:110730-201112);大黄酚(作为内标)(中国食品药品检定研究院生物制品检定所,纯度99.5%,批号:110796-201118);注射用和厚朴酚脂质体冻干粉(成都金瑞基业生物技术有限公司,批号:2014502,20 mg/瓶)。
API-4000Q Trap 型三重四级杆串联质谱仪(Applied Biosysytem Sciex 公司);Agilent1200 高效液相色谱仪(Agilent Technologies 公司);YMC C18(100 mm×2.1 mm,1.7 μm)色谱柱(YMC 公司);GL-88B型旋涡混合器(海门市其林贝尔仪器制造有限公司);TGL-14G 高速离心机(上海医疗器械(集团)有限公司手术器械厂);比朗超声波清洗器(上海比朗仪器有限公司);FA1004电子天平(上海舜宇恒平科学仪器有限公司)。
乙腈(色谱纯,Fisher Scientific 公司,批号:135525);甲醇(色谱纯,Fisher Scientific 公司,批号:134191);乙酸乙酯(色谱纯,Honeywell International Inc 公司,批号:C0033);氨水(分析纯,北京化工厂,批号:20090616);纯净水(娃哈哈公司)。
1.2 溶液配制
精密称取和厚朴酚标准品10.02 mg,用甲醇溶液溶解,并定容至10 mL容量瓶中,混匀得1 mg/mL的和厚朴酚储备液,并用甲醇稀释成系列标准品溶液供分析用。
精密称取大黄酚标准品10.05 mg,用甲醇溶液溶解,并定容至10 mL容量瓶中,混匀得1 mg/mL的大黄酚储备液,备用。
1.3 分析条件
1.3.1 液相条件 YMC C18(100 mm×2.1 mm,1.7 μm)色谱柱,流动相B 为0.025%氨水乙腈,A 为0.025%氨水,在线脱气,流速0.8 mL/min。梯度洗脱:0~2 min,B 相85%~85%;2~4 min,B 相85%~10%;4~6 min,B 相10%~85%;6~8 min,B 相85%~85%,柱温400C。进样量10 μL。
1.3.2 质谱条件 离子源电喷雾电离源(ESI),负离子电离模式,雾化气50 psi,加热辅助气50 psi,源温度为600℃,毛细管电压-4000 V,扫描方式多级反应监测(MRM),监测离子对m/z 和厚朴酚(265.0→223.0)和内标(253.0→225.0),和厚朴酚和内标碰撞能量分别为-41和-39 V。
1.4 样品处理
取荷瘤裸鼠血浆样品45 μL置于1.5 mL Ep管中,加入5 μL甲醇、5 μL内标溶液(1 μg/mL),涡旋混匀,加100 μL 乙腈,涡旋2 min,14 000 r/min 离心10 min,破坏和厚朴酚脂质体,裂解出未游离和厚朴酚。取上清液,进样测定。
1.5 受试动物给药方案
荷瘤裸鼠63 只随机分为9 组,每组雌雄各半。瘤体积约为110 mm3时,尾静脉注射20 mg/kg 和厚朴酚脂质体,分别于2、5、15 min及0.5、0.75、1、2、4、6 h摘除眼球取血,肝素抗凝,5000 r/min离心5 min分离血浆,分装后-80℃冻存,备测药代动力学参数。
2 结果
2.1 质谱分析
采用负离子方式检测,将和厚朴酚和大黄酚标准品溶液按上述步骤操作,在一级全扫描质谱图中获得和厚朴酚和内标分子离子峰,选择相应准分子离子峰进行碰撞诱导电离,生成碎片离子峰,两者质谱图见图1、2。
2.2 方法学考察
2.2.1 方法专属性 取浓度为0.500 ng/mL 的和厚朴酚和内标混合标准溶液直接进样,得和厚朴酚和内标标准品色谱图(图3A);取空白血浆45 μL,除不加内标外,其余按前述样品处理操作,得空白血浆色谱图(图3B);取0.500 ng/mL 的和厚朴酚血浆样品,按前述样品处理操作,得和厚朴酚和内标提取后色谱图(图3C);取荷瘤裸鼠静脉注射单剂量单次给药组1 号(给药后0.75 h 样品),按前述样品处理操作,得血浆样品中和厚朴酚和内标色谱图(图3D)。结果显示,在本实验条件下,和厚朴酚和内标保留时间分别为2.9和5.1 min,峰形及分离度良好,血浆中杂质不干扰样品的测定,方法专属性良好。
2.2.2 线性关系及定量下限 取荷瘤裸鼠空白血浆45 μL,分别加入和厚朴酚系列标准溶液5 μL,配制成血浆中含和厚朴酚质量浓度分别为0.500、2.000、5.000、25.00、100.0、250.0、500.0、1000 ng/mL 的标准曲线样品,其余加入1 μg/mL 内标溶液同样品处理方法,进样测定。以待测物和厚朴酚浓度为横坐标、待测物与内标峰面积比为纵坐标进行线性回归,得方程y=0.0147x+0.000711(r2=0.9965)。表明和厚朴酚在0.500~1000 ng/mL 范围内线性关系良好,定量下限为0.500 ng/mL(S/N>10)。
2.2.3 回收率 按前述样品处理方法,制备含和厚朴酚质量浓度分别为1.000、50.00、800.0 ng/mL的含药血浆,进样测定,得提取后色谱峰面积At;以水代替空白血浆配成含和厚朴酚1.000、50.00、800.0 ng/mL 的标准溶液,同上处理,得提取后色谱峰面积A0。每个浓度平行4份样品。以At/A0×100计算得血浆样品处理方法的绝对回收率,结果见表1。
2.2.4 基质效应 取空白血浆45 μL,除不加内标外,其余按样品处理方法操作,取上清液,将和厚朴酚标准溶液稀释成浓度为1.000、50.00、800.0 ng/mL的溶液,进样测定,记录峰面积为At;用流动相将和厚朴酚标准溶液稀释成浓度为1.000、50.00、800.0 ng/mL 的溶液,进样测定,记录峰面积为A0。每个浓度平行4 份样品。以At/A0×100 评价方法基质效应,结果见表1。
表1 LC-MS/MS测定和厚朴酚及内标的绝对回收率和基质效应(n=4,)
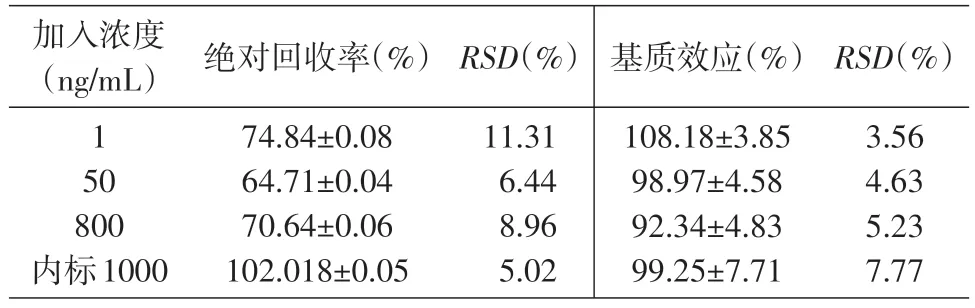
表1 LC-MS/MS测定和厚朴酚及内标的绝对回收率和基质效应(n=4,)
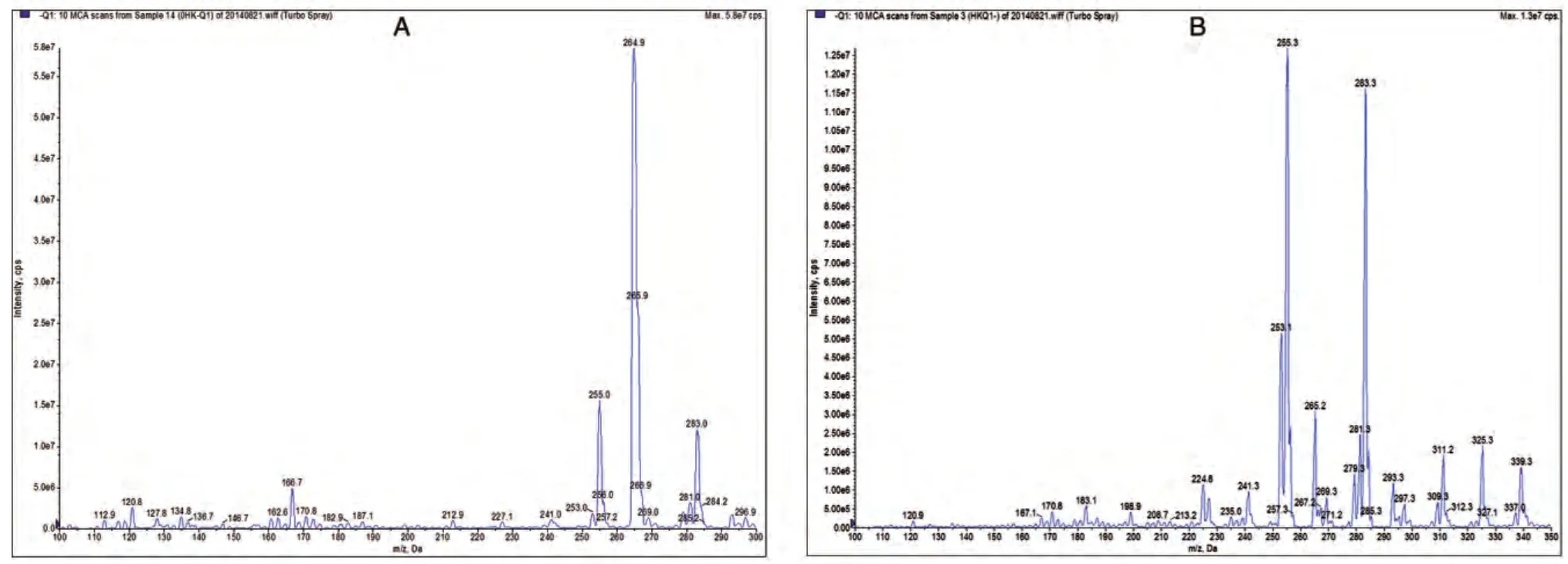
图1 和厚朴酚及内标的一级全扫描质谱图

图2 和厚朴酚及内标的产物离子全扫描质谱图
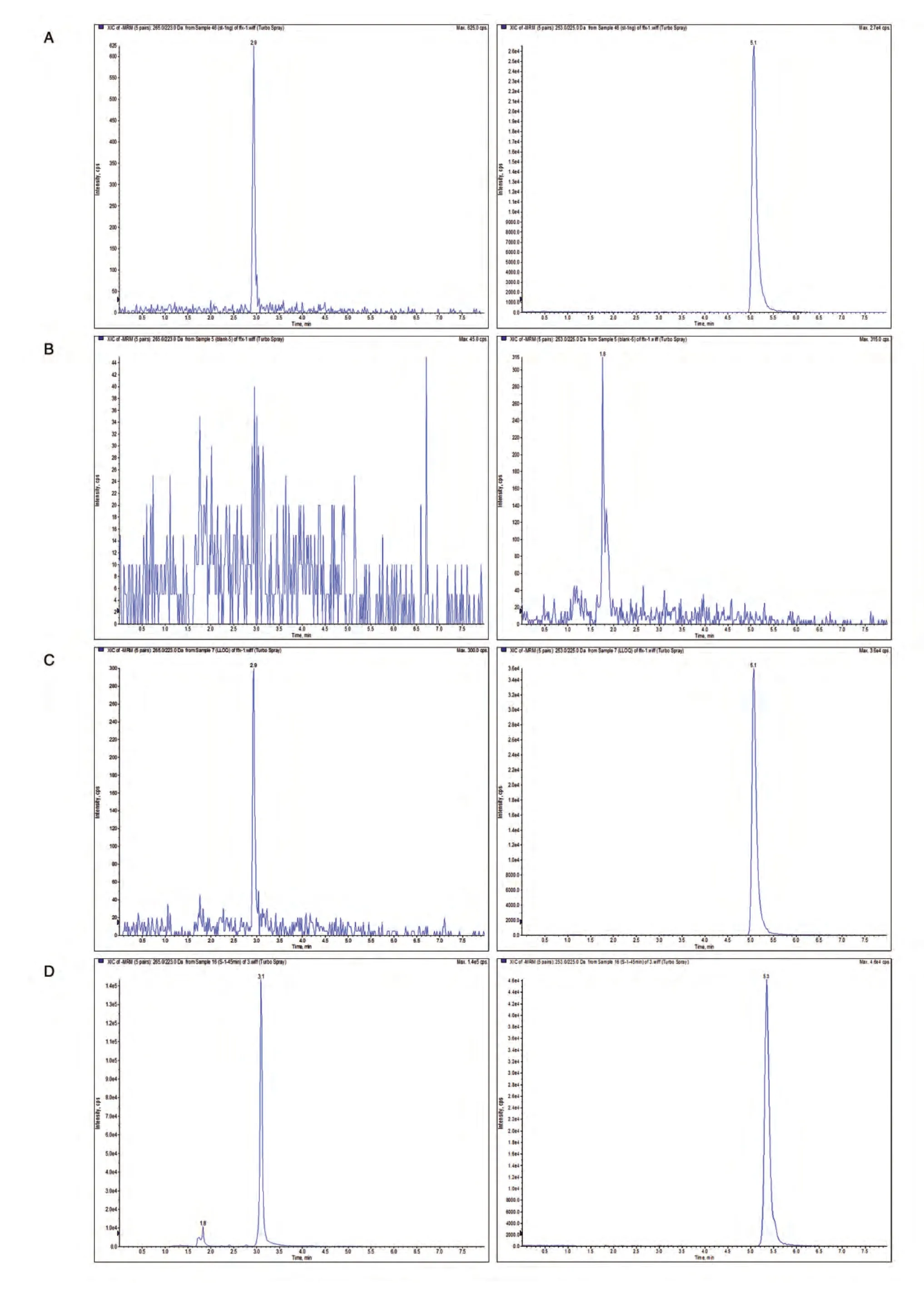
图3 测定和厚朴酚特异性色谱图
2.2.5 稀释效应 用空白血浆配成1000 ng/mL 的含药质控样品,用空白血浆稀释成浓度为200.0、100.0、50.00 ng/mL 的含药样品,每个浓度平行4 份样品,其余按样品处理方法操作进样测定,以测得值与理论值的比值考察稀释效应。结果显示,稀释后其与理论值比值为85.80%~113.86%,无稀释效应。
2.2.6 精密度与准确度 以空白血浆配制1.000、50.00、800.0 ng/mL 的血浆样品,按样品处理方法提取后进样分析,每个浓度平行测定6份样品,此为一个分析批。测定3 个分析批,分别用当日标准曲线计算测得浓度。计算批内和批间的相对标准偏差(RSD),评价方法的精密度及准确度,结果见表2。
2.2.7 稳定性实验 配制1.000、50.00、800.0 ng/mL的含药血浆,分别进行室温稳定性、冻融稳定性及长期稳定性实验,每个样品平行4份,结果见表3。
2.2.8 药代动力学研究 测得数据用Microsoft Excel 2007 软件处理,计算和厚朴酚药代动力学参数。用Microcal Origin 7.0软件做平均血药浓度-时间曲线(图4)。
表4为荷瘤裸鼠单次静脉注射和厚朴酚脂质体后和厚朴酚药代动力学参数。单次静脉注射和厚朴酚脂质体后,和厚朴酚消除相对半衰期T1/2为49.1±6.1 min,AUC(0~360 min)为173073±49503.3 ng/(min·mL),峰浓度Cmax为12915±4022.5 ng/min,平均滞留时间(MRT)为21.1±3.5 min,表明和厚朴酚脂质体在体内释放速率较快。
3 讨论
研究表明,和厚朴酚能以时间及剂量依赖性方式诱导肺癌、结肠癌、乳腺癌等肿瘤细胞的凋亡,在有效的治疗浓度下正常细胞具有良好的耐受性,因而在治疗肿瘤方面有良好的开发潜力[12]。脂质体携带药物具有靶向性强、毒副作用小、运载量大等优点,近年来广泛应用于肿瘤导向治疗。Cheng[13-14]等在组织分布及体内小鼠移植瘤模型上均证明修饰的和厚朴酚脂质体明显优于普通和厚朴酚静脉制剂。
表2 LC-MS/MS测定和厚朴酚的精密度和准确度(n=6,)

表2 LC-MS/MS测定和厚朴酚的精密度和准确度(n=6,)
对于和厚朴酚的检测,常用GC 法[15]、HPLCDAD 法[16]、RP-HPLC 法等。本实验采用LC-MS/MS法,能将质谱的高分辨率、高灵敏度与液相色谱的高分离能力统一起来,提高了灵敏度与检测限。本实验中和厚朴酚及大黄酚在色谱柱中得到很好的分离,且在8 min 内运行完毕,分析速度快,具有高准确度、高灵敏度、样品前处理简单方便的特点,且对样品的需求量少,为临床对和厚朴酚的大样本量药代动力学研究提供了方法学参考。
由于和厚朴酚与内标大黄酚结构中酚羟基的存在[17],其在水溶液中会解离,形成负离子形式,故在检测时采用负离子模式。在进行流动性的优化过程中,使用乙腈与水进行梯度洗脱时,发现峰形拖尾较为严重,由于受试品呈弱酸性,故用甲酸调节酸性对其进行峰形优化,加入不同浓度的甲酸,发现峰形有所改变,但响应值大大减小,甲酸压低了负离子相应信号。一般液质流动性pH值为pKa+2[18],受试品pH值在6 左右,因此,向乙腈中加入适量氨水调节pH值,通过对乙腈中氨水含量及水溶液中氨水含量的不断调整,最终确定0.025%氨水乙腈∶0.025%氨水为流动相。
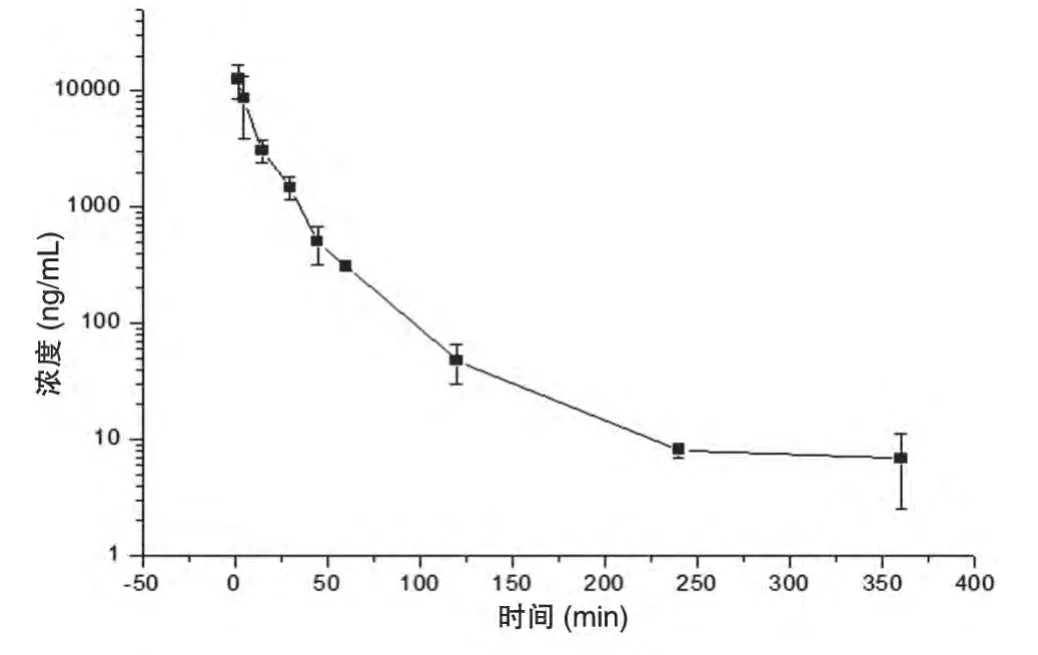
图4 荷瘤裸鼠静脉注射和厚朴酚脂质体后的平均血药浓度-时间曲线(n=6,)
表3 LC-MS/MS测定和厚朴酚的稳定性(n=4,)

表3 LC-MS/MS测定和厚朴酚的稳定性(n=4,)

表4 6组荷瘤裸鼠尾静脉注射20 mg/kg和厚朴酚脂质体后主要药代动力学参数(n=6)
本实验的方法学验证满足了国家食品药品监督管理总局关于生物样品分析方法学验证的要求。荷瘤裸鼠尾静脉注射20 mg/kg 和厚朴酚脂质体后,血浆中和厚朴酚消除相对半衰期和平均滞留时间较短,表明其在体内释药速率较快。血浆中游离和厚朴酚浓度变化还须进一步研究,以期更好地阐明和厚朴酚脂质体的药代动力学特点。
综上,通过优化条件,本实验中样品采用直接沉淀法,操作简单,血浆样品用量仅需45 μL,定量下限为0.500 ng/mL(n=5),分析每个样品仅需8 min,而且该法具有良好的精密度和准确度,适合和厚朴酚脂质体药代动力学研究和血药浓度监测。
[1]雷海军,易宇阳,钟志桦,等.厚朴提取物的稳定性研究[J].安徽农业科学,2014,42(20):6601-6602.
[2]Niemen D C.Exercise upper respiratory tract infection and the immene system[J].Med Sci Sports Exerci,1994,26(2):128.
[3]Chang M C,Jen K L,Shing H L,et al.Characterization of neurotoxic effects of NMDA and the novel neuroprotection by phytopopfenils in mice[J].Behav Neurosci,2010,124(4):541-553.
[4]Arora S,Singh S,Piazza G A,et al.Honokiol:a novel natural agent for cancer prevention and therapy[J].Curr Mol Med,2012,12(10):1244-1252.
[5]Liu H,Zang C,Emde A,et al.Anti-tumor effect of honokiolalone and in combination with other anti-cancer agents in breast cancer[J].Eur J Pharmacol,2008,591(1-3):43-51.
[6]Tian W,Xu D,Deng Y C.Honokiol,a multifunctional tumor cell death inducer[J].Pharmazie,2012,67(10):811-816.
[7]滕鸿,胡敏,刘跃建.和厚朴酚对哮喘小鼠气道重构及VEGF表达水平干预作用的研究[J].中医临床研究,2014,6(27):85-87.
[8]曾宝,吴安国,陈建南,等.HPLC考察和厚朴酚在Caco-2细胞模型的转运特征[J].中国中药杂志,2011,36(10):1286-1290.
[9]吴德强.和厚朴酚脂质体的制备及表征[J].实用中西医结合临床,2014,14(8):86-88.
[10]Weiss J,Decker E A,McClements D J,et al.Solid lipid nanoparticles as delivery systems for bioactive food components[J].Food Biophysics,2008,3(2):146-154.
[11]张宇,白海昕,邵永祥,等.和厚朴酚脂质体联合阿霉素抑制4T1细胞增殖的机制研究[J].中国实验诊断学,2012,16(6):983-985.
[12]Fang W F,Tse A K,Poon K H,et al.Magnolol and honokiol enhance HL-60 human leukemia cell differentiation induced by1,25-dihydroxyviamin D3 and retinoic acid[J].Int J Biochem Cell Biol,2005,37:427.
[13]Wang X H,Deng L Y,Cai L L,et al.Preparation,characterization,pharmacokinetics,and bioactivity of honokiol-in-hydroxypropyl-β-cyclodextrin-in-liposome[J].J Pharm Sci,2011,100(8):3357-3364.
[14]Cheng N,Xia T,Han Y,et al.Synergistic antitumor effects of liposomal honokiol combined with cisplatin in colon cancer models[J].Oncol Lett,2011,2(5):957-962.
[15]赵磊,邓莹,李岩,等.GC 法同时测定利胆排石片中厚朴酚及和厚朴酚含量[J].解放军药学学报,2014,30(3):237-241.
[16]薛珍珍,晏仁义,余盛贤,等.HPLC-DAD测定厚朴中6种活性成分的含量[J].中国实验方剂学杂志,2014,20(22):45-49.
[17]Byung H K,Jae Y C.Anti-inflammatory effect of honokiol is mediated by PI3K/Akt pathway suppression[J].Acta Pharmacol Sin,2008,29(1):113-122.
[18]Bonfiglio R,King R C,Olah T V,et al.The effects of sample preparation methods on the variability of the electrospray ionization response for model drug compounds[J].Rapid Commun Mass Spectrom,1999,13(12):1175-1185.

