北极海洋沉积物高抗氧化活性菌株的筛选及其多样性分析*
王 桢,李 阳,车 帅,林学政*
(1.国家海洋局 第一海洋研究所,山东 青岛266061;2.国家海洋局 海洋生物活性物质重点实验室,山东 青岛266061)
极地是地球生物圈中重要的组成部分之一,极地微生物能够适应各种强胁迫条件而快速生长和繁殖,是巨大的基因遗传变异库[1],也为人们寻找新的微生物或筛选新的活性代谢产物提供了丰富的种质资源[2]。特殊的极地环境造就了极地微生物特殊的生物学特征及竞争优势。栖息于极地的细菌,为了适应恶劣的环境条件,必须采用独特的生存策略来获得生存优势[3]。极地由于臭氧空洞的存在,使UV-B辐射增强,可诱导生物细胞内活性氧的产生;酷寒的自然环境,使得海水中溶解氧含量升高[4];除此之外,有研究证明,冷胁迫往往伴随着细胞内氧胁迫的增加而增加[5]。因此,极地微生物必然逐渐形成高水平的氧化应激反应来对活性氧产生较强的耐受性,以此适应特殊的生存环境。
活性氧会导致脂质过氧化反应,以此破坏膜的流动性,使线粒体凋亡[6];对特定的氨基酸序列进行修饰,裂解肽链使酶失活,对蛋白质造成氧化损伤。活性氧还可造成基因缺失、突变等影响[7]。生物体利用氧化应激反应来消除活性氧的损害[8],而适当补充外源性抗氧化剂可清除自由基,阻断脂质过氧化反应,保持食物品质、治疗或缓解病症。因此,发展和应用更多有效的天然来源抗氧化剂正日益受到人们的关注。韩乐琳等[9]对南极地衣提取物的抗氧化能力进行了初步研究,结果表明南极地衣具有较高的抗氧化活性;阎雪芬等[10]对分离自北极海洋沉积物的81株真菌进行了抗氧化活性的筛选,其中7株对活性氧具有抑制作用;而其对93株红树林的内生真菌也进行了抗氧化的筛选,仅有1株具有抑制活性氧的作用,以上结果表明,海洋真菌是产生抗氧化活性物质的重要来源。Pereira等[11]对从南极发草、南极漆姑草和桧叶金发藓的提取物进行了抗氧化活性的研究,发现其能明显减少脂质过氧化反应,具有明显的抗氧化特性。而对微生物特别是北极细菌抗氧化活性的研究报道较少[12-13]。
本文对分离自中国第五次北极科考采取的海洋沉积物的细菌进行了具抗氧化性活性菌株的筛选,并进一步测定了其对DPPH自由基、羟自由基和超氧阴离子的清除能力;利用16SrRNA基因对其进行了分子鉴定与系统发育分析,以期为了解极地微生物的抗氧胁迫机制及极地来源的新型生物活性物质的研发打下一定的基础。
1 材料与方法
1.1 材料
北极海域海洋沉积物样品为2012-07-09中国第五次北极科学考察采集,对箱式采样器和重力采样器采到的海洋沉积物样品,用无菌药匙采集后置于无菌封口袋中,于雪龙船现场进行可培养细菌的分离纯化并于4℃保存,回实验室后进行进一步的分离纯化培养与鉴定。
海水Zobell 2216E培养基(1 000mL):蛋白胨5g,酵母粉1g,琼脂粉15g,V(过滤原位海水)∶V(自来水)=1∶2。
1.2 具有H2O2耐受性的活性菌株的筛选
向Zobell 2216E液体培养基中添加适量H2O2使其终浓度为1.0mmol/L后作为实验组,对照组则加入等量蒸馏水;按体积分数1%的接种量接入过夜活化的菌株,于10℃,150r/min振荡培养24h后利用分光光度计于600nm下测其培养液OD值[20]。以实验组OD值/对照组OD值×100%>60%为依据,筛选具有高H2O2耐受性的细菌。
1.3 活性菌株的抗氧化能力检测
将筛选到的活性菌株活化后接种于Zobell 2216E液体培养基中,于10℃,150r/min振荡培养24h,培养液经6 000r/min,4℃离心10min后,收集菌体经PBS缓冲液两次洗涤后,再将菌体细胞重悬,调整细胞浓度为1.0×109个/mL,以此作为样品溶液,待测其对DPPH自由基、羟自由基、超氧阴离子的清除能力。
1.3.1 DPPH自由基清除能力的测定
取样品2mL,加入0.2mmol/L DPPH和无水乙醇1mL,混匀后在室温下避光反应30min,并在6 000 r/min下离心10min,取上清液于517nm测定其吸光度,与待测液相同体积浓度为1mmol/L的抗坏血酸做阳性对照,空白组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液,并以等体积蒸馏水和无水乙醇混合液空白调零,于517nm分别测定其吸光度[14]。DPPH自由基的清除率为:
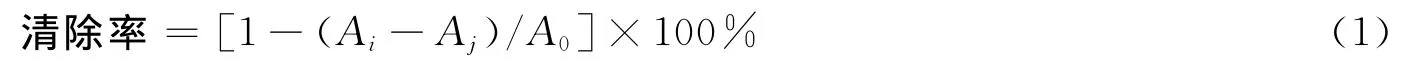
式中,A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度。
1.3.2 羟自由基(HO·)清除能力的测定
在具塞试管中依次加入1mL 5mmol/L硫酸亚铁溶液,1mL 5mmol/L水杨酸-乙醇溶液,1mL 3mmol/L双氧水溶液,混匀后加入0.5mL的待测样品,用双蒸水补齐至刻度10mL,在(37±0.1)℃的恒温水中反应15min后,6 000r/min离心10min,然后以双蒸水作参比,在510nm下测定吸光度[15]。与待测液相同体积浓度为1mmol/L的抗坏血酸做阳性对照。清除率计算式为:

式中,A0为空白组的吸光度;Ax为加入待测溶液后的吸光度。
1.3.3 超氧自由基清除能力的测定
取4.5mL 0.1mol/L Tris-HCl缓冲液(pH=8.2)于试管中,依次加入1.0mL 1.0mmol/L EDTA,1.0mL待测菌液,2.4mL蒸馏水。于25℃水浴反应10min,再加入2.0mL 9mmol/L邻苯三酚准确反应60min后,加入0.1mL 12.0mol/L HCl终止反应,于325nm 处测定吸光度(As)[16]。与待测液相同体积浓度为1mmol/L的抗坏血酸做阳性对照。对照以1.0mL蒸馏水代替样品,操作方法同样品管,测得吸光度(Ac)。超氧自由基清除率:

式中,Ac为对照组的吸光度;As为样品组的吸光度。
1.4 分子鉴定与系统发育分析
16SrRNA基因扩增中的DNA模板的制备和PCR引物参照文献[17]进行。
反应条件:95℃,5min;95℃,1min,55℃,30s,72℃,1.5min,30个循环;72℃延伸7min。PCR产物送至南京金斯瑞生物股份有限公司进行纯化和测序。测序获得的16SrRNA基因序列在National Center for Biotechnology Information(NCBI)进行BLAST分析。序列比对采用BioEdit的多序列比对排列(Clustalw multiple alignment),系统发育分析采用 MEGA 4.0软件的邻接法(Neighbor-joining method)。利用EzTaxon-e Database检索与活性菌株相似性最高的模式菌株,并与模式菌株的16SrRNA基因相似性进行比较(http:∥eztaxon-e.ezbiocloud.net)[18]。
2 结果与分析
2.1 抗氧化活性菌株的筛选结果
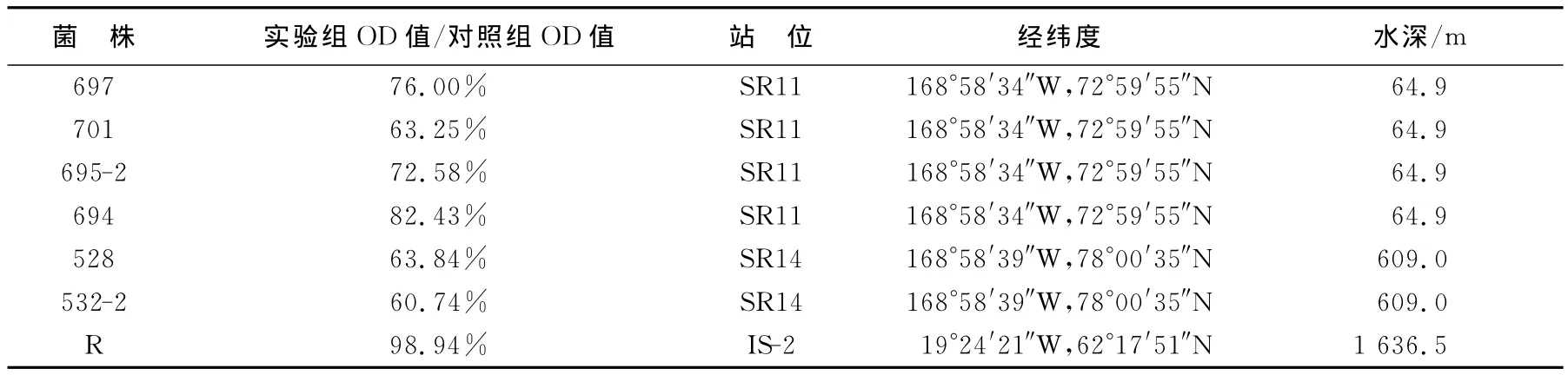
根据H2O2耐受性实验,对实验室保存的145株北极海洋沉积物细菌进行了抗氧化活性菌株的筛选。以实验组OD值/对照组OD值×100%>60%作为菌株具有强抗氧化性的依据,共筛选出25株具有高H2 O2耐受性的菌株,有关实验结果和采样信息见表1。可见,筛选到的活性菌株的实验组OD值/对照组OD值为62.63%~140.00%;值得指出的是,1mmol/L H2O2似乎对菌株563和720-2的生长具有一定的促进作用,其原因值得进一步研究。25株抗氧化活性菌株分离自12个站位中,水深从19~3 540m不等,由此可见,在北极海洋沉积物这一特殊生境中,广泛分布着抗氧化细菌。

表1 H2O2耐受实验结果及采样信息Table 1 Results of hydrogen peroxide tolerance test and locations of samplings
续表
2.2 DPPH自由基、羟自由基(HO·)和超氧自由基清除能力的测定
由表2可见,25株活性菌株对DPPH自由基、羟自由基(HO·)和超氧自由基的清除能力:25株活性菌株对DPPH自由基有着不同的清除效率,清除率为25.36%~84.15%,其中以菌株563的清除率最高,可达84.15%;25株活性菌株对HO·也具有较强的清除能力,清除率在65.72%~88.61%之间;其中菌株567的清除能力最强,可达88.61%;通过邻苯三酚自氧化法测定活性菌株的超氧自由基清除能力的研究结果也表明,25株菌株均对其有着一定的清除作用,但清除能力相对较弱,清除率为11.25%~45.77%,其中以菌株763-1超氧自由基的清除率最高,可达45.77%。
总体来说,菌株563对DPPH自由基、羟自由基(HO·)和超氧自由基清除能力都具有较好的清除作用,清除率分别为84.15%,70.71%,42.46%;菌株630对3种自由基也都具有较好的清除作用,清除率分别为83.89%,78.91%,45.56%。菌株563和630的抗氧化特性值得进一步研究。

表2 25株活性菌株对自由基清除能力的测定Table 2 Results of antioxidant activity of 25isolated antioxidative strains
2.3 活性菌株的系统发育分析
对25株抗氧化活性菌株的16SrRNA基因序列采用BioEdit软件进行序列比对,然后利用MEGA 4.0软件的邻接法,构建25株抗氧化菌株及其同源性较高的模式菌株的系统发育树(图1)。由图1可见,筛选到的抗氧化活性菌株有着丰富的种类多样性。从纲水平上来说,25株活性菌株分属于细菌域的5个纲,其中有14株属于γ-Proteobactria纲,占总菌株的56%,为优势种群;4株属于α-Proteobacteria纲,占16%;4株属于Actinobacteria_c纲,占16%;有2株属于Bacilli纲,占总菌数的8%;还有1株属于Flavobacteria纲,占4%。从属水平上来说,25株细菌分属于15个属,其中假交替单胞菌属(Pseudoalteromonas)多样性最高,含4株菌,其次为盐细菌属(Salinibacterium),含有3株菌。种水平上,25株细菌分属于20个种,多样性丰富。
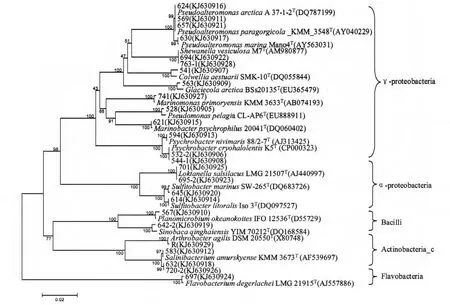
图1 基于16SrRNA基因序列的具有抗氧化活性菌株的系统发育树Fig.1 Phylogenetic tree of the bacteria with antioxidant activity based on the partial 16SrRNA gene sequences
3 讨论
极地微生物不仅要适应低温,也需要抵御其他胁迫条件如紫外辐射等[19]。为了在极端环境中得以生存,这些微生物必然形成不同抗氧化系统去抵抗由活性氧引起的氧化胁迫。本文通过对来自北极深海沉积物中的145株菌株进行了抗氧化性菌株的筛选,获得了25株抗氧化性较强的菌株;并采用DPPH自由基、羟自由基和超氧自由基清除能力实验综合评价了其抗氧化能力。三组实验从多个角度对菌株抗氧化性能进行了测试,结果表明,对H2O2具有较强耐受性的活性菌株,对DPPH自由基、羟自由基和超氧自由基均有着一定的清除能力,但对三者的清除能力没有必然联系,不存在线性关系。
目前,对抗氧化菌株的筛选及其生物活性物质的研究主要集中于乳酸杆菌,如张凤敏等[20]从传统发酵食品中筛选出两株对过氧化氢耐受能力较强的乳酸菌,并研究了其对DPPH自由基和羟自由基的清除能力,表明这两株乳酸菌对DPPH自由基和羟自由基都具有一定的清除能力。海洋抗氧化菌株的研究主要集中于真菌,如陈霞等[21]对8株来源于东海海洋的真菌提取物进行了抗氧化和抗肿瘤活性筛选,表明海洋真菌是潜在的活性代谢产物的重要来源。在极地微生物方面,则多集中于色素的抗氧化研究,如Daniela等[22]对从南极土地杆菌属细菌Pedobactersp.中提取的混合色素进行抗氧化能力的检测,表明这些色素具有极强的抗氧化能力。本文样品取自具有强烈促氧化作用的北极生态系统,筛选到的抗氧化活性菌株的DPPH自由基清除率的范围为25.36%~84.15%,羟自由基(HO·)清除率在65.72%~88.61%;而张凤敏等[20]对筛选出的两株高抗氧化活性乳酸菌对DPPH自由基和羟自由基(HO·)清除率最高仅分别为37.18%和10%。由此可见,本实验获得的活性菌株清除DPPH自由基和清除羟自由基能力更强。
研究结果表明,在极地海洋沉积物这一特殊的生境,广泛分布着抗氧化活性菌株,且其种类多样。从145株北极海洋沉积物微生物中分离到25株抗氧化活性菌株,比例可达17.2%;对25株活性菌株的分子鉴定与系统发育表明,γ-Proteobacteria纲细菌数量最多,含14株,占总分离菌数的56%,物种多样性也最为丰富,含有12个种,占所有种的60%;其次有4株属于α-Proteobacteria纲,数量占总分离菌数的16%,分属于3个种,占所有种比例达到15%;Actinobacteria_c纲筛选得到4株,放线菌与人类关系密切,目前广泛应用的抗生素约70%是各种放线菌所产生。一些特殊的放线菌还能产生各种酶制剂、维生素和有机酸等。因此对北极地区放线菌次级代谢产物的研究具有重大的理论意义和应用价值。
极地特殊的环境条件造就了极地微生物特殊的生物学特征及竞争优势,栖息于极地的细菌,为了适应恶劣的环境条件,必须采用独特的生存策略来获得生存优势[23],这使其将成为研究低温生物学的良好试验材料及新型活性物质的重要的潜在来源。有关极地微生物的资源勘探与代谢活性产物研发,已成为国际微生物学领域研究的热点之一[24-25]。本文表明,北极蕴含着强抗氧化的细菌种质资源,并具有极好的多样性和丰富性。本文所获结果有助于人们认识和开发北极这一特殊海域的抗氧化微生物资源,加速海洋微生物抗氧化活性物质的开发利用。
致谢:中国第五次北极考察队采集样品及数据。
(References):
[1]BOWLER C,KARL D M,COLWELL R R.Microbial oceanography in a sea of opportunity[J].Nature,2009,459(7244):180-184.
[2]RUSSO R,GIORDANO D,RICCIO A,et a1.Cold-adapted bacteria and the globin case study in the Antarctic bacteriumPseudoalteromonashaloplanktisTAC125[J].Marine Genomics,2010,3(3-4):125-131.
[3]GIUDICE A L,BRUNI V,MICHAUD L.Characterization of Antarctic psychrotrophic bacteria with antibacterial activities against terrestrial microorganisms[J].Journal of Basic Microbiol,2007,47(6):496-505.
[4]HERMES L M,ZENTENO S T.Animal responses to drastic changes in oxygen availability and physiological oxygen stress[J].Comparative Biochemistry and Physiology,2002,1334(4):537-556.
[5]GOCHEVA Y G,TOSI S,KRUMOVA E T,et al.Temperature downshift induces antioxidant response in fungi isolated from Antarctic[J].Extremophiles,2009,13(2):273-281.
[6]GREEN D R,REED J C.Mitochondria and apoptosis[J].Science,1998,281(5381):1309-1312.
[7]IMLAY J A.Pathways of oxidative damage[J].Annual Review of Microbiology,2003,57:395-418.
[8]LOPEZ M G,ELNITSKY M A,BENOIT J B,et a1.High resistance to oxidative damage in the Antarctic midgeBelgicaantarcticaand developmentally linked expression of genes encoding superoxide dismutase,catalase and heat shock proteins[J].Insect Biochemistry and Molecular Biology,2008,38(8):796-804.
[9]HAN L L,WEI J C.A preliminary study on antioxidant ability of Antarctic lichen extract[J].Institute of Microbiology,2009,28(6):846-849.韩乐琳,魏江春.南极地衣提取物抗氧化能力的初步研究[J].菌物学报,2009,28(6):846-849.
[10]YAN X F,HUANG D H,DAI Y B,et a1.Study on antioxidant activity of marine fungi[J].Journal of Xiamen University:Natural Science,2007,46(3):418-421.阎雪芬,黄丹虹,代宇博,等.海洋真菌抗氧化活性物质的初步研究[J].厦门大学学报:自然科学版,2007,46(3):418-421.
[11]PEREIRA B K,ROSA R M,SILVA J D,et al.Protective effects of three extracts from Antarctic plants against ultraviolet radiation in several biological models[J].Journal of Photochemistry and Photobiology B:Biology,2009,96:117-129.
[12]YAN X,NAGATA T,FAN X.Antioxidative activities in some common seaweeds[J].Plant Foods for Human Nutrition,1998,52(3):253-262.
[13]RUPEREZ P,AHRAZEM O,LEAL J A.Potential antioxidant capacity of sulfated polysaccharides from the edible marine brown seaweed fucus vesiculosus[J].Journal of Agricultural and Food Chemistry,2002,50(4):840-845.
[14]HUANG S S,LIU J,ZHAO Z.Study on antioxidative activity of two lactic acid bacteria[J].China Dairy Industry,2010,38(10):8-27.黄珊珊,刘晶,赵征.植物乳杆菌和德氏乳杆菌保加利亚亚种菌体外抗氧化活性的对比研究[J].中国乳品工业,2010,38(10):8-27.
[15]LI Z Y,ZHANG H R,LIANG H Y.Comparison of the elimination of hydroxyl free-radicals by five kinds of wines[J].Liquor-Making Science &Technology,2006,4:26-28.李志英,张海荣,梁会艳.5种葡萄酒清除羟自由基的比较[J].酿酒科技,2006,4:26-28.
[16]LIU T W,PAN D D.Screening of lactic acid bacteria with antioxidant acitivity[J].Food Science,2011,32(19):125-129.刘天祎,潘道东.抗氧化活性乳酸菌的筛选[J].食品科学,2011,32(19):125-129.
[17]SUN F Q,WANG B J,LI G Y,et al.Diversity of bacteria isolated from the South China Sea sediments[J].Acta Microbiologica Sinica,2008,48(12):1578-1587.孙风芹,汪保江,李光玉,等.南海南沙海域沉积物中可培养微生物及其多样性分析[J].微生物学报,2008,48(12):1578-1587.
[18]KIM O S,CHO Y J,LEE K,et al.Introducing EzTaxon-e:aprokaryotic 16SrRNA Gene sequence database with phylotypes that represent uncultured species[J].International Journal of Systematic and Evolutionary Microbiology,2012,62:716-721.
[19]SMITH R C,PREZELIN B B,BAKER B S,et al.Ozone depletion:ultraviolet radiation and phytoplankton biology in antarctic waters[J].Science,1992,255(5047):952-959.
[20]ZHANG F M,TIAN F M,CHEN W,et al.Screening of antioxidative lactic acid bacteria[J].China Dairy Industry,2007,35(2):4-7.张凤敏,田丰伟,陈卫,等.具抗氧化活性乳酸菌的筛选[J].中国乳品工业,2007,35(2):4-7.
[21]CHEN X,YI Y,ZHAO M R.Screening of antioxidative and antitumor activities of eight marine fungi[J].Chinese Journal of Marine Drugs,2012,31(2):1-6.陈霞,易喻,赵美蓉.8株海洋真菌的抗氧化和抗肿瘤活性筛选[J].中国海洋药物杂志,2012,31(2):1-6.
[22]DANIELA N,CORREA L,MAXIMILIANO J,et al.Antioxidant capacity of novel pigments from an Antarctic bacterium[J].The Journal of Microbiology,2012,50(3):374-379.
[23]GIUDICE A L,VIVIA B,MICHAUD L.Characterization of Antarctic psychrotrophic bacteria with a ntibacterial activities against terrestrial microorganisms[J].Journal of Basic Microbiology,2007,47(6):496-505.
[24]MARX J C,COLLINS T,D'AMICO S,et al.Cold-adapted enzymes from marine Antarctic microorganisms[J].Marine Biotechnology,2007,9(3):293-304.
[25]VARDHAN REDDY P V,SHIVA NAGESWARA RAO S S,PRATIBHA M S,et al.Bacterial diversity and bioprospecting for coldactive enzymes from culturable bacteria associated with sediment from a melt water stream of Midtre Loenbreen glacier,an Arctic glacier[J].Research in Microbiology,2009,160(8):538-546.

