四川省不同来源核盘菌菌株的可溶性蛋白和酯酶同工酶的电泳图谱分析
李沛利, 刘 丹, 叶华智, 严吉明
(四川农业大学农学院, 成都 611130)
四川省不同来源核盘菌菌株的可溶性蛋白和酯酶同工酶的电泳图谱分析
李沛利, 刘 丹, 叶华智, 严吉明*
(四川农业大学农学院, 成都 611130)
选取四川省不同地区、不同寄主、代表不同致病性水平和不同菌丝体亲和性表现的核盘菌(Sclerotiniasclerotiorum)菌株进行可溶性蛋白和酯酶同工酶电泳分析,结果表明:不同寄主来源、不同致病性水平、不同菌丝体亲和性表现的核盘菌菌株间的可溶性蛋白和酯酶同工酶电泳图谱条带数量及分布相对稳定,仅部份弱带在出现频率、染色强度或迁移距离上有一定的变化,表现出种的特征和种内的异质性,在分类上具有一定的意义,可溶性蛋白和酯酶同工酶电泳分析可作为核盘菌分类和遗传多样性分析的一个生化指标。
核盘菌; 电泳分析; 可溶性蛋白; 酯酶同工酶
蛋白质(包括酶)是基因表达的产物,其电泳图谱的差异在一定程度上反映了菌株间的遗传差异,这种差异受生理因素和环境条件的影响较小,而与供试菌株的亲和群、致病性或菌株来源有一定的相关性[1-6],这种相关性在不同病原菌中表现不同。Reynolds等[1]的研究表明,不同立枯丝核菌(Rhizoctoniasolani)融合群(AG1~AG5)间的可溶性蛋白图谱差异显著,而相同融合群内菌株的可溶性蛋白图谱存在一定相似性。刘曙照等[2]研究发现,稻瘟病菌(Pyriculariaoryzae)各生理小种群、生理小种乃至相同生理小种不同菌株间的可溶性蛋白图谱都存在不同程度的差异。伍光庆等[3]的研究表明,不同菌株的可溶性蛋白、酯酶和酸性磷酸酯酶的谱带差异与病菌的致病性不直接相关。胡春锦等[4]发现引起水稻纹枯病的立枯丝核菌(R.solani)的AG-l-IA融合群的可溶性蛋白图谱条带数目与菌株致病力强弱成正比。赵桂东等[5]发现,江苏大麦纹枯病菌(Rhizoctoniacerealis)的酯酶图谱与菌丝融合群或亚群大体一致,根据酶谱划分的菌株类型与地理分布有一定的联系,而与菌株的致病力无关。赵小明等[6]发现,引起棉花黄萎病的大丽轮枝菌(Verticilliumdahliae)不同致病类型的菌系有独特的酯酶同工酶谱,并与营养体亲和群有一定的关系。
核盘菌(Sclerotiniasclerotiorum)是世界分布的寄生物,可侵染作物引起菌核病。将蛋白质和酶用于核盘菌种群结构的研究,国内外已有报道,Russo等[7]在核盘菌菌核中发现了一种在营养菌丝中没有或含量很低的特异性蛋白(development-specific protein),认为这种蛋白在核盘菌的生活史中可作为一种贮藏蛋白,合成菌核萌发所需的氮源或氨基酸。Petersen等[8]对近源的核盘菌(S.sclerotiorum)、小核盘菌(S.minor)和三叶草核盘菌(S.trifoliorum)进行电泳分析发现,这3个种的菌核中都含有这种特异蛋白,其中小核盘菌的development-specific proteins迁移率略大于另外2种。刘万仁等[9]将同工酶电泳分析结果作为分类地位有分歧的核盘菌种类微观鉴定的辅助依据,为核盘菌种内分化鉴定提供了新指标,并发现核盘菌种群南方菌系与北方菌系的可溶性蛋白稍有差异。李新凤等[10]发现,对腐霉利表现不同抗性水平的6株菌株间,蛋白质及酯酶图谱存在明显差异。迄今,对不同寄主来源、不同致病性水平、不同菌丝体亲和性表现的核盘菌菌株间的电泳图谱有无差异还缺乏全面的研究。
四川是受菌核病危害较为严重的一个地区,除了油菜外,莴苣、向日葵、白芷、板蓝根、益母草、红花等蔬菜和药用植物受到的危害也较重。因此,本研究选取四川省不同地区,不同寄主,代表不同致病性水平和不同亲和性表现的核盘菌菌株进行可溶性蛋白和酯酶同工酶电泳分析,以确定四川省不同来源的核盘菌菌株间的电泳图谱有无差异,为掌握四川省核盘菌的遗传多样性及抗病育种提供依据。
1 材料与方法
1.1 供试菌株
供试的15个核盘菌(S.sclerotiorum)菌株分别代表不同致病性水平[11]和不同菌丝体亲和性[12],其中,14个来自四川省不同地区,1个来自内蒙古,菌株编号见表1。以寄主为泽泻,疑似为小核盘菌(S.minor)的菌株(编号为91)为参照。
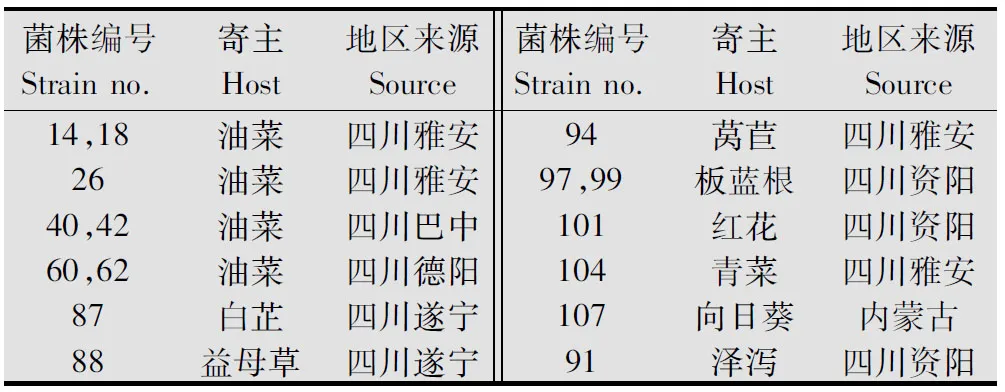
表1 供试菌株
1.2 样品制备
将各菌株接种在PDA平板上,20 ℃培养1个月,收集菌核。用无菌水浸洗24 h后用提取缓冲液(Tris-Gly,pH 8.3)浸洗30 min,吸干菌核上的水分,置于-20 ℃下冷冻备用。制样时加入3倍菌核体积的提取缓冲液及少许酸洗过的石英砂,在冰上研磨匀浆,4 ℃,15 000 r/min离心2次,每次30 min,所得上清液立即使用或保存于-20 ℃[9]。
1.3 可溶性蛋白电泳分析
采用不连续的垂直板聚丙烯酰胺凝胶电泳系统[13],浓缩胶浓度为5%(pH 6.8),分离胶浓度为10%(pH 8.8),均为过硫酸铵聚合,电泳缓冲液为Tris-Gly (pH 8.3)。电泳在4 ℃下进行,稳压输出,初始电压80 V,待溴酚蓝指示剂进入分离胶后调电压为160 V。电泳完毕后立即剥胶,用0.25%考马斯亮蓝R250染色至条带清晰,随后用7%的乙酸脱色数次至谱带清楚后照相,计算相对迁移率[14],相对迁移率Rf=蛋白质分子迁移距离(cm)/染料迁移距离(cm)。每个菌株重复试验3次。
1.4 酯酶同工酶电泳分析
采用和1.3相同的电泳系统和电泳条件,染色方法参考吴少伯等[15]的方法,待出现清晰条带后用蒸馏水冲洗胶板,保存于7%的乙酸中供观察、照相。
2 结果与分析
2.1 核盘菌可溶性蛋白电泳分析
测定结果表明,供试菌株的可溶性蛋白条带数介于8~14条之间,在凝胶的上、中、下各部都有分布,其中多条为着色快、色泽深的主蛋白带。由图1可知,带P1(相对迁移率Rf=0.32)、P2(相对迁移率Rf=0.43)、P4(相对迁移率Rf=0.69)和P5(相对迁移率Rf=0.74)稳定地出现在15个核盘菌(S.sclerotiorum)中,在疑似为小核盘菌(S.minor)的菌株(编号91)中没有出现,可认为是核盘菌菌株的特异性谱带。带P3(相对迁移率Rf=0.49)是16个供试菌株共有的,只是在菌株91中表现为唯一的主蛋白带,而在15个核盘菌菌株中该谱带颜色的宽度和深度有所变化(在8个菌株中表现为1级带,在7个菌株中表现为2级带)。表明15个核盘菌菌株的可溶性蛋白条带数量及分布相对稳定,仅部份弱带在不同菌株间出现的频率、迁移距离或染色强度上有所变化;菌株91与供试核盘菌菌株既有同源性又有区别。
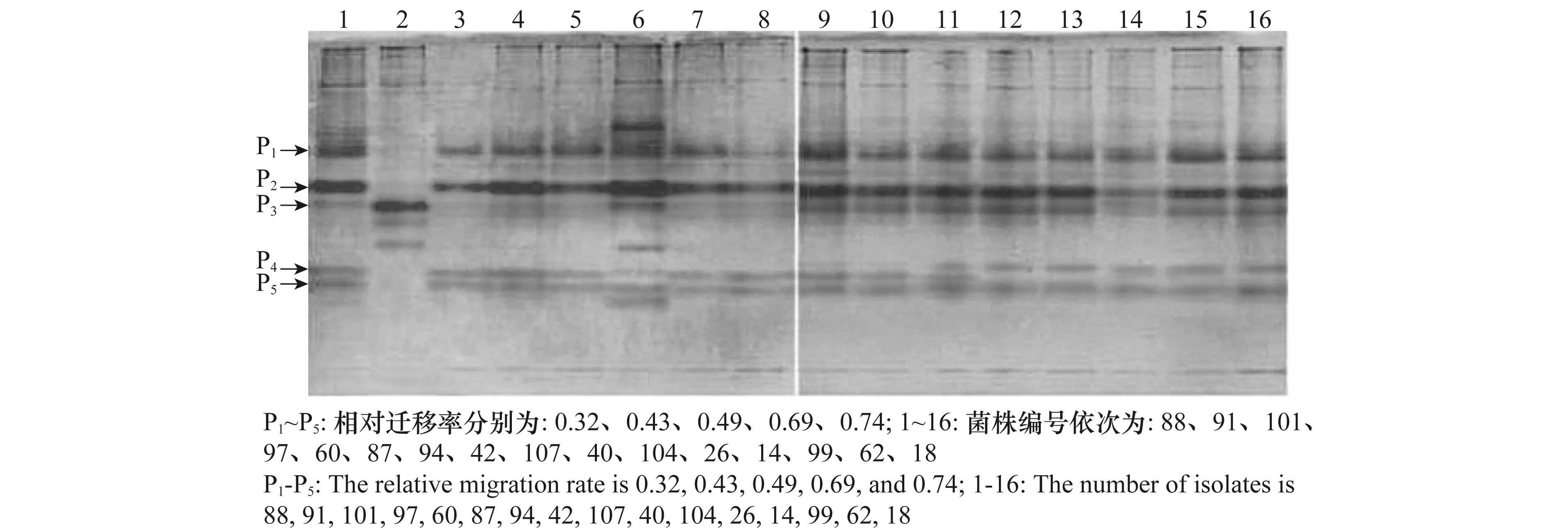
图1 核盘菌可溶性蛋白电泳图谱Fig.1 Electrophoretic patterns of soluble proteins of Sclerotinia sclerotiorum
2.2 酯酶同工酶电泳分析
从图2可以看出,供试菌株的酯酶同工酶酶带均位于凝胶的中下部,且酶带较少(仅2~3条)。菌株91具有3条核盘菌(S.sclerotiorum)菌株没有的特异性条带,其中E2(相对迁移率Rf=0.65)和E5(相对迁移率Rf=0.87)为1级带,E1(相对迁移率Rf=0.47)为2级带,说明菌株91的酯酶同工酶酶谱与核盘菌菌株有明显的区别。染色较深的1级带E3(相对迁移率Rf=0.72)和染色较浅的3级带E4(相对迁移率Rf=0.78)稳定出现在15个核盘菌菌株中,充分体现了供试的15个核盘菌菌株的同源性,带E3和E4可视为核盘菌的特异性谱带。另外少数菌株还具有一条染色较浅的3级带E6(相对迁移率Rf=0.95),说明供试核盘菌菌株在遗传背景上也存在一定的差异。
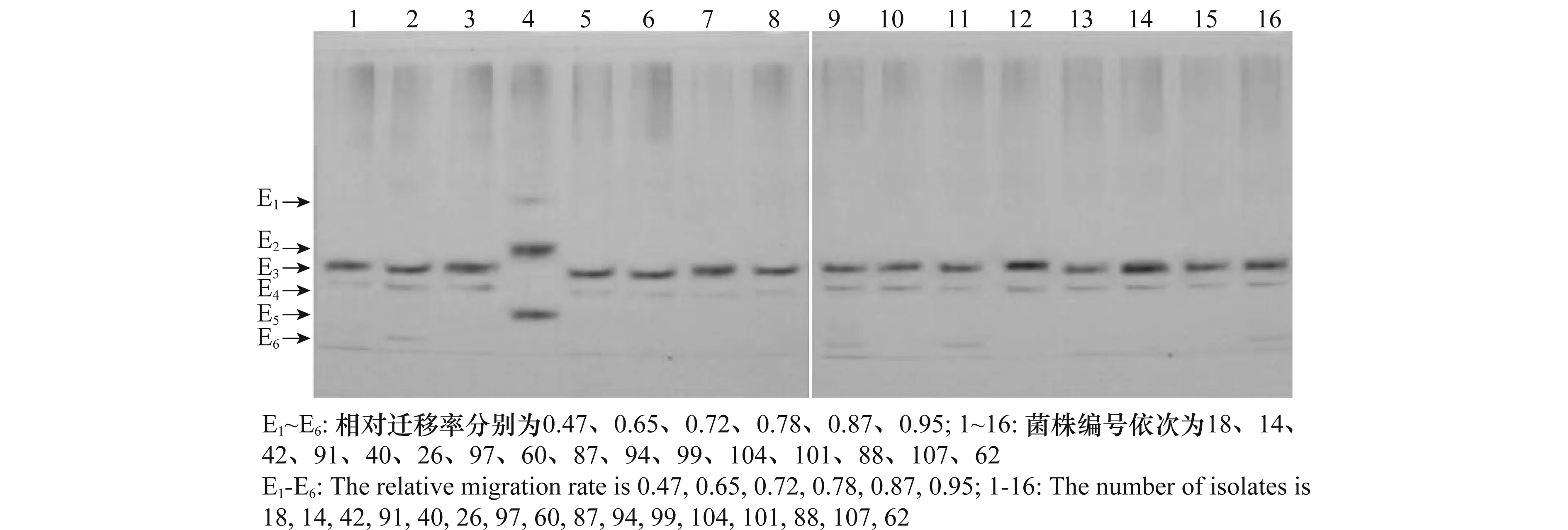
图2 核盘菌酯酶同工酶电泳图谱Fig.2 Electrophoretic patterns of esterase isozyme of Sclerotinia sclerotiorum
3 讨论
可溶性蛋白和同工酶电泳分析可在群体、种及种下水平对样品进行分析,从而澄清一些有争议的类群或作为一些类群分类的辅助手段[16],该方法在许多菌物分类和鉴定中已得到了应用[1-6],在核盘菌中的应用也有一些报道[7-10]。本试验对16个供试菌株进行电泳分析发现,疑似为小核盘菌(S.minor)的菌株与15个核盘菌(S.sclerotiorum)菌株的可溶性蛋白酶谱和酯酶同工酶酶谱在表现差异的同时,也显示出彼此的亲缘关系,参考形态学特征及相对迁移率[8],菌株91应属于小核盘菌(S.minor)。由电泳图谱还可以看出,15个核盘菌(S.sclerotiorum)菌株都含有一条色泽深,着色快的主蛋白带P2,说明该条带在15个核盘菌菌株中含量都较高。根据相对迁移率推测该蛋白带可能就是Russo等人发现的特异性蛋白的谱带[7],也是核盘菌中较为保守的特异性条带。
供试的14个核盘菌菌株来自四川省不同地区、不同寄主、具有不同致病性水平、不同菌丝体亲和性表现,它们的可溶性蛋白和酯酶同工酶谱带数量及分布相对稳定,仅某些弱带在不同菌株间出现的频率、染色强度或迁移距离有一定的变化,说明四川省核盘菌菌株的可溶性蛋白酶谱和酯酶同工酶酶谱在种内差异较小,Casale对世界各地的核盘菌属真菌的分离物总蛋白和11种不同酶的电泳分析也得出了相似的结论[17]。
核盘菌群体的遗传多样性,还可通过分子标记技术进行测定[18-21]。刘晓红[18]用9个随机引物对川西平原30个不同菌丝体亲和群(MCGS)的油菜核盘菌菌株进行RAPD扩增,不同菌丝体亲和群(MCGS)的菌株间、不同地方及同一地方不同菌株间表现出一定的遗传多样性,但菌株间的遗传距离不大(GD≤0.333),表明菌株间具有相似的遗传背景。Mandal等[19]用分子标记对24株代表印度10个不同州的核盘菌菌株进行测定,用21个RAPD引物标记后,大多数菌株表现出90%以上的遗传相似性;所有的菌株产生几乎相同的ITS-RFLP图谱,不同菌株的ITS区变化很小。段晓莉等[20]用微卫星(SSR)标记,对来自欧洲和中国的30个核盘菌菌株进行测定,30个核盘菌分离物具有较高的遗传相似性,物种水平的Nei遗传多样性指数为0.139 3,Shannon多样性指数为0.248 8。不同菌株群体的Nei遗传距离都较小,为0.009 6~0.049 6;群体结构与地理来源没有明显的直接关系。张强等[21]用SRAP分子标记技术对陕西省的144株油菜菌核病菌和18株不同寄主来源的菌核病菌进行遗传多样性分析,结果表明,陕西省油菜菌核病菌存在丰富的SRAP多态性(不同地区的144株菌株的多态性比例为88.4%,相似系数为0.346~0.936,不同寄主的18株菌株的多态性比例为84.9%,相似系数为0.358~0.976),其遗传多样性与地理来源相关性不明显,与寄主种类及致病力也无显著相关性。
通过各种分子标记技术进行测定[18-21]与本文得出的结果都表明,大田内大多数核盘菌菌株的遗传背景相似,虽表现出一定的遗传多样性,但差异不明显,这种差异与菌株的寄主来源、地理来源、亲和群关系不明显。虽然不同地区、不同寄主来源、不同致病性水平、不同菌丝体亲和性表现菌株间的电泳图谱表现出的信息量不如SRAP分子标记等方法丰富,但操作相对简单,从生理、生化的角度揭示了核盘菌群体的遗传多样性,反映出种的特征和种内的异质性,在分类上具有一定的意义。
[1] Reynolds M,Weinhold A R,Morris T J.Comparison ofRhizoctoniasolaniby polyacrylamide gel electrophoresis of soluble proteins [J].Phytopathology,1983,73(6): 903-906.
[2] 刘曙照,李清铣.稻瘟病菌生理小种菌体可溶性蛋白特性初探[J].植物病理学报,1994,24(3): 203-206.
[3] 伍光庆,叶华智,李崇云,等.稻瘟菌菌体可溶性蛋白和同工酶的凝胶电泳分析[J].四川农业大学学报,1996,14(4):505-508.
[4] 胡春锦,李扬瑞,黄思良.稻纹枯菌酯酶同工酶、可溶性蛋白及致病力的研究初报[J].植物病理学报, 2005, 35(1): 90-92.
[5] 赵桂东,李清铣.江苏大麦纹枯病菌酯酶同工酶的测定[J].真菌学报,1993,12(2):163-170.
[6] 赵小明,吕金殿,商鸿生,等.大丽轮枝菌(Verticilliumdahliae)酯酶同工酶的测定[J].河北农业大学学报,1997,20(1):37-44.
[7] Russo G M,Dahlberg K R,Etten J L Van.Identification of a development-specific protein in sclerotia ofSclerotiniasclerotiorum[J].Experimental Mycology, 1982,6(3): 259-267.
[8] Petersen G R, Russo G M, Van Etten J L. Identification of the major proteins in sclerotia ofSclerotiniaminorandSclerotiniatrifoliorum[J].Experimental Mycology,1982,6(3):268-273.
[9] 刘万仁,王崇仁,吴友三.核盘菌可溶性蛋白质及同工酶电泳研究[J].真菌学报,1989,8(1): 62-69.
[10]李新凤,刘慧平,程麦芳,等.核盘菌不同水平抗药性菌株可溶性蛋白和酯酶的电泳图谱比较研究[J].山西农业大学学报(自然科学版),2003,23(2):106-108.
[11]李沛利,叶华智.核盘菌致病性分化研究[J].植物保护,2006,32(5): 29-31.
[12]李沛利,秦芸,严吉明,等.四川省核盘菌的营养体亲和性[J].四川农业大学学报,2010,28(3): 324-327.[13]Sambrook J, Fritsch E F, Maniatis T. Molecular cloning: a laboratory manual[M].USA: Cold Spring Harbor Laboratory Press,1989: 47-57.
[14]杨建雄.生物化学与分子生物学实验技术教程[M].北京:科学出版社,2002: 153-154.
[15]吴少伯.植物组织中蛋白质及同工酶的聚丙烯酰胺凝胶盘状电泳[J].植物生理学通讯,1979(1): 30-33.
[16]牛永春.真菌系统分类与鉴定中的新方法[J].北京林业大学学报,1995,17(2): 93-98.
[17]Casale W L, Hart L P.Influence of four herbicides on carpogenic germination and apothecium development ofSclerotiniasclerotiorum[J].Phytopathology, 1986, 76(10): 980-984.
[18]刘晓红.川西平原油菜菌核病菌群体结构研究[D].雅安:四川农业大学,2004.
[19]Mandal A K, Dubey S C.Genetic diversity analysis ofSclerotiniasclerotiorumcausing stem rot in chickpea using RAPD,ITS-RFLP,ITS sequencing and mycelial compatibility grouping [J].World Journal of Microbiology & Biotechnology,2012,28:1849-1855.
[20]段晓莉, Irzykowski W, Jedryczka M, 等. 利用微卫星标记分析核盘菌遗传多样性[J].中国油料作物学报, 2012, 34(3): 294-299.
[21]张强,陈亚菲,高小宁,等.陕西省油菜菌核病菌遗传多样性的SRAP分析[J].西北农业学报, 2012, 21(10): 149-155.
(责任编辑:杨明丽)
Electrophoretic patterns of soluble protein and esterase isozyme patterns ofSclerotiniasclerotiorumfrom different origins in Sichuan
Li Peili, Liu Dan, Ye Huazhi, Yan Jiming
(College of Agronomy, Sichuan Agricultural University, Chengdu 611130, China)
Soluble protein and esterase isozyme patterns ofSclerotiniasclerotiorumstrains from different host in different region, with various pathogenicities and MCGs, were studied by polyacrylamide gel electrophoresis. The electrophoretic patterns and distribution of soluble protein and esterase isozyme were relative stable in all tested strains, except little changes of weak band in frequencies of occurence, staining intensity and migration distance between different strains. Although a little genetic information was showed in the electrophoretic patterns, the results could be used in practice ofS.sclerotiorumclassification as an additional taxonomic criterion.
Sclerotiniasclerotiorum; electrophoretic analysis; soluble protein; esterase isozyme

研究简报ResearchNotes
2014-05-08
2014-12-16
四川省科技厅应用基础项目(2012JY0117)
S 435.654
A
10.3969/j.issn.0529-1542.2015.04.026
* 通信作者 E-mail:jimingyan@126.com

