半夏泻心汤预防应激性胃黏膜损伤及对Bcl-2和Caspase-3的影响
刘 余,谭达全,罗桂香,李定祥,尹 勇,郭春秀*
(湖南中医药大学,湖南 长沙410208)
应激性胃黏膜损伤是机体在遭受身体、心理障碍等应激状态时,发生的一种急性胃黏膜病变。 随着社会压力的不断增加,人们的心理障碍问题愈发严重,此病的发生率也成大幅上升势头,已严重危害人们的健康和生命。 现代研究证实胃黏膜细胞过度凋亡是应激性胃黏膜损伤发生的机制之一[1]。 虽然近年来有研究[2-4]证实半夏泻心汤能有效地预防应激性溃疡的发生,但是缺乏半夏泻心汤对胃黏膜细胞凋亡影响以抗应激性损伤的研究。 本实验拟通过对束缚水浸应激大鼠胃黏膜上皮细胞凋亡相关蛋白Bcl-2 家族和Caspase-3 表达的影响, 探讨半夏泻心汤预防应激性胃黏膜损伤的作用机制。
1 材料与方法
1.1 材料与仪器
半夏泻心汤所用中药(半夏、黄芩、黄连、干姜、人参、炙甘草、大枣)均一次性购自湖南楚仁堂大药房。 药物剂量比例按《伤寒论》原著:半夏半升,黄芩、黄连、人参、炙甘草各三两,黄连一两,大枣十二枚,根据文献[5]换算为现代用量,半夏55.7 g,黄芩、干姜、人参、炙甘草各46.875 g,黄连15.625 g,大枣42 g。 药物水煎30 min,2 次,提取水煎液,合并, 水浴浓缩至含生药3.05 g/mL, 贮于冰箱中备用。 奥美拉唑, 北京康蒂尼药业有限公司生产,规格:20 mg/片, 实验时以生理盐水稀释成0.203 mg/mL 浓度。
逆转录试剂盒(Fermentas)、 引物(上海生工公司)、 辣根过氧化物酶标记的羊抗鼠IgG(Proteintech)、Caspase-3 抗体、辣根过氧化物酶标记的羊抗兔IgG(Proteintech)。 TS-92 摇床、QL-901 旋涡混合器(其林贝尔)、PCR 仪(Eppendorf)、电泳仪、水平琼脂糖电泳槽、DYCZ-40A 转膜仪(北京六一仪器厂)等。
1.2 动物分组与给药
健康SD 大鼠40 只,雄性,体质量180~220 g,购自湖南斯莱克景达生物有限责任公司,动物许可证号:SCXK(湘)2011-0003。 大鼠按随机数字表法随机分为4 组:空白组、模型组、中药组、西药组,每组10 只。 4 组动物于实验前饲养于湖南中医药大学动物实验中心, 控制室温(25±2)℃, 相对湿度(65±5)%,饲养条件相同。 动物适应性饲养1 周后,中药组给予半夏泻心汤药液30.5 g/kg 灌胃,1 次/d,持续3 d; 西药组给予奥美拉唑2.03×10-3g/kg 灌胃;空白组和模型组以等体积生理盐水灌胃处理。
1.3 造模及取材
除空白组外,中药组、西药组、模型组大鼠采用束缚水浸应激法[6]制作急性胃溃疡模型。 大鼠禁食不禁水24 h,将大鼠仰卧捆绑固定于鼠板上,然后将鼠板直立于(20±1) ℃的水箱中,水面平大鼠胸骨剑突水平,水浸10 h 后大鼠取出松绑。造模后1 h,大鼠10%水合氯醛麻醉仰卧固定于鼠板上,剖腹取胃,观察胃黏膜损伤指数(UI),每组随机抽出5 只大鼠胃黏膜置于Trizol 中,-80 ℃冰箱冻存,RTPCR 法待检Bcl-2、Bax mRNA 的表达; 每组其余5只大鼠胃黏膜置于-80 ℃冰箱冻存,Western-blot 法待检Caspase-3 表达。
1.4 指标检测
1.4.1 UI 观察 大鼠取胃后沿胃大弯剖开,用生理盐水冲洗干净, 再用毛笔轻轻刷去胃黏膜表面黏液, 在滤纸上平展开,10 倍放大镜下肉眼观察大鼠的胃黏膜损伤情况,按文献[6]:斑点糜烂计1 分;糜烂长度<1 mm 计2 分; 糜烂长度1~2 mm 计3 分;糜烂长度2~3 mm 计4 分; 糜烂长度>4 mm 计5分;宽度>2 mm 者计分加倍,累计所得损伤指数。
1.4.2 Western-blot 法检测Caspase-3 表达 胃黏膜组织匀浆提取上清液,用常规操作方法提取胃黏膜组织总蛋白;SDS-PAGE 电泳;转膜2 h;用TBST配制5%脱脂奶粉封闭1 h;一抗(1∶1 000)4 ℃孵育过夜;二抗(1∶3 000)室温孵育1 h;加入显色液,以X 光胶片曝光。 每张膜上做一种目的蛋白和相应的内参蛋白。 图片扫描保存为电脑文件,并用ImageJ分析软件将图片上每个特异条带灰度值数字化。 将目的蛋白的灰度值除以内参β-actin 的灰度值以校正误差,将其比值(相对灰度值)作为结果。
1.4.3 RT-PCR 法检测Bcl-2、Bax mRNA 表达 应用Trizol 试剂盒提取总RNA,组织总mRNA 逆转录成cDNA 操作步骤按照说明书进行。 20 μL 逆转录反应体系配置:5×逆转录buffer 4 μL,oligo (d T)0.5 μL,dNTPs 0.5 μL, 逆转录酶MmLV 1 μL,DEPC 处理水10 μL,RNA 模板4 μL。 反应条件:37 ℃,1 h;95 ℃,5 min;灭活MmLV。 10 μL 扩增体系配置:10×Ex buffer 1 μL, dNTP 1 μL, 上游引物0.5 μL, 下游引物0.5 μL,cDNA 1 μL,Ex Taq DNA polymerase 0.15 μL,ddH2O 5.85 μL。 扩增条件:94 ℃ 4 min,94 ℃ 30 s,56 ℃(Bcl-2)/60 ℃(Bax) 30 s,72 ℃30 s,共30个循环,72 ℃延伸5 min,4 ℃保存。 PCR 产物电泳,凝胶成像系统下观察、照相、扫描,将图片采集,并用Quality one软件对图像进行分析,计算目的蛋白与总蛋白(Beta-actin)的光密度比值。
引物序列如下:Bcl-2 引物序列:Bcl-2-F:5’-GGTGAACTGGGGGAGGATTG -3’,Bcl -2 -R:5’ -CCACAGAGCGATGTTGTCC -3’;Bax 引 物 序 列:Bax-F:5’-GGGATGGCCTCCTTTCCTAC-3’,Bax-R:5’-TTCCAGATGGTGAGTGAGGCA -3’;actin 引物序列:actin-F:5’-CATCCTGCGTCTGGACCTGG-3’,actin-R:5’-TAATGTCACGCACGATTTCC-3’。
1.5 统计学分析
采用SPSS 16.0 软件进行分析, 计量资料数据用“±s”表示。正态性检验,若符合正态分布者,多组比较采用单因素方差分析 (One-way ANOVA),方差齐者用LSD 和SNK 法, 若方差不齐者用Tamhane’s T2 或Dunnett’s T3 法。P<0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠UI 结果比较
空白组大鼠胃黏膜未见明显损伤,模型组大鼠UI 最高,与空白组比较,具有统计学意义(P<0.01),说明束缚水浸应激刺激可造成胃黏膜的急性损伤;与模型组比较,中药组和西药组UI 均降低,差异具有统计学意义(P<0.01)。 见表1。
表1 各组大鼠UI 结果比较 (±s,n=10)

表1 各组大鼠UI 结果比较 (±s,n=10)
注:与空白组比较★★P<0.01;与模型组比较▲▲P<0.01。
组 别空白组模型组中药组西药组给药剂量(g/kg·d)— —30.5 2.03×10-3 UI 0 41.80±5.59★★22.70±5.12★★▲▲23.30±7.90★★▲▲
2.2 各组大鼠胃黏膜Bcl-2、Bax mRNA 表达结果比较
与空白组比较, 模型组大鼠胃黏膜Bcl-2 表达显著降低(P<0.01)、Bax 表达显著增强(P<0.01),提示束缚水浸应激造模可抑制Bcl-2 mRNA 表达、促进Bax mRNA 表达,使Bcl-2/Bax 表达失衡。 与模型组比较,中药组和西药组均可显著促进Bcl-2 表达(P<0.01),中药组与西药组比较,西药组促进Bcl-2 表达的作用优于中药组(P<0.05)。 见表2。
2.3 各组大鼠胃黏膜活化Caspase-3 表达的比较
与空白组比较,模型组大鼠胃黏膜细胞活化的Caspase-3(17kd)表达显著升高(P<0.01),酶原Caspase-3(35 kd)显著降低(P<0.01),提示束缚水浸应激造模,可促进Caspase-3 的活化。 与模型组比较,中药组和西药组可显著降低活化Caspase-3 的表达(P<0.01)。 见表3,图1。
表2 各组大鼠Bcl-2、Bax mRNA 表达结果比较(±s,n=5)
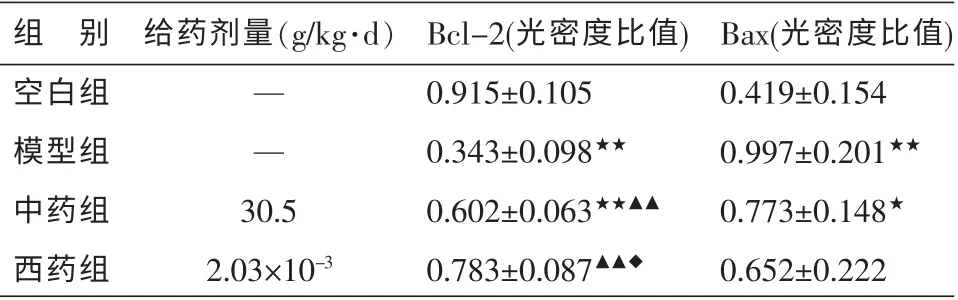
表2 各组大鼠Bcl-2、Bax mRNA 表达结果比较(±s,n=5)
注:与空白组比较★P<0.05,★★P<0.01;与模型组比较▲▲P<0.01;与中药组比较◆P<0.05。
组 别空白组模型组中药组西药组Bcl-2(光密度比值)0.915±0.105 0.343±0.098★★0.602±0.063★★▲▲0.783±0.087▲▲◆给药剂量(g/kg·d)— —30.5 2.03×10-3 Bax(光密度比值)0.419±0.154 0.997±0.201★★0.773±0.148★0.652±0.222
表3 各组大鼠Caspase-3 表达的比较 (±s,n=5)
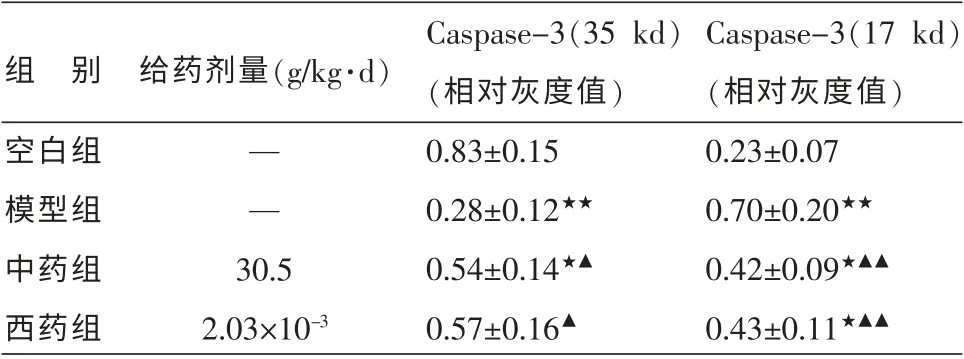
表3 各组大鼠Caspase-3 表达的比较 (±s,n=5)
注:与空白组比较★P<0.05,★★P<0.01;与模型组比较▲P<0.05,▲▲P<0.01。
Caspase-3(35 kd)(相对灰度值)0.83±0.15 0.28±0.12★★0.54±0.14★▲0.57±0.16▲组 别空白组模型组中药组西药组给药剂量(g/kg·d)— —30.5 2.03×10-3 Caspase-3(17 kd)(相对灰度值)0.23±0.07 0.70±0.20★★0.42±0.09★▲▲0.43±0.11★▲▲

图1 大鼠胃黏膜Caspase-3 蛋白western-blot 电泳图
3 讨论
正常情况下胃黏膜细胞通过平衡的凋亡和增殖机制,维持黏膜细胞数量的稳定和胃黏膜整体的完整性。 研究发现应激状态下,黏膜上皮细胞凋亡增加,增殖受到抑制,说明应激过程中胃黏膜上皮细胞的过度凋亡参与了胃黏膜的损伤[1]。
细胞凋亡的发生受到细胞内凋亡调节蛋白的调控,在已知的凋亡调节蛋白中,Bcl-2 家族蛋白发挥着细胞凋亡“主开关”的作用,其抗凋亡蛋白和促凋亡蛋白两类蛋白相互作用调节,决定着细胞的存活与凋亡,Bcl-2 表达增强则抑制细胞凋亡的发生,Bax 表达增强则促进细胞凋亡的发生。 研究[7-8]发现水浸束缚应激导致细胞过度凋亡,其发生的机制与增加促凋亡基因Bax 的表达和减少抑凋亡基因Bcl-2 的表达有关。而Caspase 家族是细胞凋亡过程中的启动者和执行者, 是细胞死亡蛋白酶。 其中Caspase-3 作为凋亡级联反应下游的凋亡执行因子中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子,它的活化标志着凋亡进入不可逆阶段[7]。 在正常细胞内部,Caspase 处于非活化的酶原状态,不具备生理活性,只有被激活的Caspase-3才具备生理活性,引发细胞凋亡级联反应。 Bcl-2 家族蛋白可改变线粒体膜的通透性, 细胞色素c 进入细胞液, 与抗恶性贫血因子1 和Caspase-9 组成凋亡复合体,Caspase-9 激活后, 作用于下游的Caspase-3 酶原,激活Caspase-3,被活化的Caspase-3引发细胞不可逆性凋亡[9]。 因此在执行细胞凋亡和促进创伤愈合的过程中Caspase-3 发挥重要的作用。
半夏泻心汤是《伤寒论》中“辛开苦降”的代表方剂。 在本研究中半夏泻心汤按照原方剂量配伍,半夏剂量大大超过《中药学》《中药大辞典》和《中华本草》等权威著作规定的用量5~10 g。 但谭达全等[10]通过对仲景运用半夏的经验和规律进行总结与研探,发现大剂量半夏生用,经过汤剂煎煮,既能解半夏之毒,又不破坏其治病有效成分而达到了增强疗效之目的,且后世很多医家[11-13]在临床也证实仲景使用半夏,剂量超常,但功效卓著。 至今半夏泻心汤的治疗应用远超仲景原来的心下痞、肠鸣而呕的范畴,广泛应用于中焦寒热错杂、升降失调引发的诸症。王凤泽等[14]认为“只要是脾胃中焦之气机升降运动失常所导致的水湿运化障碍,气滞血瘀及一切病理产物阻塞中焦所出现的一切病证, 均可使用该方”。唐虹[15]则总结出脾胃病机总不离寒热及升降失常,因而对脾胃病的治疗常用辛开苦降法。
大鼠束缚水浸的应激性胃黏膜病变与临床心理和身体应激的胃溃疡病变的病机相似,实验和临床[16-18]证实半夏泻心汤可有效防治胃黏膜病变,包括应激性胃黏膜损伤。 本实验结果显示,束缚水浸应激后, 胃黏膜损伤明显, 胃黏膜上皮细胞Bcl-2 mRNA 表达明显降低,Bax mRNA 表达明显增高,Caspase-3 被明显活化, 从而引发胃黏膜上皮细胞的不可逆性过度凋亡。 预先给予半夏泻心汤,可明显抑制胃黏膜的急性损伤,Bcl-2 mRNA 的表达明显增强,Caspase-3 酶原的活化受到抑制,表明半夏泻心汤可通过抑制胃黏膜上皮细胞的过度凋亡从而对抗胃黏膜损伤。
综上,半夏泻心汤可通过增强Bcl-2 mRNA 的表达、抑制Caspase-3 酶原的活化,从而有效对抗应激性胃黏膜上皮细胞的过度凋亡,预防应激性胃黏膜急性损伤的发生,但其抑制凋亡的具体机制及对凋亡信号通路的影响还有待进一步研究。
[1]刘 婧,李兆申.大鼠应激性胃黏膜损伤时细胞发生凋亡[J].基础医学与临床[J].2007,27(9):1 038-1 042.
[2]徐 颖,张祖志,方正清,等.半夏泻心汤对应激性胃黏膜损伤大鼠血管活性肠肽含量的影响[J].中医药临床杂志,2004,16(2):97-98.
[3]张 忠,司银楚,吴海霞,等.半夏泻心汤及其拆方对应激性胃溃疡大鼠胆碱能神经元的影响[J].中国中医基础医学杂志,2005,11(4):283-284.
[4]张 忠,司银楚,白丽敏,等.半夏泻心汤及其拆方对应激性胃溃疡大鼠胃泌素的影响[J].世界华人消化杂志,2005,13(10):1 223-1 224.
[5]柯雪帆,赵章忠,张玉萍,等.《伤寒论》和《金匮要略》中的药物剂量问题[J].中国中医药杂,1983(12):36-38.
[6]Guth PH,Aures D,Paulsen G. Topical aspfin plus HCI gastric lesions in the rat. Cytoprotective effect of prostaglandin,cimetidine,and probanthine [J]. Gastroenterology,1979,76(1):88-93.
[7]牛廷献,史智勇,姜进军.凋亡相关基因bcl-2 和Bax 在大鼠应激性溃疡中的表达及作用[J].中国实验动物学报,2005,13(3):170-172.
[8]刘 婧, 李兆申, 宛新建, 等. 凋亡相关基因Bcl-2/Bax 和Fas/Fas L 在应激性溃疡发生发展过程中的表达及作用[J].中华医学杂志,2003,83(6):504-509.
[9]何永锋,樊廷俊.Bc1-2 家族蛋白与细胞凋亡[J].生物化学与生物物理学报,2002,34(4):289-294.
[10]谭达全,张炳填,李鑫辉.仲景妙用半夏杂谈[J].中医药学刊,2006,24(1):146-149.
[11]张银梅.半夏临床运用点滴[J].中华现代临床医药杂志,2003(11):59.
[12]朱树宽.半夏善治三叉神经痛[J].中医杂志,2001,42(2):73.
[13]吴鞠通.吴鞠通医案[M].北京:人民卫生出版社,1960,181.
[14]王泽凤,王 敏,史新萍.半夏泻心汤在胃肠疾病方面的应用[J].中国实用医药,2009,4(9):167-168.
[15]唐 虹.辛开苦降法治疗脾胃病浅析[J].中医研究,2010,23(5):59-60.
[16]房亚洲.半夏泻心汤治疗消化性溃疡临床分析[J].光明中医,2011,26(1):97-98.
[17]渡边泰雄.半夏泻心汤对水浸拘束诱发大鼠胃溃疡的抑制作用以及脑和胃的单胺调节[J].国外医学·中医中药分册,1998,20(6):23-24.
[18]许景峰,王金萍,许 茜.半夏泻心汤对大鼠胃溃疡及小肠功能的影响[J].中国药业,2002,11(2):48-49.

