不同气候条件对“云烟87”旺长期叶片光合速率及蛋白表达的影响
蔡永占,周普雄,张柳,王铮 ,徐琼华,杨焕文,毛自朝
1 云南农业大学烟草学院 昆明 650201;
2 云南农业大学农学与生物技术学院 昆明 650201;
3 玉溪农业职业技术学院 云南玉溪 653106
不同气候条件对“云烟87”旺长期叶片光合速率及蛋白表达的影响
蔡永占#1,周普雄#2,张柳2,王铮2,徐琼华3,杨焕文1,毛自朝2
1 云南农业大学烟草学院 昆明 650201;
2 云南农业大学农学与生物技术学院 昆明 650201;
3 玉溪农业职业技术学院 云南玉溪 653106
为揭示烟草植株对不同气候环境响应的分子机理,采用相同土壤栽培和管理,在云南3个不同气候试验点盆栽烤烟品种“云烟87”,测定烟株旺长期农艺性状、SPAD值和净光合速率,以iTRAQ标记技术开展叶片差异表达蛋白分析,并对部分差异表达蛋白基因的转录进行q-RT-PCR验证。结果表明:在不同实验点间农艺性状、SPAD值和净光合速率有显著差异;不同生态点间烟叶差异蛋白富集到碳、氮代谢和逆境响应等途径。与昆明烟叶相比,丽江金庄试验点烟叶中光合光反应相关的蛋白上调表达,而与糖呼吸消耗相关的酶类下调表达;丽江片角试验点烟叶糖合成途径相关的酶类上调表达而与呼吸代谢相关酶类则下调表达。丽江片角和金庄试验点烟叶中,蛋白质和氨基酸等含氮化合物合成酶类下调,而与其分解酶类上调表达。随机选取6个差异表达的蛋白质,用q-RT-PCR进行其转录表达水平的间接验证,表明与iTRAQ分析的差异蛋白在mRNA水平上有相似的表达趋势。本研究初步阐明丽江烟叶通过提高碳含量和降低氮含量来形成高“碳氮比”烟叶的气候因子诱发机制。
烟草;气候条件;旺长期;蛋白质组学;iTRAQ
烟草(Nicotiana tabacum)是重要的经济作物,同时作为模式植物,在遗传、发育、生理、生化和转基因等领域的研究中具有重要意义[1]。烟叶发育及品质受遗传、生态环境和栽培措施共同调控。单一环境因子对烟草生长发育影响有很多报道,杨兴有等报道了烤烟不同发育时期降低光照强度后,烟叶干物质含量和转化酶活性降低,但光合色素和中性致香成分含量有所增加[2]。黄勇等发现UV-B辐射可矮化烟苗,缩小叶面积,降低光合效率,但微量UV-B辐照有利于烟叶光合色素和多酚含量的提高[3]。梁太波等研究了水分胁迫导致烟株氮素代谢紊乱,氨同化关键酶活性和氮素含量均显著下降,植株生物量降低[4]。时鹏等发现气候因子与烟叶化学成分有显著的相关性,在一定范围内,降雨量、日照时数和积温的增加促进烟叶中总糖的积累,减少含氮化合物的积累[5]。在蛋白质水平研究环境因素对烟草生长发育影响方面,崔红[6]等运用双向电泳技术揭示成熟烟叶中参与叶绿体发育、色素代谢、光合作用相关的蛋白在福建的清香烟叶中较高表达,而与糖酵解途径相关的蛋白质则在河南浓香烟叶中较高表达; 陈宗瑜等报道,不同滤减UV-B辐射后,在生理成熟期的K326 叶片中检测到参与氧化还原反应和光合作用等过程的差异表达蛋白[7],蔡永占等分析在不同气候环境下的昆明和丽江金庄团棵期烟草叶片蛋白质组变化,初步阐述了丽江烟叶糖含量高的形成机制[8]。目前生态环境对烟草生长发育影响的研究主要集中于成熟期,并偏重于烟叶常规化学成分和致香物质含量分析,对烟株长势和烟草叶片发育有重要影响的旺长期的研究较少,特别是利用蛋白质组技术,结合植物的生长发育与生理性状的测定来研究不同气候环境对旺长期烟草生长发育调控的研究鲜见报道。
本文在烟株生长的关键时期—旺长期,采用生理生化、形态指标及高通量蛋白质组学技术对丽江市永胜县片角、丽江市玉龙县金庄、昆明(云南农业大学后山农场)3个试验点的烟叶进行比较研究,探索不同气候条件对“云烟87”旺长期叶片光合速率及蛋白表达的影响,以阐述旺长期相关气候因子对丽江烟叶品质形成的机理。
1 材料与方法
1.1 试验材料
供试品种“云烟87”。2011年分别在云南省丽江市玉龙县金庄(27°6′49.43″ N、99°50′37.57″ E、海拔1879m),云南省丽江市永胜县片角(26°00′17.19″ N、100°35′4.68″ E、海拔1501m )和云南省昆明市云南农业大学农场(25°7′51.92″ N、102°45′10.39″ E、海拔1943 m)(以下简称,金庄JZ、片角PJ和昆明KM)三个生态点,按照8行9列东西方向排列,使用上口、下口和高度分别为40 cm、20 cm和26cm,装 25 kg 干土的塑料盆栽烤烟品种(云烟 87)72株,以模拟大田栽培模式放置盆栽烟苗,使烟株行距为1.20 m,株距为0.55 m,四周设置保护行。在相同土壤(土壤均来自丽江金庄科技园)、相同品种(云烟 87)、相同苗龄(2011年3月12日播种)、相同移栽时间(2011年5月15日)和相同管理措施的条件下,在旺长期(2011年7月10日)每个试验点随机采取9棵烟株的中部第10片,(从下向上第10叶,下同)迅速置于液氮中以备提取烟草叶片蛋白质,并用iTRAQ蛋白质组分析技术进行分析。
1.2 气候因子分析
通过在金庄、片角和昆明各生态试验点设置WPH1-HYA-C型小气象站(中西远大,北京),收集气象数据,并采用 Excel软件分析5月至7月(烟草现蕾前)的日平均气温、气温日较差、降水量、日照时数等气象特征。
1.3 农艺性状测定
在每个试验点于旺长期随机选取10株烟草,测量其株高、中部茎围、叶长、叶宽等农艺性状。
1.4 SPAD值测定
在每个试验点的旺长期随机选取10 株烟草,利用SPAD-502型叶绿素测定仪(久和顺电子科技,深圳),分别活体测量中部第10片叶片的 SPAD 值,每个叶片测定上(叶尖)、中(叶中部)和下(叶基)3 个部位,每个部位测定3次,计算平均值。
1.5 净光合速率测定
每个试验点于旺长期,随机选取3 株烟草的中部第10片叶,在晴天上午 9:00—11:30,利用 LI-6400光合仪,打开内置光源设置光照强度为 1500,1200,900,600,300,150,50 和 0μmol·m-2·s-1;用配套 CO2钢瓶,设置并维持CO2浓度为390μmol·mol-1,做光响应曲线。根据三地点的气候数据分析,计算测定时间点前、后5天,共11天的平均光照强度,并通过获得的光响应曲线查询来获得烟株的平均净光合速率。
1.6 烟草叶片蛋白质组分析
参照蔡永占等方法[8]分别对旺长期金庄、片角和昆明烟草叶片进行全蛋白提取。对提取的蛋白质样品进行还原烷基化处理,打开二硫键以便于变性进行蛋白酶水解。用Amersham Bioseienees公司(美国)的蛋白质定量试剂盒进行蛋白质浓度测定[11];以(1:30)胰蛋白酶提取蛋白质在37℃进行过夜酶解;用iTRAQ试剂标记酶解肽段[12],其中用113试剂标记金庄试验点蛋白质样品,114试剂标记片角试验点蛋白质样品,115试剂标记昆明试验点蛋白质样品。将标记后的肽段进行等量混合后,使用强阳离子交换色谱(SCΧ)进行预分离,进一步进行液相串联质谱分析,获得差异表达肽段及其序列,并通过二级质谱中不同iTRAQ标记的丰度及相应的峰面积,来计算不同样品间蛋白的含量。最后将差异肽段序列分别在NCBI nr数据库和我们建立的烟草转录组数据库(Access No:SRA096861)中进行肽段匹配和蛋白质的预测与注释。
1.7 q-RT-PCR分析
随机选取6个差异表达的蛋白质点,分别是热激蛋白70(heat shock protein 70)、核酮糖-3-磷酸激酶(Ribulose-3-phosphokinase)、类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenase)、L-抗坏血酸过氧化物酶(ascorbate peroxidase)、叶绿体色素结合蛋白cp 24(chloroplast pigment-binding protein CP24)、叶绿素a/b结合蛋白(chlorophyll a/b binding protein)和(内标蛋白)β-肌动蛋白(β-Actin),根据其基因编码区序列,用DNAMAN设计并由上海生物工程公司合成引物(序列见表1)。采用目的基因与内参基因(β-Actin)Ct值之间的比值进行基因的相对表达量的计算[13]。
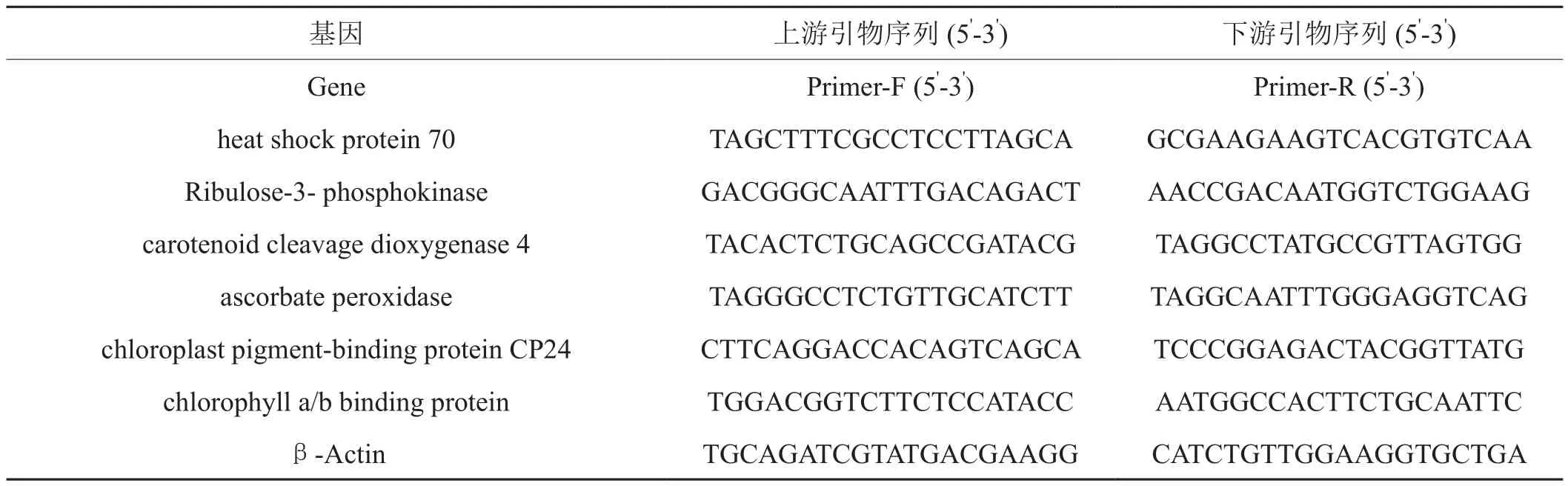
表1 用于 qRT-PCR分析的引物序列Tab.1 Primers for qRT-PCR ampli fi cation
2 结果与分析
2.1 不同生态点气象数据分析
分别对丽江金庄、片角和昆明地区2011年5月中旬至7月下旬(从烟苗移栽到现蕾期)的气象数据进行分析(如图1所示)。与昆明试验点相比,金庄试验点旬平均昼夜温差高,旬平均降水量在5月中旬到6月上旬期间更为充足,旬平均日照时数更长;片角试验点旬平均温度较高,旬平均昼夜温差略高,旬平均降水量在5月至6月下旬低,后期较高,旬平均日照时数更长。
总体而言,金庄和片角具有较长的日照和昼夜温差,或有利于增强烟株的光合积累并降低呼吸消耗。金庄除移栽初期气温稍低外,其它气候均较适宜,而片角烟株从移栽到团棵期(5月中下旬到6月中下旬)气温较高、降雨较少导致部分的水分胁迫,有利根系发展;而进入旺长期,雨量增加,旱情消除而促进植物的快速生长。
2.2 不同生态点烟株农艺性状、SPAD 值和净光合速率的变化
各生态点气候因子的差异导致三地烟株农艺性状,活体叶绿素含量指标SPAD数值和光合速率有较显著的变化(见表2、表3)。
与昆明试验点相比,金庄试验点烟草叶长(以第10叶为代表)、叶宽和叶面积等农艺性状参数较低,而株高、SPAD值和净光合速率较高;较高的株高和较低的叶面积与植物所受日照长、平均温度低和昼夜温差大相关,降低叶面积可避免强光所诱发的上部叶片的光呼吸,而株高增加有利于增加烟株整体的受光率,促进下部叶片的光合。
片角试验点烟株SPAD值、净光合速率、茎围和叶宽较高,但株高、叶长、叶面积和叶长/叶宽比等较低。较低的株高和较大的叶宽可能与其团棵期所受的光照时间长、降雨少、均温高有关,株高降低有利于干旱胁迫下水分的输送,叶宽增加可促进叶片的遮蔽,避免白天高光照时中、下部叶片因温度胁迫导致过多蒸腾作用引起的水分散失。
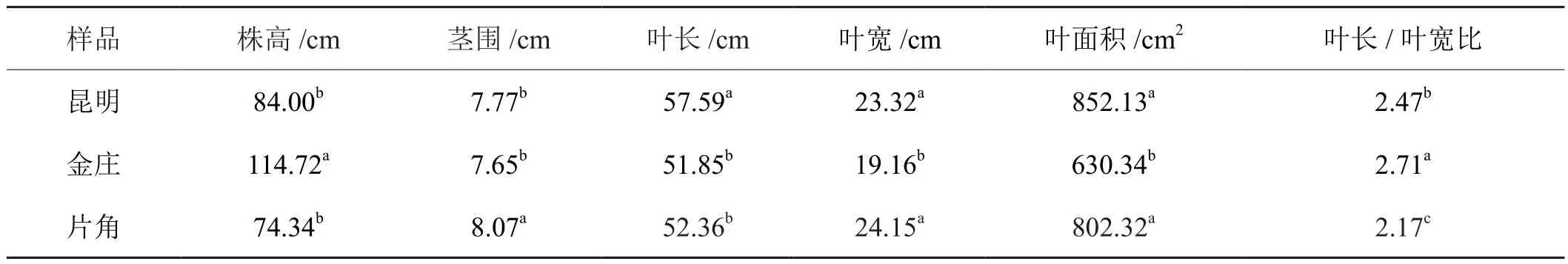
表2 不同试验点烟草旺长期农艺性状Tab.2 Changes of tobacco agronomic traits in KM,JZ and PJ

表3 不同试验点烟草旺长期烟株中部第10叶片SPAD值和净光合速率变化Tab.3 Changes of SAPAD and net photosynthetic rate of the 10th at middle part of tobacco plant
2.3 不同气候环境下烟草旺长期叶片蛋白质表达变化
2.3.1 各生态点旺长期差异表达蛋白质的总体变化
通过对金庄、片角和昆明试验点烟草的中部第10叶片蛋白样品进行iTRAQ蛋白质组学技术分析,与昆明试验点烟叶相比较,金庄、片角试验点的差异表达蛋白质(表达量差异倍数1.5倍以上)数量见表4。
所获得的1.5倍以上差异表达蛋白质的序列经过BlastP程序,对NCBI nr 数据库(www.ncbi.nlm.nih.gov)和我们建立的“云烟87”转录数据库进行比对分析后,共注释到47个差异表达蛋白质(表5),它们主要参与碳代谢、氮代谢和环境响应等生命进程。

表4 不同气候下旺长期烟草第10叶片差异表达倍数大于1.5及以上的蛋白数Tab.4 Number of different expressed proteins in the 10th leaves at middle part of tobacco plant under different climate conditions
2.3.2 不同气候环境下旺长期烟叶碳代谢相关蛋白质的表达变化
金庄JZ与昆明KM烟叶相比,检测到5个参与碳代谢的差异表达蛋白质(表5),其中铁氧还蛋白主要参与光合电子传递,其表达量上调,有利于有机物的合成与积累,这与金庄旺长期烟叶净光合速率大于昆明旺长期烟叶相一致(见表2);3-磷酸甘油醛脱氢酶、苹果酸脱氢酶和L-乳酸脱氢酶参与糖酵解、三羧酸循环等反应过程,其在金庄试验点烟草中表达下调,预示金庄烟叶碳水化合物分解缓慢,利于碳水化合物的积累;丙酮酸/α-酮戊二酸脱氢酶复合体主要参与丙酮酸形成乙酰辅酶A或α酮戊二酸脱氢酶转化为琥珀酰辅酶A,其在金庄烟叶中表达上调,反映该点烟草需要通过该酶类来增加乙酰辅酶A或琥珀酰辅酶A的合成,来增强物酯类、氨基酸、核苷酸等物质的合成与转化。
片角(PJ)与昆明(KM)烟叶相比,有11个差异表达的蛋白质与碳代谢相关,其中β-半乳糖苷酶、F0F1型的ATP合成酶的α亚基和β亚基、L-乳酸脱氢酶、苹果酸/乳酸脱氢酶、NADPH:醌还原酶和锌依赖氧化还原酶在片角试验点烟草叶片中下调表达,预示了片角分解糖类等有机物的代谢缓慢;果糖-1,6-二磷酸酶糖,果糖-1,6-二磷酸醛缩酶,3-磷酸甘油醛脱氢酶在片角烟叶中上调表达,预示该点烟叶光合碳同化或糖异生能力较强,这与该点其参与单糖的异构化和单糖的聚合的核苷二磷酸糖差向异构酶表达量上调相一致。
不同生态点碳代谢相关蛋白质表达差异显示,相对于昆明烟叶,代表丽江烟叶的片角和金庄 “云烟87”旺长期烟叶中糖类合成途径的酶类增加,而呼吸消耗酶类下降,预示丽江烟叶应有积累较高的碳水化合物含量,这与前人测定的丽江烟叶具有较高的淀粉和可溶性糖含量相一致[9-10]。

表5 不同气候条件旺长期烟草叶片差异表达蛋白质注释结果Tab.5 Different expressed proteins in tobacco leaves with their annotation under dif fi dent climate conditions
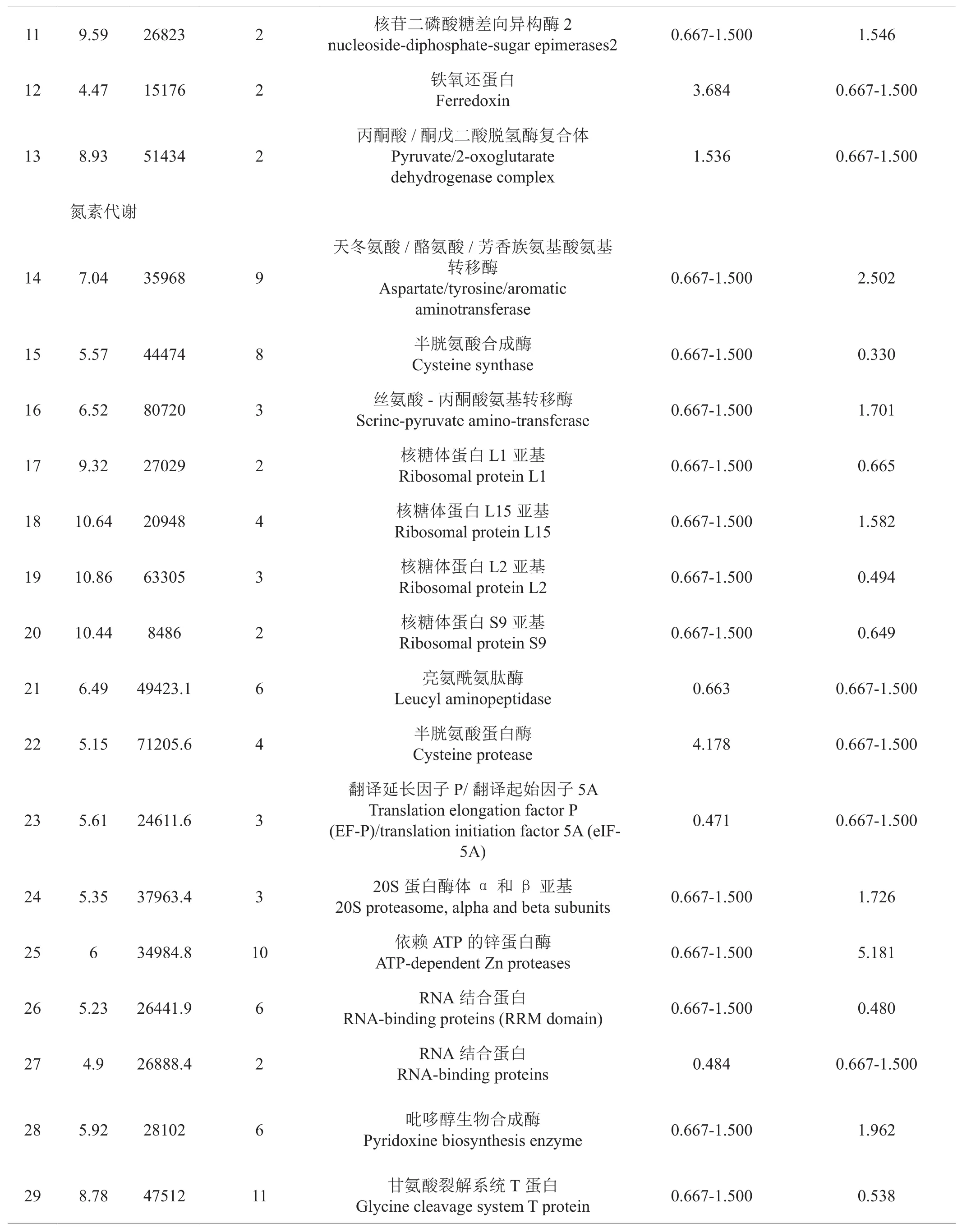
续表5

续表5
2.3.3 不同生态点烟叶氮代谢相关蛋白的差异变化
金庄JZ与昆明KM烟叶比较有4个氮代谢相关的差异表达蛋白质,其中半胱氨酸蛋白酶(4.178)为仅有的上调表达蛋白,蛋白亮氨酰氨肽酶(0.663)、翻译延长因子/翻译起始因子P(0.471)和RNA结合蛋白[14](0.484)为下调蛋白,预示金庄烟叶蛋白合成能力下降,降解能力增强。
片角PJ与昆明KM烟叶比较,有12个1.5倍差异表达的蛋白质参与氮代谢相关过程,其中半胱氨酸合成酶、核糖体蛋白L1,L2,S9亚基和RNA结合蛋白主要参与氨基酸和蛋白质合成代谢,其下调表达,预示片角烟叶蛋白合成能力较低;而20S蛋白酶体α和β亚基、依赖ATP的锌蛋白酶参与蛋白降解反应;天冬氨酸/酪氨酸/芳香族氨基酸氨基转移酶、丝氨酸-丙酮酸氨基转移酶参与氨基酸的降解;吡哆醇是氨基酸转氨或脱酸的辅酶[15],这些蛋白质总体表达较高,预示片角烟叶蛋白质和氨基酸的降解能力较强。
不同生态点气候差异引发烟叶蛋白差异表达变化显示,与昆明烟叶相比,代表丽江烟叶的片角和金庄“云烟87”旺长期烟叶中与氨基酸和蛋白质降解相关酶上调表达,而蛋白质及氨基酸合成相关酶下调表达的变化,这也与丽江烟叶中氮含量低、含氮化合物合成降低的结果[10]相一致。
2.3.4 不同生态点逆境响应相关蛋白表达的变化
金庄JZ与昆明KM烟叶比较有4个环境相应差异蛋白,其中分子伴侣GroEL蛋白(0.479)是唯一下调表达蛋白,而上调表达蛋白有肽甲硫氨酸亚砜还原酶(1.638)、富含亮氨酸重复序列蛋白(1.727)和肽基脯氨酰基顺反异构酶(5.2)。这些相对较少逆境蛋白质的表达变化可能与金庄“云烟87”旺长期阶段,总体气候较适宜所受逆境胁迫少,但其昼夜温差较大,夜间气温在移栽期较低相关。
片角PJ与昆明KM烟叶比较,片角烟叶有12个差异表达的蛋白质参与环境响应,其中热激蛋白/分子伴侣在片角试验点烟草中表达量总体偏高,反映了片角试验点平均温度较高,降雨量在团棵期前少,同时这也与该点冷激蛋白表达量较低相一致(表5)。片角试验点海拔1501m,与之相比,昆明(海拔1943m)烟草Cu/Zn超氧化物歧化酶,硫醇-二硫化物异构酶和铁氧还蛋白等自由基抗性相关蛋白有较高的含量,可能与昆明试验点海拔高、紫外辐照强,诱发烟株叶片产生较多的活性氧等自由基相关。
2.4 差异表达蛋白基因转录的qRT-PCR扩增验证
采用qRT-PCR技术对6个随机选取的iTRAQ测序获得差异表达蛋白质的编码基因进行转录水平检测来进行间接验证。将扩增曲线中得到的Ct值,以β-Actin为内参基因,计算6个候选差异表达蛋白质的编码基因在旺长期3个生态试验点中3次重复相对含量(见图2),结果表明q RT-PCR分析mRNA量,虽然与蛋白质的量有差异,但6个差异表达基因的mRNA水平的变化与蛋白质的变化趋势基本是相同的,预示我们通过iTRAQ测序分析获得的蛋白质差异表达的数据是可靠和准确的。
3 讨论
丽江特色优质烟叶的形成主要源于气候环境综合影响。前人已对生长在不同生态烟区成熟期和团棵期烟草叶片差异表达蛋白质进行了分析[8-10],考虑到旺长期烟叶的生长发育对烟叶的物质积累和最终的产量具有重要作用,本研究在比较各生态点烟株的农艺性状,叶绿素含量和净光合速率的基础上,进一步提取旺长期烟草叶片蛋白质,运用iTRAQ标记技术,辅助以质谱鉴定获得不同气候环境下差异表达蛋白,并通过差异表达蛋白质的注释来探索不同气候环境对烟草生长发育调控的分子机理。
本研究对丽江主栽品种云烟87在所设置的三个生态试验点旺长期烟草叶片蛋白质组学研究结果表明,与昆明试验点相比较,以丽江金庄和片角试验点为代表的丽江烟叶在参与糖类积累等相关蛋白表达量上调,这有利于丽江烟叶碳水化合物的积累;同时参与氨基酸与蛋白质合成相关蛋白质表达量下调;而参与蛋白和氨基酸分解的蛋白质表达量上调,不利于含氮化合物的积累。因此,本研究从蛋白质组学初步揭示了丽江烟叶旺长期碳氮比较高的机理。

图2 qRT-PCR验证iTRAQ测序蛋白质的相对表达量Fig.2 q-RT-PCR ampli fi cation for different expressed proteins determined by iTRAQ analysis
另丽江烟叶中活体叶绿素含量SPAD值、净光合速率较高,能提高丽江烟叶的光合能力的同时,也将在烟叶中积累较多的光合色素,有利于清香型烟叶品质的形成[17]。
本研究中因iTRAQ检测的局限性,不同地区因环境变化所产生的差异表达蛋白没有检测到在烟叶发育中起重要作用的信号传导、转录因子和激素代谢等含量微或不稳定的蛋白质变化,因此,为进一步阐述不同气候所导致烟叶基因表达变化与互作的全貌,还需要新的高通量手段如RNA-seq[18]等来进行分析。因抗体的缺乏,在本研究中没有对随机选取的差异表达蛋白含量进行蛋白质印迹法(Western Blot)的验证,但通过q-RT-PCR检测差异蛋白的转录,显示差异蛋白在转录水平与蛋白含量有相似的趋势,间接验证了蛋白质组分析的差异蛋白的准确性。
[1]周冀衡,刘建利,余砚碧,等.对我国部分替代进口烟叶工作的思考[J].烟草农业科学,2006,2(3):216-217.
[2]杨兴有,刘国顺,伍仁军,等.不同生育期降低光强对烟草生长发育和品质的影响[J].生态学杂志,2006,26(7):1014-1020.
[3]黄勇,周冀衡,郑明,等.UV-B对烟草生长发育及次生代谢的影响[J].中国生态农业学报,2009,17(1):140-144.
[4]梁太波,王建伟,尹启生,等.水分胁迫对烤烟氨同化和生物量的影响[J].中国烟草学报,2012,18(3):50-54.
[5]时鹏,申国明,向德恩,等.恩施烟区主要气候因子与烤烟烟叶化学成分的关系[J].中国烟草科学,2012,33(4):13-16.
[6]崔红,冀浩,张华,等.不同生态区烟草叶片蛋白质组学的比较[J].生态学报,2008,28(10):4874-4880.
[7]陈宗瑜,毕婷,吴潇潇.滤减UV-B 辐射对烤烟蛋白质组变化的影响[J].生态学杂志,2012,31(5):1129-1135.
[8]蔡永占,周普雄,李佛琳,等.不同气候环境中团棵期烟草叶片蛋白质组学分析[J].中国农业科学,2013,46(4):859-870 .
[9]刘杰,周清明,彭新辉,等.云南烟区烤烟中部烟叶化学成分比较分析[J].作物研究,2009,23(2):104-107.
[10]胡小曼,李佛琳,杨焕文,等.丽江烟区烤烟烟叶致香物质和常规化学成分及其相关性研究[J].云南农业大学学报,2011,26(S2):41-46.
[11]Wang JZ,Fan M.Technical Manual of Protein [M].Beijing:Science Press,2000:42-46.
[12]Gan,C.S,Chong,P.K,Pham,T.K.et.al.Technical experimental and biological variations in isobaric tags for relative and absolute quantitation(iTRAQ) [J].Proteome Res 2007,6(2):821-827.
[13]Livak,K.J.and Schmittgen,T.D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J].methods,2001,25:402-408.
[14]Hafner M,Landthaler M,Burger L et al.Transcriptomewide identi fi cation of RNA-binding protein and microRNA target sites by PAR-CLIP.Cell.2010,141(1):129-141.
[15]Wu ΧY,Lu L.Vitamin B6 deficiency,genome instability and cancer.Asian Pacific Journal of Cancer Prevention,2012,13(11):5333-5338
[16]杜娟,张楠,许自成,等.烤烟不同部位烟叶主要化学成分与感官质量的关系[J].郑州轻工业学院学报(自然科学版),2011,26(2) :16-20.
[17]宋纪真,席元肖,魏春阳,等.不同香型烤烟化学成分含量的差异[J].烟草科技,2011(5):29-33
[18]Kuersten S,Radek A,Vogel C,et al Translation regulation gets its ‘omics’ moment.Wiley Interdiscip Rev RNA.2013,4(6):617-30.
Effects of climate conditions on photosynthetic rate and protein expression in Yunyan 87 leaves at vigorous growth stage
CAI Yongzhan#1,ZHOU Puxiong#2,ZHANG Liu2,WANG Zheng2,XU Qionghua3,YANG Huanwen1,MAO Zichao2
1 College of Tobacco Science,Yunnan Agricultural University,Kunming 650201,China;
2 College of Agronomy and Biotechnology,Yunnan Agricultural University,Kunming 650201,China;
3 Yuxi Vocational College of Agriculture,Yuxi ,653106 Yunnan,China
Nicotina tobaccumL.cv.Yunyan 87,were pot-planted by using the same soil cultivation method in areas featuring different climate conditions,i.e.at the farm of Yunnan Agricultural University in Kunming(KM),at Jinzhuang in Yulong County of Lijiang(JZ)and at Pianjiao in Yongsheng county of Lijiang(PJ) respectively.Agronomic traits,SPAD values and net photosynthetic rate(Pn) were determined at vigorous growth period; differential expressed proteins(DEPs) of tobacco leaves were analyzed with methods of iTRAQ and their mRNA level was further veri fi ed by q-RT-PCR ampli fi cation.Proteomic analysis data obtained by iTRAQ showed that DEPs in leaves mainly existed in metabolism of carbon,nitrogen and stress response.Compared with KM,proteins associated reaction of photosynthesis were upregulated while enzymes related to respiratory pathway for sugar consumption were down-regulated in PJ; proteins related to pathway of gluconeogenesis was increased,while enzymes associated respiratory pathways were reduced in PJ; and in both PJ and JZ,enzymes associated to biosynthesis of amino acids and proteins were down-regulated,while the ones related to degradation of amino acids and proteins were up-regulated.mRNA level of six randomly selected DEPs was con fi rmed to have similar expressional trend by q-RTPCR detection verifying the accuracy of proteomic results obtained by iTRAQ.It is also suggested that Lijiang tobacco,which is represented by tobacco of both PJ and KM,accumulate more carbohydrates with reduced content of nitrogen compounds,such as amino acids and proteins in their leaves.This study will help understand the effects of local climate on development of Lijiang tobacco leaves featuring high ratio of carbon and nitrogen content by using methods of proteomics.
nicotiana tabacum;climatic conditions ;prosperous phase;proteomics;iTRAQ
蔡永占,周普雄,张柳,等.不同气候条件对“云烟87”旺长期叶片光合速率及蛋白表达的影响[J].中国烟草学报,2015,21(1)
中国烟草总公司重大科技专项(Ts-03-20110024)、云南省烟草公司科技项目(09YN03)
蔡永占(1984—),博士研究生,主要从事烟草栽培研究,Email:caiyongzhan2010@163.com;周普雄(1991—),本科生,生物技术专业,Email:zhoupuxiong2011@163.com#为同等贡献作者
杨焕文(1963—),学士,教授,主要从事烟草生理生化研究,Email:Mryanghuanwen@126.com;毛自朝(1969—),博士,教授,主要从事分子植物学研究,Email:mao2010zichao@126.com
2013-10-14
:CAI Yongzhan,ZHOU Puxiong,ZHANG Liu,et al.Effects of climate conditions on photosynthetic rate and protein expression in Yunyan 87 leaves at vigorous growth stage[J].Acta Tabacaria Sinica,2015,21(1)

