60Coγ射线辐照剂量对牛血清白蛋白结构的影响
耿胜荣 李新 李查德 鉏晓艳 廖涛 夏和舟 叶丽秀 程薇
摘要:为研究60Coγ射线辐照剂量对牛血清蛋白结构的影响,以单一组分牛血清白蛋白(BSA)为模型,研究BSA水溶液辐照0~50 kGy剂量后的含量、结构和微观形态变化。结果表明,BSA主要由25~214 kDa约10种分子量的蛋白质组成,其中55 kDa的蛋白质含量最大,各组分含量随辐照剂量的增加而下降,辐照50 kGy时几乎全部降解;BSA在210、280 nm处各有1个紫外吸收峰,峰高均随着剂量的增加而下降,辐照30 kGy时280 nm处的峰消失;BSA二级结构中α-螺旋、β-折叠和β-转角、无规卷曲含量分别为40.8%、37.3%和21.9%,α-螺旋含量随辐照剂量增加而下降,其他结构含量呈上升趋势;辐照前后BSA的酰胺Ⅰ带红外吸收峰从1 650.8 cm-1红移至1 655.5 cm-1处;BSA辐照后微观表面由平滑变为褶皱,形成松散的片状。辐照后牛血清白蛋白二级结构发生变化,辐照剂量越大,反应程度越大。
关键词:60Coγ射线;牛血清白蛋白;剂量;结构改变
中图分类号:TS201.6;TL99 文献标识码:A 文章编号:0439-8114(2015)21-5378-04
DOI:10.14088/j.cnki.issn0439-8114.2015.21.045
Effect of 60Coγ Rays Irradiation Dose on Bovine Serum Albumin Structure
GENG Sheng-rong1,LI Xin1,LI Cha-de2,ZU Xiao-yan1,LIAO Tao1,XIA He-zhou1,YIE Li-xiu1,CHENG Wei1
(1.Institute for Farm Products Processing and Nuclear-Agricultural Technology,Hubei Academy of Agricultural Sciences/Hubei Innovation Center of Agricultural Science and Technology,Wuhan 430064,China;2.School of Chemistry ,Chemical Engineering and Life Sciences, Wuhan University of Technology, Wuhan 430070,China)
Abstract:To study the influence of 60Co γ ray irradiation dose on bovine serum component,as a single component model,BSA solution was irradiated by 0~50 kGy respectively and the protein content,secondary structure molecular and morphology were determined. The results showed that the BSA was mainly composed of 10 proteins and the molecular weights were 25~214 kDa,of which the protein content of 55 kDa was the largest one. The protein content was decreased with the increasing of irradiation dose and the content of 10 proteins were degraded after irradiated 50 kGy. The UV-Vis(UV-Visible Spectrophotometer) of BSA appeared two absorption peaks at 210 nm and 280 nm,respectively. The height of two peaks were decreased with the dose increasing and 1 280 nm-peak disappeared after the BSA was irradiated by 30 kGy. The secondary structure content of α-helix,β-fold & β-corner and random coil from BSA were 40.8%,37.3% and 21.9%. The α-helix content decreased with the dose increasing and the other structural content increased with the dose increading. Amide I band of infrared absorption peak of bovine serum albumin shifted from 1 650.8 cm-1 to 1 655.5 cm-1. The BSA had a smooth surface microstructure before irradiation and changed into a loose sheet after irradiaton. Thus,the main effect region of the radical irradiation was α-helix of BSA,subsequently led the increasing of β-fold,β-turn and random coil increases,finally the protein turned from the ordered state into a disordered state,the greater the dose,the greater the degree of reaction.
Key words:60Coγ rays;bovine serum albumin;dose;structure change
牛血清是细胞培养的最重要的组分,它具有促进细胞增殖和诱导细胞分化等生物学功能,与现代生物技术包括基因工程、细胞工程、酶工程和发酵工程的发展有密切关系[1]。由于原料来源和生产环节引入的外源病毒会影响牛血清的品质以及下游生物制品的品质[2],关于60Coγ射线灭活病原菌和破坏细胞的效果早期有大量研究[3,4],但对于牛血清中蛋白组分的生理指标变化未曾涉及,牛血清生物功能的破坏,根本原因在于蛋白质结构和构象的改变,研究辐照对蛋白质结构的影响有利于建立高效的辐照工艺。
牛血清中的蛋白质可分为纤维蛋白原、白蛋白、α1球蛋白、α2球蛋白、β1球蛋白、β2球蛋白和γ-球蛋白等多种成分[5],其中BSA是生物体血浆中含量最丰富的一种载体蛋白质,约占血浆中总蛋白质的52%~62%,因其能够与多种小分子化合物进行可逆的结合而起到体内转运作用,是常用的蛋白质模型。BSA是由607个氨基酸残基组成的一种球蛋白,含有17个二硫键,一个自由半胱氨酸基团,为较大的螺旋形结构。本试验利用紫外光谱(UV-Vis)、红外光谱(FT-IR spectrometer, FT-IR)、圆二色谱(Circular dichroism,CD)和扫描电镜(Scanning electron microscope,SEM),研究辐照后BSA结构的变化,为建立剂量与蛋白质结构变化之间的关系提供理论参考。
1 材料与方法
1.1 试剂与仪器
BSA,分析纯,国药集团化学试剂有限公司;蛋白标样(MBP-β-半乳糖苷酶,分子量175 kDa;MBP-截短型-β-半乳糖苷酶,分子量80 kDa;MBP-CBD,分子量58 kDa;CBD-Mxe intein-2CBD,分子量46 kDa;CBD- Mxe intein,分子量30 kDa),Thermo公司。
γ射线辐照源(60Co源,装源量25.5万居里),湖北省辐照实验中心;扫描电镜(Quanta 200型),荷兰FEI公司;示差扫描量热仪(DSC200F3型),德国Netzsch公司;红外光谱仪(NICOLET 5700型,红外显微镜),美国热电公司;紫外可见分光光度计(T6新世纪),北京普析通用仪器有限责任公司;1515型高效液相色谱泵、2690D型分离模块、2410型折射率检测器、Waters ultrahy drogel 2000型和Waters ultrahy drogel 250型色谱柱,美国Waters公司;圆二色谱(J-810型),日本分光公司(JASCO)。
1.2 试验设计
BSA的100 mg/mL水溶液采用有氧包装后,在常温下(约25 ℃)分别辐照0、10、20、30、40、50 kGy剂量,另外一个处理在低温下(约10 ℃)辐照10 kGy剂量。辐照方式采用动态照射法,平均剂量率约为30 Gy/min。硫酸亚铁剂量计跟踪剂量,照完后样品采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法分析蛋白含量和组分变化;采用UV-Vis、CD、FT-IR、SEM表征结构变化,其中CD测定直接取样稀释,其他指标测定取辐照后BSA的冻干样。
1.3 检测方法
SDS-PAGE:样品浓度1 mg/mL,微孔滤膜过滤,上样量10 μL。分离胶浓度9%,分离胶段电泳电压100 V,浓缩胶浓度4%,浓缩胶段电泳电压60 V,电泳时间2.5 h。
UV-Vis:样品浓度5 mg/mL,蒸馏水溶剂,微孔滤膜过滤,波长扫描范围190~410 nm。
CD:将浓度为0.5 mg/mL的样品注入1.0 cm的石英比色皿中,以去离子水为对照。控制程序为Spectra manager,气体流量为4~5 L/min,检测波长范围190~260 nm,1次数据采集,采集频率200 nm/min。二级结构含量根据仪器自带程序杨氏公式给出。
FT-IR:取冻干样品与KBr混合压片,扫描范围400~4 000 cm-1,分辨率4 cm-1。
SEM:取冻干样品少量黏在金属台上,喷金,电镜扫描。
2 结果与分析
2.1 BSA辐照后蛋白组分及分子量的变化
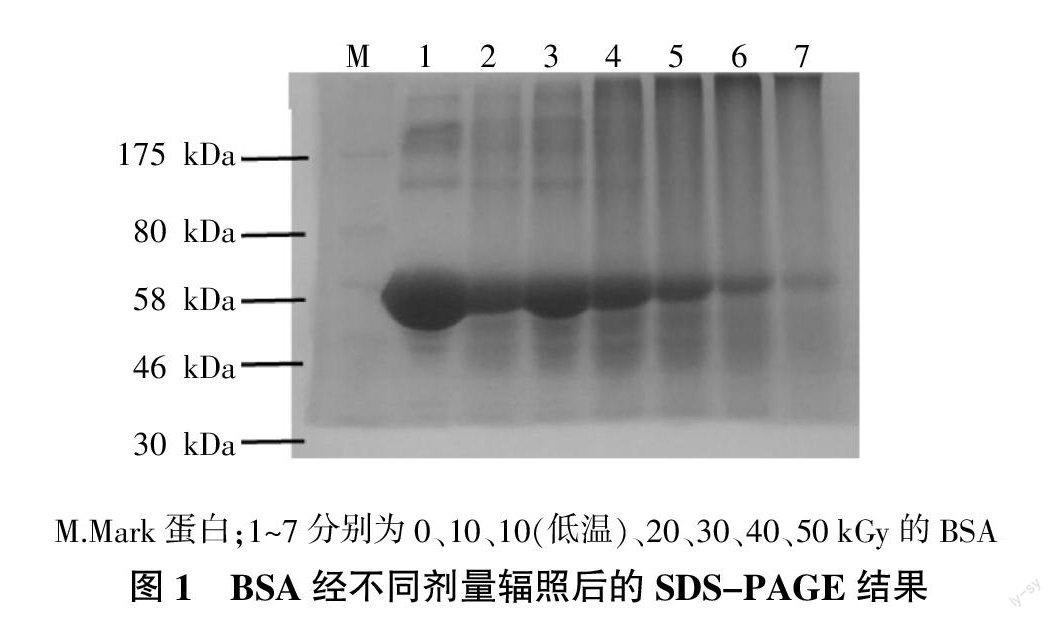
BSA溶液分别辐照0~50 kGy后作SDS-PAGE分析,见图1。未辐照BSA有10条带,1~3条分子量大于175 kDa,第4~5条在175~80 kDa范围,第6条在58 kDa处,浓度相当大,第7~9条在46~30 kDa之间,第10条小于46 kDa。低温辐照10 kGy BSA与常温10 kGy相比条带颜色略深,尤其是在58 kDa处。从20 kGy开始,大于58 kDa的蛋白条带消失,形成均匀的连续分子量的混合物。58 kDa处蛋白条带也逐渐变浅。
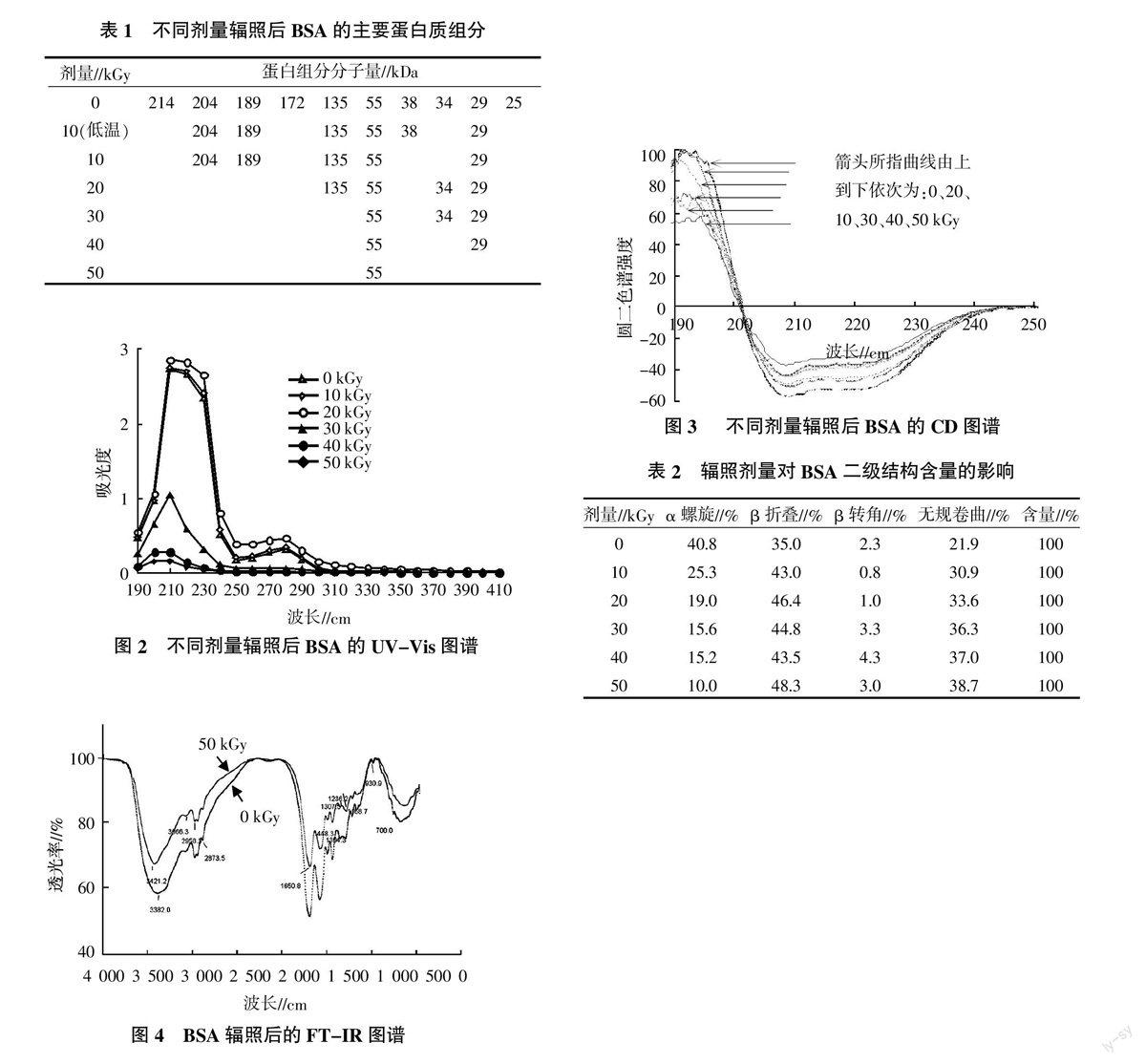
根据迁移距离和标样蛋白质的分子量计算,各剂量对应的条带分子量见表1。未辐照BSA主要由214、204、189、172、135、55、38、34、29、25 kDa这10种分子量蛋白质组成,其中55 kDa分子量蛋白含量最大。经10~50 kGy剂量辐照后,各分子量蛋白逐渐降解消失,形成混合物。
2.2 BSA辐照后UV-Vis光谱吸收变化
BSA溶液分别辐照0~50 kGy后的UV-Vis图如图2所示,未辐照BSA水溶解部分的紫外吸收光谱在210 nm处和280 nm处各有1个峰,吸光度分别为2.74和0.318 L/g·cm,随着剂量的增加峰高逐渐下降,剂量大于30 kGy时,280 nm处的峰消失(图2)。280 nm的吸收峰是分子中的2个色氨酸和19个酪氨酸的芳杂环的Π-Π*和n-Π*跃迁引起的,而210 nm处的吸收峰是由肽键上的C=O的n=Π*跃迁引起的,与BSA的α-螺旋含量有关[6]。辐照引起蛋白质构象发生变化,主要为肽键上的C=O的n=Π*跃迁能量减小和α-螺旋含量减少,且与剂量呈正相关,大于20 kGy辐照后样品的210 nm和280 nm两个紫外吸收峰高下降尤其明显。
2.3 BSA辐照后CD变化
肽链骨架中的肽键、芳香氨基酸残基以及二硫键是主要的光活性生色基团,生色基团对左右圆偏振光吸收不同,造成偏振矢量的振幅差,从而得到蛋白质和多肽分子的二级结构,圆二色谱仪是研究蛋白质构象变化的有效手段。BSA溶液显示(图3)出α-螺旋结构的3个特征峰,192 nm处1个正峰,208、222 nm处2个负峰,吸收强度反映蛋白α-螺旋的含量[7]。
BSA溶液分别经0~50 kGy辐照后,测定样品的CD光谱(图3)。随着辐照剂量的增加,192、208和222 nm处的3个峰值均下降,剂量大于30 kGy时,在192 nm处的峰型发生变化。用杨氏法计算得到BSA二级结构中4种结构的含量,详见表2。随着辐照剂量的增加,α-螺旋含量从40.8%(0 kGy)下降至10.0%(50 kGy),β-折叠和β转角的总含量从37.3%增加至51.3%,无规卷曲从21.9%增加至38.7%。
2.4 BSA辐照后FT-IR变化
牛血清酰胺Ⅰ带主要是氨基酸残基的C=O伸缩振动吸收,是α-螺旋、β-折叠、转角和无规卷曲等不同结构振动峰的加合带,各吸收峰范围在1 600~1 685 cm-1之间,其中1 600~1 640 cm-1归属β-折叠,1 640~1 650 cm-1归属无规卷曲,1 650~1 670 cm-1归属α-螺旋,1 680~1 685 cm-1归属转角结构,1 651 cm-1归属α-螺旋[8]。酰胺Ⅱ带吸收峰范围1 500~1 600 cm-1,包含C-N的伸缩振动和N-H的变形振动[9]。
未辐照和50 kGy辐照BSA溶液红外吸收图谱见图4。未辐照BSA的酰胺Ⅰ带的红外最大吸收位于1 650.8 cm-1附近,表明BSA以α-螺旋结构为主。辐照BSA吸收峰红移至1 655.5 cm-1处,辐照BSA样品酰胺Ⅱ带移至1 536.6 cm-1附近,与未辐照相比,峰高变高并尖锐。红外吸收变化说明辐照使蛋白质的构象发生了变化。
2.5 BSA辐照后SEM结构变化
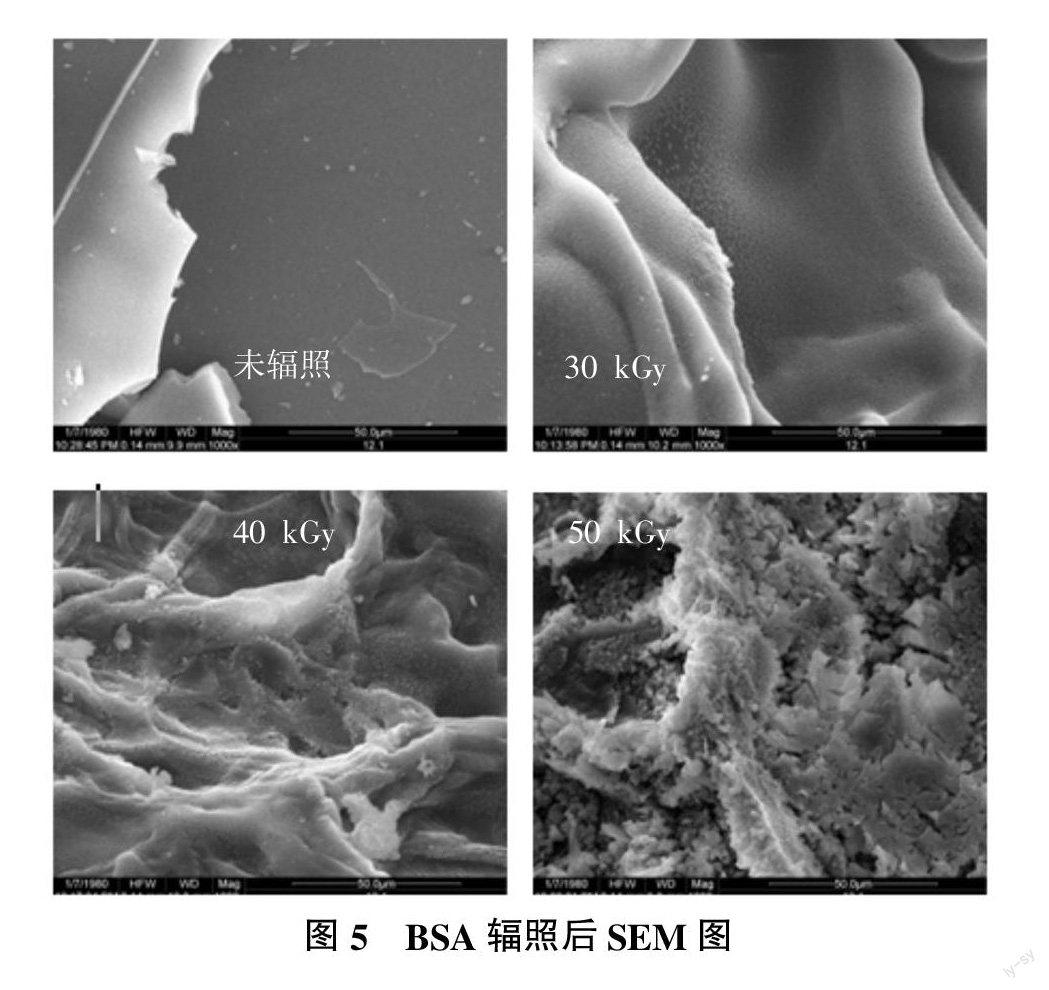
图5为BSA水溶液或凝胶经冻干后的SEM图。由图5可知,未辐照BSA表面光滑,经30 kGy辐照后表面有小量褶皱和小突起,40、50 kGy辐照处理后表面褶皱增加,小突起变为大片状突起。本研究结果与耿胜荣等[10]明胶溶液辐照后因交联反应微观表面变得粗糙相似。
3 讨论
在0~50 kGy辐照范围内,随着辐射剂量的增加,牛血清白蛋白的主要蛋白组分含量逐渐减少,当大于20 kGy辐照后,仅有4种主要蛋白组分(135、55、34、29 kDa)存在,辐照后BSA蛋白质溶解性变差,微观表面呈现松散的片状结构,这与明胶水溶液辐照的特性相似[11],明胶水溶液辐照后蛋白质组分电泳后发生降解反应,蛋白质含量下降,微观表面形成更为紧密的网状结构。
本试验中,α-螺旋含量下降,而β-折叠和β转角、无规卷曲含量升高,α-螺旋含量在辐照剂量0~10 kGy间下降幅度最大,20 kGy后变缓和,这说明辐照自由基主要作用BSA的α-螺旋结构区域。熊泽云等[12]报道的镧(Ⅲ)-芸香甙配合物与人血清白蛋白反应后α-螺旋含量下降,其他结构含量升高,认为二者结合导致人血清白蛋白的构象变化。吴锦绣等[13]报道壳聚糖与牛血清蛋白相互作用导致的208和222 nm圆二色谱峰向低波数移动,以及振幅下降,说明BSA发生降解,从而引起组成和结构的变化。
本试验结果表明,大于30 kGy辐照的BSA溶液在210、280 nm处的紫外光谱吸收峰大幅度下降。薛春霞等[6]认为,抗生素头孢地尼结构中的羧基解离后,离子诱导BSA肽链伸展,内部的色氨酸和酪氨酸残基芳杂环疏水基团裸露,使278 nm处吸收增强;罗红霉素分子中的羟基与BSA肽链中的氨基酸残基中的含氧或含氮基团形成氢键,从而使氨基酸残基中含氧或含氮基团原有的键强减弱,278 nm处吸收峰下降。本试验中辐射引起的BSA紫外减色效应,与罗红霉素的作用效果相同,但结合圆二色谱和扫描电镜结论分析,辐照后的BSA紫外吸收下降,与BSA的疏水基团增加,导致溶解性下降,发色基团含量减少有关,并不是形成了氢键。
50 kGy辐照的BSA酰胺Ⅰ带发生红移,酰胺Ⅱ带峰型变尖锐,说明α-螺旋含量、C-N、N-H键合力发生改变。这与安秀林等[8]的研究报道相同,也与本试验中圆二色谱变化一致。
4 小结
1)未辐照牛血清白蛋白有10种主要蛋白组分,分子量分别为25、29、34、38、55、135、172、189、204、214 kDa,其中55 kDa含量最多。常温高于20 kGy的牛血清辐照灭菌剂量明显造成蛋白的分子量降解,低温有一定的抑制作用。
2)辐照后BSA紫外吸收峰型和圆二色谱峰型均随着辐照剂量的增加而下降;随着辐照剂量增加,BSA的α-螺旋结构含量下降,同时β-折叠、β转角和无规卷曲的含量增加。
3)辐照引起BSA微观表面由光滑渐变为片状突起,辐照引起BSA变性,导致蛋白溶解性变差。
参考文献:
[1] 刘学平,魏至栋,谢 澎,等.新生牛血清促牛肾细胞生长试验测定方法的建立[J].微生物学免疫学进展,2010,38(3):24-27.
[2] 张 强,李树清,李 健,等.进口胎牛血清中牛病毒性腹泻病毒污染的检测[J].中国动物检疫,2013,30(2):55-57.
[3] 王 杰,张 健. 60Coγ射线辐照的犊牛血清对细胞培养及病毒增殖的影响[J].畜牧兽医科技信息,2013(1):30-32.
[4] 李福安,李玉凡,鲍松滨.辐照小牛血清对生物指标影响的初步探讨[J].中国辐射卫生,2010,119(3):354-355.
[5] 陆连寿,张秀英,王在时,等.液相色谱法分析牛血清中IgG的方法研究[J].分析仪器,2012(3):40-48.
[6] 薛春霞,董社英.四种抗生素与牛血清白蛋白相互作用的紫外吸收光谱法研究[J].湖北农业科学,2014,53(16):3855-3858.
[7] FASMAN G D. Circular dichrosim and the conformational anaysis of biomolecules[M]. New York:Plenum Press,1996.738-740.
[8] 安秀林,李庆忠,刘海萍,等.溴化十六烷基三甲基铵与牛血清白蛋白相互作用的红外光谱研究[J].西南师范大学学报(自然科学版),2005,30(4):699-702.
[9] 李晓霞,张 萌,罗贤文,等.甲氨蝶呤与牛血清白蛋白相互作用的光谱和分子对接研究[J].分析试验室,2013,32(6):41-45.
[10] 耿胜荣,廖 涛,李 新,等.60Co-γ不同剂量辐照对明胶特性的影响[J].食品科学技术学报,2013,31(4):28-31.
[11] 耿胜荣,汪 兰,廖 涛,等.60Co-γ射线辐照剂量对明胶特性和结构的影响[J].原子能科学技术,2014,48(3):512-517.
[12] 熊泽云,张华新,王洪林,等.镧(Ⅲ)-芸香甙配合物与人血清白蛋白作用特征的研究[J].化学与生物工程,2014,31(5):24-27.
[13] 吴锦绣,李 梅,柳召刚,等.分子量为3000的壳聚糖与牛血清白蛋白相互作用的研究[J].功能材料,2014,45(17):17040-17044.

