管壳式自热型氨分解反应器模拟分析
王一帆,段学志,吴炜,周兴贵
管壳式自热型氨分解反应器模拟分析
王一帆1,段学志1,吴炜2,周兴贵1
(1华东理工大学化学工程联合国家重点实验室,上海200237;2国立成功大学化工系,台湾台南70101)
建立了管壳式自热型氨分解反应器,其中管内为拟均相催化反应,管外壳程为考虑气膜传递阻力的非均相催化反应。通过模拟比较和分析了氨气和氢气-空气混合物并流与逆流操作的反应结果。在并流操作中,氢燃烧产生的高温正好与高氨气浓度对应,氢燃烧热被充分用于氨分解反应,因此反应效率要显著高于逆流操作。与等温反应器的比较分析表明,在自热和高转化率条件下并流操作的效率与等温操作效果很接近。
化学反应器;数学模拟;制氢;氨分解;并流操作
引 言
氢是一种备受关注的二次能源,具有清洁、高效、应用形式多样等诸多优点[1]。用于氢能转化方面的质子交换膜燃料电池运行温度较低,启动快速,在汽车和便携式设备领域有广泛的应用前景。由于CO会毒化燃料电池阳极催化剂,传统的制氢过程如烃类水蒸气重整,需要增加脱碳、净化步骤,工艺复杂[2-6]。而氨分解制备无CO的燃料电池用氢过程简单,作为移动制氢工艺具有显著优势。氨气储氢量高(17.6%,质量),价格低廉,易于液化存储。其成熟的合成、运输、使用技术也为氨分解制氢路线的推广提供了良好的技术支持[7-11]。
氨分解是可逆吸热反应。为了保证氨分解完全,反应必须在高温(823.15 K以上)进行。可利用燃料电池通过电加热维持反应温度和提供反应热,这样虽可简化氨分解反应器结构,但从能量利用效率角度不可取[12]。更可行的方式是将部分氢气燃烧以提供反应热。通过烧氢提供反应热还有一个优点,即可充分利用氢纯化过程产生的不纯废氢、或氢燃料电池发电后的尾氢,这样能从总体上提高能量使用效率。铁、钴、镍及其合金是最常用的氨分解催化剂,而氢燃烧常用高活性负载铂催化剂。将烧氢催化剂涂覆在氨分解反应管外壁,可显著提高传热效率。类似的在反应管内进行一种反应、在外管壁进行另一种反应以有效利用反应热的例子还有很多,如管内进行裂解反应、管外进行甲烷催化燃烧反应等[13-15]。
对本文关注的氨分解反应体系,用于提供燃烧热的氢气可与氨气并流,也可逆流。本文通过模拟研究这两种流动方式的反应特点,并与等温反应器进行比较,为通过反应热耦合在一起的反应器设计优化提供参考。
1 反应器结构
自热型氨分解反应器由两个同心的圆筒构成,呈管壳结构。管内填充氨分解催化剂颗粒;壳内是空心的,在内管外壁上均匀地涂覆着烧氢催化剂。氨气在管式固定床内分解,氢气在壳程中非均相燃烧(反应仅发生在管壁上)。整个反应器为绝热操作,两个反应同时进行,由氢气燃烧对反应器供热,维持氨分解反应。氨分解的产物经过分离纯化,再分为两股,一股氢气跟空气混合后通入壳程燃烧供热,另一股直接进入燃料电池发电(图1)。如前所述,用于提供反应热的氢气可以是来自于氢分离的废氢或发电后的尾氢。本文重点在于分析反应器的操作方式对反应结果的影响,暂不考虑总体能量利用效率,因此以纯氢与空气混合进行反应。无论是纯氢、废氢还是尾氢,从模拟分析的角度,仅在于混合气体热容和为了维持反应热平衡所需的混合气体总流率的差别,这可从以下的反应器模型中 看出。
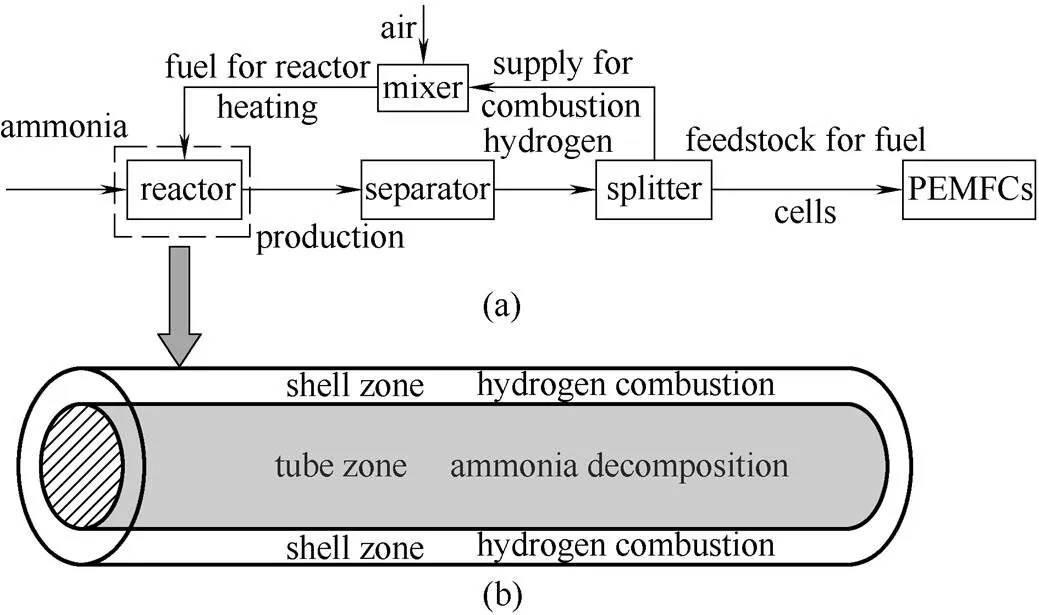
图1 氨分解制备燃料电池用氢(a)、自热型氨分解反应器(b)
2 反应器数学模型
采用一维定态模型对管程的氨分解反应和壳程的氢气非均相燃烧进行数学模拟,均不考虑轴向扩散。模型描述了管程和壳程的物料衡算、能量衡算、压力分布以及表观线速度的分布[16]。
2.1 数学模型
2.1.1 管程内氨分解 床层空隙率恒定,催化剂颗粒均一。对于变分子反应,结合衡算方程和压力分布,通过理想气体状态方程计算固定床的表观线速度。通过Ergun方程计算床层压降[17]。
2.1.2 壳程内氢燃烧 氢气燃烧为快速反应,受气膜传递的影响,因此需要考虑气相主体和催化剂外表面之间的物质和能量传递。由于催化剂涂层很薄,不计涂层内部传递的影响。氢气燃烧在常压下进行,忽略壳程内的气体流动阻力。类似地,利用理想气体状态方程可以计算流体的线速度。
气相主体
以上方程前的加减号分别代表并流操作和逆流操作。
气膜
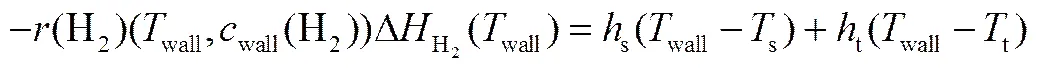
2.2 模型参数
2.2.1 动力学方程 模拟采用Ni-Pt/Al2O3催化剂上的氨分解反应动力学[18],以及氢气在Pt金属表面的一步反应动力学[19]。
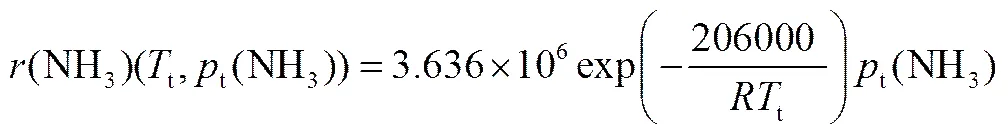
2.2.2 传质系数 通过Sherwood数()Reynolds数()和Schmidt数()可以计算壳程的传质系数g[20]。
2.2.3 传热系数 环隙内的层流对流传热系数s与Nusselt数()Reynolds数Prandtl数()和Grashof数()相关[22]。其中的黏度项和自然对流项分别取1.05和1。
固定床传热系数t与Reynolds数相关[23]。
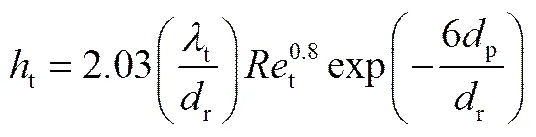
2.2.4 物性参数 模拟计算中混合气体的黏度、热导率、比热容以及与温度相关的反应生成焓等数据均利用DIPPR物性数据库计算求得。
2.3 边界条件和数值方法
2.3.1 边界条件 对并流操作,氨气和氢气-空气混合物从处分别进入管程和壳程。入口摩尔流量恒定,入口温度等于进料温度,管程出口压力等于常压。
对逆流操作,管程的边界条件不变。恒摩尔流量的氢气-空气混合物从处进入壳程,入口温度等于进料温度。
2.3.2 数值方法 通过gPROMS Modelbuilder v3.6模拟平台建立上述数学模型。反应器被分割成500个均匀的离散点,轴向位置的空间导数通过中间差分法进行计算。
3 模拟计算结果和讨论
反应器几何尺寸见表1。在自热型氨分解反应器中,氨分解反应和氢气燃烧同时进行,由氢气燃烧对氨分解反应供热。根据能量守恒,如进料温度一定,氨气和氢气的摩尔进料流率应该满足式(13)
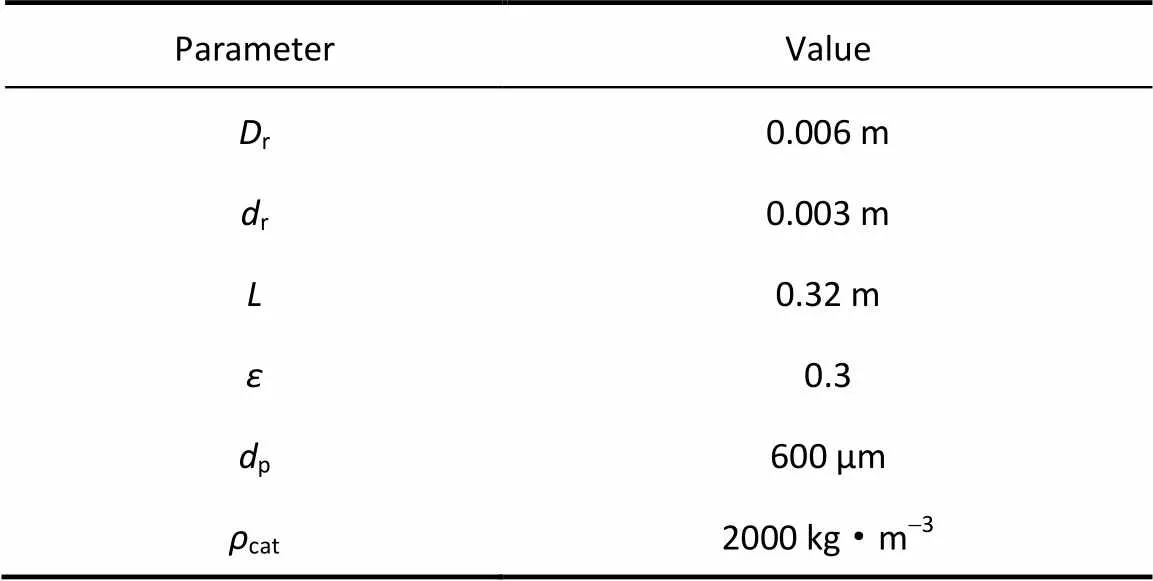
表1 反应器尺寸及相关物性参数
3.1 并流操作
进料温度913.15 K,氨气的摩尔流量为6.00×10-4mol·s-1。氢气-空气的混合物以并流方式通入壳程,其摩尔流量通过氢气摩尔组分和式(13)确定。其中,氢气组分的摩尔流量为1.33×10-4mol·s-1,相当于管程氨气完全反应产氢量的14.78%。
表2列出了具体的进料条件和模拟结果。氨分解和氢气燃烧的反应转化率分别为99.59%和99.90%。管程和壳程出口温度的差异很小,说明在模拟条件下反应器内的换热是充分的。尽管反应器内部轴向方向上温度变化很大,但管程和壳程的出口温度均非常接近进料温度。反应焓作为状态函数,只取决于系统的始态和终态,与中间变化过程无关。当进料条件满足式(13),而反应器内两个区域均反应完全且充分换热,则出口温度一定等于进料温度。
图2和图3是反应器内的反应速率曲线和温度曲线。入口处因氢气浓度很高,反应剧烈放热,而且管外壁与壳程混合气体换热受外扩散的影响,因此壁温特别高。氨的分解速率沿轴向逐渐降低[图2 (b)],主要是由于氨气浓度不断下降。由于入口氨气温度较高,氨分解速率较快;尽管有管外燃烧供热,但供热速率不及氨分解的吸热速率,管内温度有所下降。之后因氨分解速率下降,管内温度逐渐上升。由于氢气不断消耗,管壁的温度沿轴向不断降低。在接近反应器出口处,因氨和氢气浓度很低,氨分解和氢燃烧都不显著,只发生管内外的换热,使管内、管壁、壳层环隙三者温度逐渐趋同。
表2 并流模拟结果
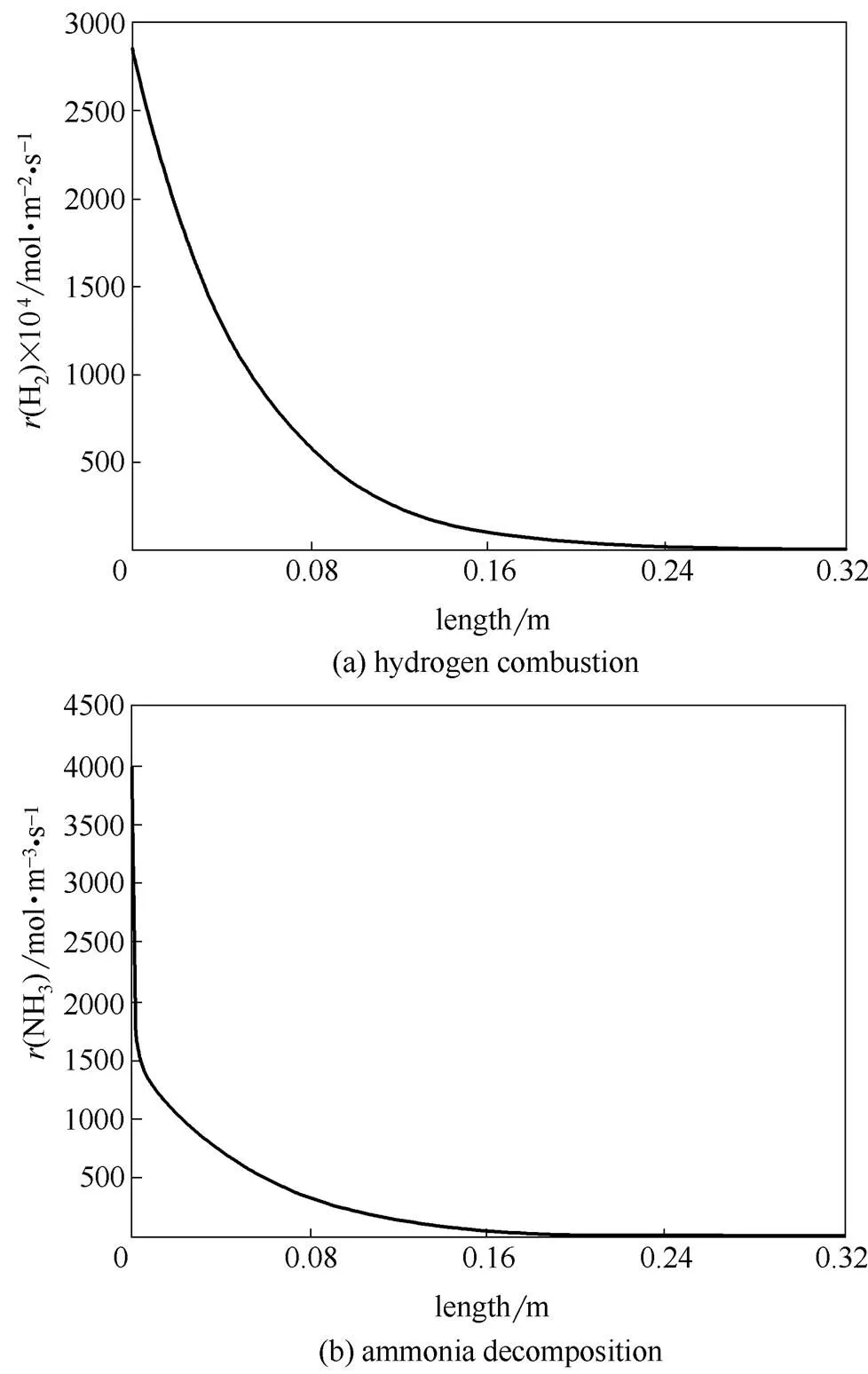
图2 并流操作氢燃烧、氨分解反应速率曲线
在并流操作条件下,壳程氢气剧烈燃烧的位置与高浓度氨出现的位置一致,燃烧产生的高温促进了氨的快速分解,这使氨气在很短的距离内接近完全转化。无疑这有利于减少反应器体积。
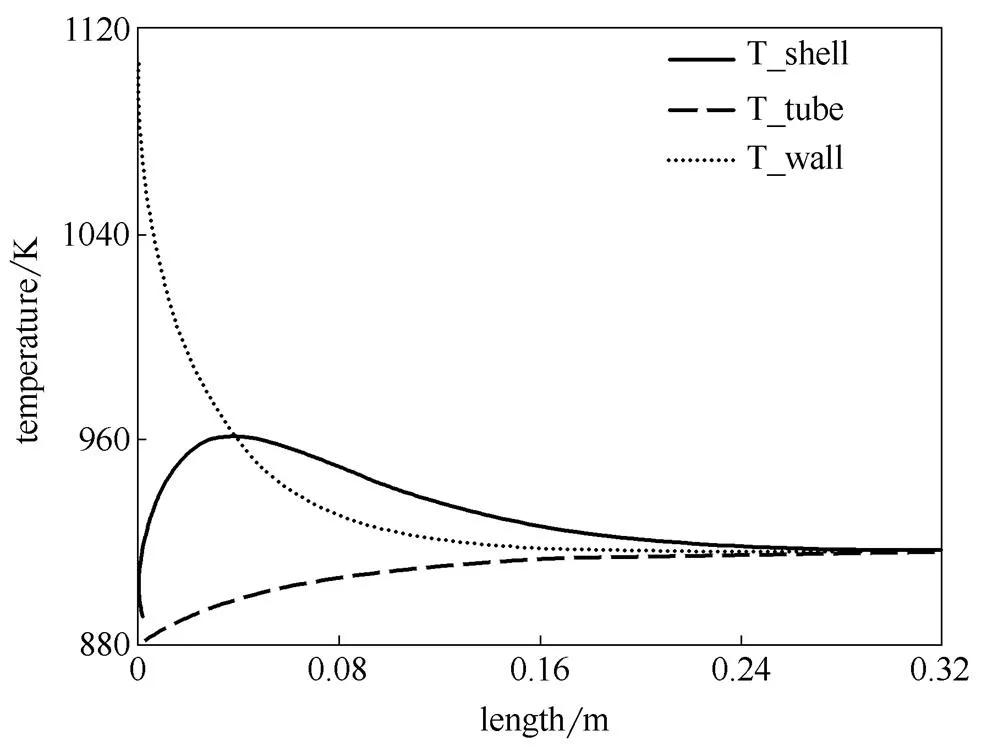
图3 并流操作壳程、管程和管壁温度曲线
3.2 逆流操作
在逆流操作条件下,氢气-空气的混合物从反应器末端通入壳程,其余操作条件以及反应器几何尺寸均与并流操作保持一致。
表3列出了逆流操作的模拟结果。壳程内氢气几乎完全反应,因为催化剂有足够的活性,而且氢燃烧是放热反应,不受平衡限制。但管程中氨气的转化率仅为90.92%。壳程的出口温度低于入口温度,管程的出口温度高于入口温度,表明壳程将氢气燃烧产生的热量,甚至进料的部分显热都传递给了管程,但是这些能量却没有使氨气完全转化,只是提升了管程的出口温度。可见,逆流操作效果不佳,并不是换热情况差。
图4比较了并、逆流条件下,管程中氨气摩尔分数沿轴向的分布情况。在并流条件下,氨气的摩尔分数在反应器中前段迅速降低;而对逆流操作,氨气的摩尔分数在入口段下降一些后其下降速率就变得很慢,在反应器中后段才加速下降。氨分解反应主要集中在反应器的后半部分,而且最终未反应完全。
图5是反应器内的氨分解和氢燃烧速率曲线。烧氢反应主要集中在反应器中后段(靠近氢气入口),而在反应器前段,几乎没有燃烧供热,仅是管程和壳程通过管壁相互换热。因为固定床传热系数远大于环隙传热系数,管壁温度接近管程温度。

表3 逆流模拟结果
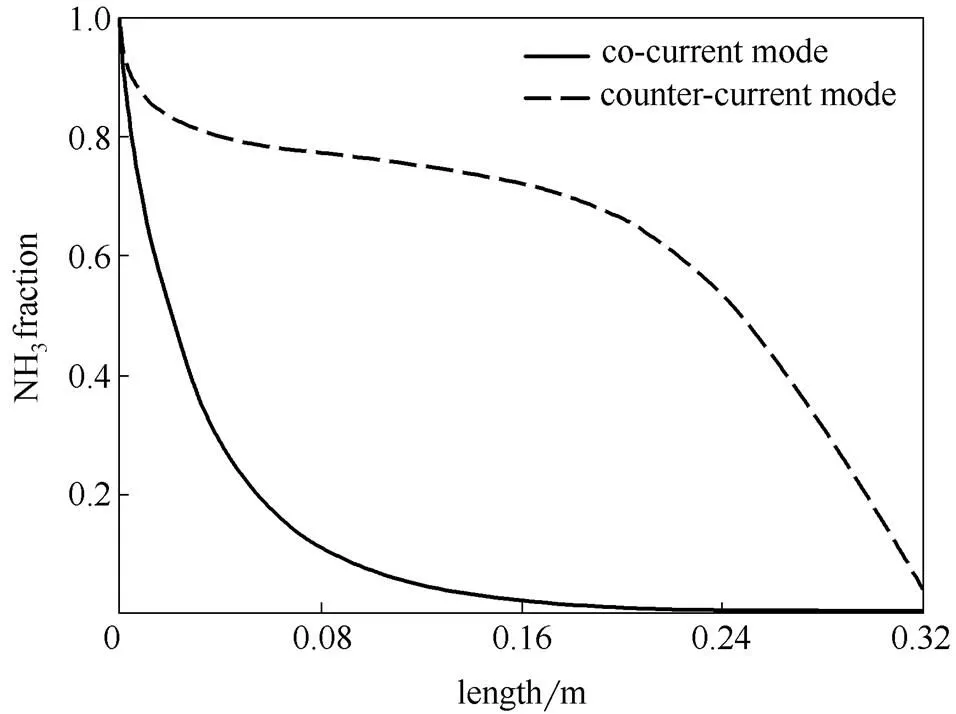
图4 管程氨气摩尔分数曲线对比
反应器入口处,氨分解吸热,但管外氢气几乎耗尽,不能提供足够的反应热,管程温度急剧下降,反应几乎无法进行。从图5 (b)可看出,在前半段反应器内有一段死区,氨分解反应速率几乎为0。只有在反应器中后段,主要由于氢气燃烧的供热,管程温度升高,氨分解反应才得以部分恢复。
图6是逆流条件下管内、管壁、壳层环隙内温度分布。在氢气的入口附近,由于氢气剧烈燃烧放热,管壁温度很高;但由于此处氨浓度较低,氨分解速率较慢,相当一部分氢气燃烧热用于加热壳程的气体。这部分高温气体再通过气膜的对流传热和管壁的热传导与管程的气体换热用于氨分解反应,其自身温度逐渐降低。在氨气的入口处,由于氨气入口温度较高,热量传递的方向是从管内到管外。
在以上的模拟条件下,氨分解的转化率只有约90%。为了保证氨分解的高转化率,一个自然的想法是增加反应器长度。图7是在不同长度的反应器内氨分解反应的速率曲线。可见增加反应器的长度只会增加“死区”长度,对提高氨分解转化率的作用很小。表4列出了不同长度反应器对应的氨分解转化率,印证了上述判断。
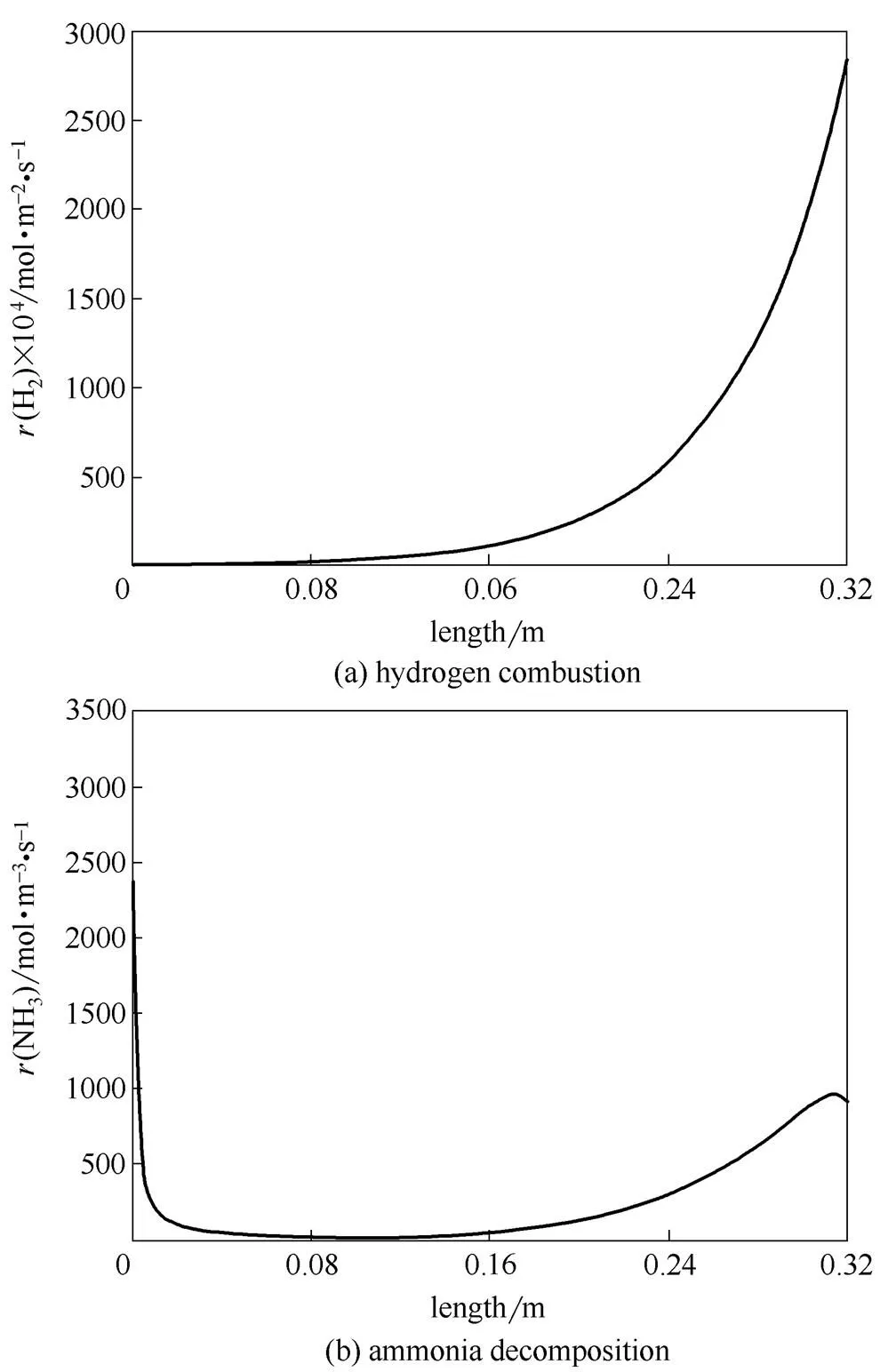
图5 逆流操作氢燃烧、氨分解反应速率曲线
反应器在逆流条件下操作,氢气放热速率与氨分解速率未能实现合理匹配,使氢气燃烧产生的高温未得到很好利用,部分燃烧热先用于加热壳程反应气体,再传给管内用于氨分解,这相当于增加了传热阻力,提高了反应热的火用损失,反应器的效率因此低下。
3.3 等温操作
前面的分析表明,并流操作使氢燃烧产生的高温正好与高氨气浓度对应,因此反应器效率要显著高于逆流操作。尽管如此,在反应器入口段,氢燃烧供热速率仍赶不上氨分解的吸热速率,因此管程在入口附近有一个温度下降过程。如果在入口段提高氢燃烧的放热强度(这可通过提高入口附近烧氢催化剂的量),直至管程的反应温度维持不变(类似于等温操作),无疑能够进一步提高反应器效率(即为达到相同转化率,需要的反应器体积更小,或者说在反应器内外管直径不变的情况下反应器长度可以更短)。为了确定并流操作与这种理想操作的差距,这里对等温反应器进行了模拟。模拟时只考虑管内氨分解,入口条件与并流操作的入口条件相同,床层温度为并流操作的管程入口温度,即913.15 K,与并流操作的管程出口温度915.45 K接近。

图6 逆流操作壳程、管程和管壁温度曲线
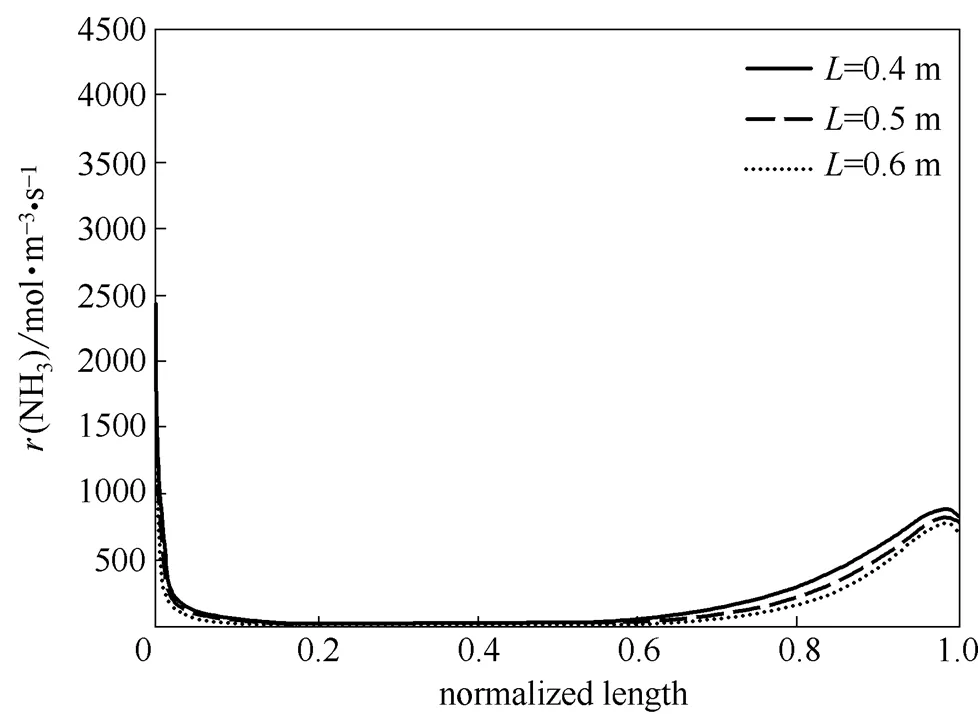
图7 不同长度反应器逆流操作的氨分解反应速率曲线

表4 不同长度反应器逆流操作的氨分解转化率
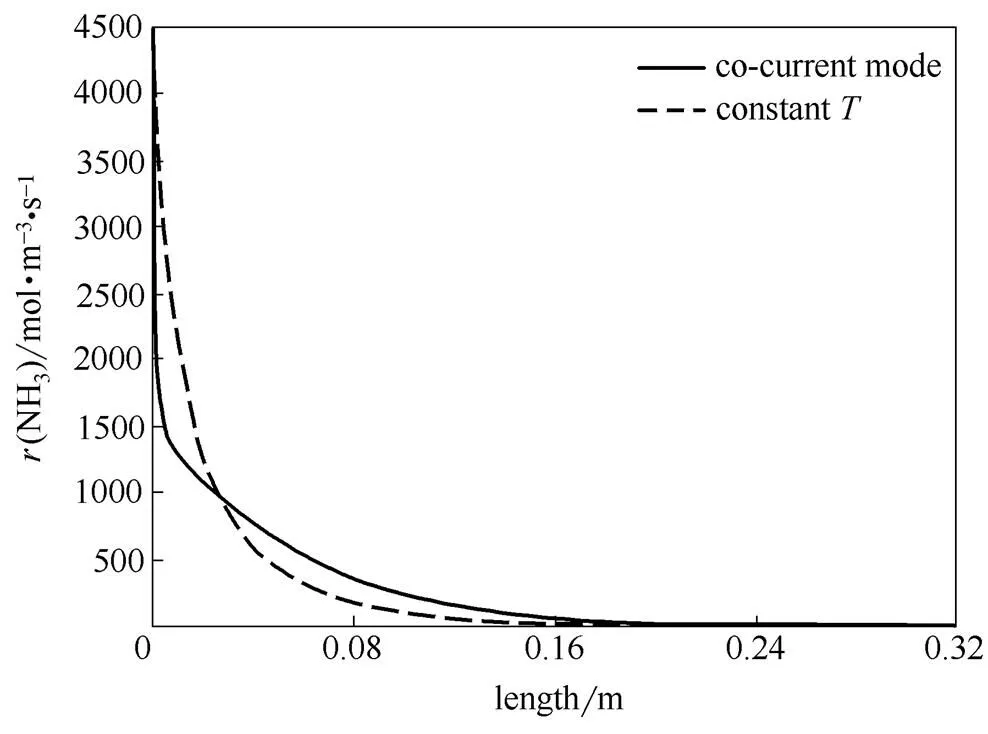
图8 氨分解反应速率曲线对比

图9 氨分解反应转化率曲线对比
图8比较了并流与等温操作时管内的氨分解的反应速率曲线。在反应器入口附近,等温操作比并流操作有更大的氨的分解反应强度,随着氨的不断消耗,氨的分解反应强度逐渐低于并流操作。
图9为等温操作和并流操作条件下氨气转化率沿管长的变化。可见在达到相同转化率时等温操作需要的反应器体积要小,说明等温反应器更有效。但要实现反应器等温操作要降低反应管直径,或对反应管进行非均匀加热,这从另一方面提高了反应器的制造成本。此外,为了实现氨的充分利用,也为了尽可能降低对环境的影响,氨制氢通常都要求很高的转化率。而图9表明,氨分解转化率越高,二者的差异越小。
4 结 论
本文针对管内进行氨催化分解反应、管外壁面上进行氢催化燃烧反应的吸热与放热耦合反应过程,建立了一维自热氨分解反应器模型,其中管内为拟均相反应,管外壳程为考虑气膜传递阻力的非均相反应,并通过模拟比较了氨气和氢气-空气混合物并流与逆流操作的反应结果。在并流操作中,氢燃烧产生的高温正好与高氨气浓度对应,氢燃烧热被充分用于氨分解反应,因此反应效率很高。在逆流操作中,氢燃烧产生的高温正好与低氨气浓度对应,燃烧热未被充分用于氨分解,而是用于混合气体自身的加热。氢燃烧的尾气只是在最后才通过催化剂涂层和反应器壁用于氨分解,但此时尾气的温度已显著低于其入口段反应器壁温度,因此效率很低。与等温反应器的比较分析表明,在自热和高转化率要求下并流操作的效率与等温操作效果很接近。这些结论也适用于其他通过管外催化燃烧供热、管内反应物几乎要完全转化的自热反应器。
符 号 说 明

A——横截面积,m2 Cp,m,g——气体混合物摩尔定压热容,J·mol-1·K-1 c——浓度,mol·m-3 D——分子扩散系数,m2·s-1 Dr——外管直径,m dp——催化剂颗粒直径,m dr——内管直径,m F——摩尔流率,mol·s-1 ΔH——反应焓,J·mol-1 h——传热系数,W·m-2·K-1 kg——传质系数,m·s-1 R——理想气体常数,J·mol-1·K-1 r(H2)——Pt金属表面氢气一步反应动力学系数,mol·m-2·s-1 r(NH3)——Ni-Pt/Al2O3催化剂的氨分解反应动力学系数,mol·(kg cat)-1·s-1 p——压力,Pa T——温度,K u——表观线速度,m·s-1 ε——床层孔隙率 λ——热导率,W·m-1·K-1 μ——黏度,Pa·s υ——化学计量系数 ρ——密度,kg·m-3 上角标 in——进料属性 下角标 cat——催化剂 i——气体组分,iNH3, H2, N2, O2, H2O s——壳程 t——管程 wall——内管外壁
[1] Dunn S. Hydrogen futures: toward a sustainable energy system [J]., 2002, 27 (3): 235-264.
[2] Choudhary T V, Sivadinarayana C, Goodman D W. Production of CO-free hydrogen for fuel cellsstep-wise hydrocarbon reforming and catalytic dehydrogenation of ammonia[J]., 2003, 93 (1): 69-80.
[3] Amphlett J C, Evans M J, Jones R A,. Hydrogen production by the catalytic steam reforming of methanol (Ⅰ): The thermodynamics [J]., 1981, 59 (6): 720-727.
[4] Lin Y M, Rei M H. Study on the hydrogen production from methanol steam reforming in supported palladium membrane reactor[J]., 2001, 67 (1): 77-84.
[5] Sohn J M, Chang Byun Y, Yeon Cho J,. Development of the integrated methanol fuel processor using micro-channel patterned devices and its performance for steam reforming of methanol [J]., 2007, 32 (18): 5103-5108.
[6] Tan Ö, Maşalacı E, Önsan Z I,. Design of a methane processing system producing high-purity hydrogen [J]., 2008, 33 (20): 5516-5526.
[7] Metkemeijer R, Achard P. Comparison of ammonia and methanol applied indirectly in a hydrogen fuel cell [J]., 1994, 19 (6): 535-542.
[8] Zhang J, Xu H, Li W. High-purity CO-free H2generation from NH3the ultra permeable and highly selective Pd membranes[J]., 2006, 277 (1): 85-93.
[9] di Carlo A, Dell’Era A, Del Prete Z. 3D simulation of hydrogen production by ammonia decomposition in a catalytic membrane reactor [J]., 2011, 36 (18): 11815-11824.
[10] Li G, Kanezashi M, Yoshioka T,. Ammonia decomposition in catalytic membrane reactors: simulation and experimental studies [J]., 2013, 59 (1): 168-179.
[11] Ganley J C, Seebauer E G, Masel R I. Development of a microreactor for the production of hydrogen from ammonia[J]., 2004, 137 (1): 53-61.
[12] Alagharu V, Palanki S, West K N. Analysis of ammonia decomposition reactor to generate hydrogen for fuel cell applications[J]., 2010, 195 (3): 829-833.
[13] Lu Zexiang (卢泽湘), Ji Shengfu (季生福), Liu Hui (刘辉), Li Chengyue (李成岳). Indirect thermal coupling between methane combustion and dodecane dehydrogenation reactions[J].(化工学报), 2011, 62 (11): 3130-3135.
[14] Frauhammer J, Eigenberger G, Hippel L V,. A new reactor concept for endothermic high-temperature reactions[J]., 1999, 54 (15): 3661-3670.
[15] Zanfir M, Gavriilidis A. Catalytic combustion assisted methane steam reforming in a catalytic plate reactor[J]., 2003, 58 (17): 3947-3960.
[16] Chen Gantang (陈甘棠). Chemical Reaction Engineering (化学反应工程) [M]. Beijing: Chemical Industry Press, 2007: 186-203.
[17] Ergun S. Mass-transfer rate in packed columns—its analogy to pressure loss[J]., 1952, 48 (5): 227-236.
[18] Chellappa A S, Fischer C M, Thomson W J. Ammonia decomposition kinetics over Ni-Pt/Al2O3for PEM fuel cell applications[J].:, 2002, 227 (1): 231-240.
[19] Schefer R W. Catalyzed combustion of H2/air mixtures in a flat plate boundary layer (Ⅱ): Numerical model[J]., 1982, 45: 171-190.
[20] Skelland A H P. Diffusional Mass Transfer[M]. New York: Wiley, 1974: 253-255.
[21] Poling B E, Prausnitz J M, O’connell J P. The Properties of Gases and Liquids[M]. New York: McGraw-Hill, 2001: 647.
[22] Chen C Y, Hawkins G A, Solberg H L. Heat transfer in annuli[J]., 1946, 68: 99-106.
[23] Li C H, Finlayson B A. Heat transfer in packed beds—a reevaluation[J]., 1977, 32 (9): 1055-1066.
Modeling and analysis of concentric self-thermal fixed-bed reactor forammonia decomposition
WANG Yifan1, DUAN Xuezhi1, WU Wei2, ZHOU Xinggui1
(State Key Laboratory of Chemical EngineeringEast China University of Science and TechnologyShanghaiChinaDepartment of Chemical EngineeringNational Cheng Kung UniversityTainanTaiwanChina
A concentric self-thermal reactor, in which ammonia decomposition is carried out in the center tube and hydrogen combustion takes place in the annulus was analyzed by modeling and simulation. The performance of the reactor with hydrogen-air flow co-current or counter-current to the ammonia flow was investigated and compared with that under isothermal condition. In the co-current mode, the high concentration of ammonia corresponds with the high heat generation rate of hydrogen combustion, while in the counter-current mode, the combustion heat is firstly used to increase the temperature of the hydrogen-air flow then used by ammonia decomposition. Therefore, the reactor with co-current flow is much more efficient in terms of the high conversion and the full use of hydrogen combustion heat. The co-current flow reactor performs as well as an isothermal reactor when a high conversion is realized.
chemical reactor; mathematical modeling; hydrogen production; ammonia decomposition; co-current flow pattern
2015-05-21.
Prof. ZHOU Xinggui, xgzhou@ecust.edu.cn
10.11949/j.issn.0438-1157.20150639
TQ 021.8
A
0438—1157(2015)08—3169—08
周兴贵。
王一帆(1989—),男,硕士研究生。
国家自然科学基金项目(21306046);高等学校学科创新引智计划(B08021)。
2015-05-21收到初稿,2015-05-30收到修改稿。
supported by the National Natural Science Foundation of China (21306046) and the Programme of Introducing Talents of Discipline to Universities (B08021).

