用于多脑区神经环路解析的新型光电极阵列
刘瑶函李 娟钟 成唐永强鲁 艺
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
用于多脑区神经环路解析的新型光电极阵列
刘瑶函1,2李 娟1,2钟 成1,2唐永强1鲁 艺1
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
光遗传技术已被广泛用于神经环路的精确解析,帮助人们深入理解神经精神疾病的发病机制。然而在活体水平实现多脑区的光遗传调控和电生理记录仍然极具挑战。文章介绍了一种制备多脑区光电极阵列的方法。这种光电极阵列包含微电极支架和步进装置,可以同时对小鼠4个脑区的自发电生理信号(包括神经元放电和场电位)和光遗传调控后诱发的电生理变化进行记录。此外,还采用电化学修饰技术,显著降低了电极界面阻抗,提高了电生理记录信号的质量和稳定性。文章利用该光电极阵列对光遗传调控前后不同脑区之间神经元的同步化关系进行了分析,通过 4', 6-二脒基-2-苯基吲哚染色确定了光电极的植入位点。实验结果表明,这种多脑区光电极阵列适用于多脑区水平的研究,并且容易与其他在体研究方法结合,实现对特定神经环路的精确解析。
光遗传学;多脑区;神经环路解析;光电极阵列;表面修饰
1 引 言
目前,全球脑疾病的患者人数已经超过 5亿,由此产生的医疗负担每年达数万亿美元,高居全部疾病之首。为了深入了解脑疾病的发病和干预机制,推动新型诊疗技术的发展,各国纷纷加大了对脑科学研究的投入。例如,欧洲在 2013年初启动了投入 15 亿美元的人脑工程;美国随后也启动了名为“通过推动创新型神经技术开展大脑研究计划”(即原“脑活动图谱计划”),旨在绘制出人脑活动图谱,了解脑的运行机理,继而帮助促进正常的脑功能和疾病状态下的脑功能恢复[1,2]。由此可见,脑科学研究已经成为全球共同关注的焦点之一。
高细胞特异性和高时空精准的神经环路结构和功能解析是理解和治疗脑疾病的基础,而以光遗传技术为代表的新一代脑图谱解析技术是实现这一目的的关键。光遗传技术是正在迅速发展的一项多学科交叉的生物技术,它通过光感基因病毒载体实现细胞的选择性调控,利用光刺激实现外界信息的写入,借助在体光电极阵列技术实现特定行为下的电生理信息读取,进而精确解析某一特定神经环路的功能特征以及与行为输出之间的联系。Nature Methods 期刊在 2010年将光遗传技术评选为当年的最佳技术(Method of the Year),并且在 2014年对最近十年重大技术的回顾(Ten Years of Methods)中评论道“光遗传技术引发的革命正在改变神经科学”。光遗传技术已经成为神经科学研究中不可或缺的技术,正在被越来越多的实验室用于神经环路功能的精确解析当中。
由于光遗传技术同时兼具毫秒级别的时间分辨率和细胞选择性,弥补了经典药理学和膜片钳电生理等技术的局限性,因此,其在过去的几年中被广泛应用脑科学的研究中,帮助研究者们回答了许多传统方法无法回答的难题。借助光遗传技术,人们深入研究了记忆的存储、提取和消退等过程,实现了对帕金森氏病和癫痫等疾病的在体干预,并且成功解析了与焦虑、抑郁、成瘾、恐惧和抉择等行为相关的神经环路。然而,目前光遗传技术研究工具的发展相对滞后,无法完全满足科研的需求。大脑特定功能的实现是不同脑区神经元协同作用的结果,如何在自由活动动物多脑区水平稳定地实施光遗传调控下的神经环路编码解析,仍然是困扰研究者们的一大难题。
早在 20 世纪80年代,多通道电生理记录技术就已经开始用于记录神经元胞外的电信号来评价神经元的电活动[3],但目前用于神经环路解析的光电极阵列仍多采用实验室自制的方式:在商品化的钨丝电极、犹他电极[4]、密歇根电极[5]以及金属丝电极阵列等[6,7]的基础上实现。人类大脑异常复杂,某一行为或某一种疾病同时可能涉及到多个神经网络中的多个环路[8]。因此,必须发展一种易于制备和使用的多脑区光电极阵列同时对多个脑区的神经环路进行解析。然而,目前尚无文献报道在自由活动水平实现多脑区步进式光遗传调控和电生理记录的光电极阵列装置。
此外,由于植入式光电极阵列直接与神经组织接触,因此必须考虑其生物相容性问题。当光电极阵列植入体内后,由于手术创伤或者植入装置的生物相容性问题往往会引起炎性反应,进而形成组织包囊,使得电极界面阻抗急剧升高。另外,炎性反应也可能会导致植入电极周围神经元的缺失,增大电极和目标神经元的距离,进一步减弱刺激和记录的效果。虽然采用高分子材料和生物活性物质对电极表面进行修饰能提高电极与神经界面的生物相容性,降低炎症反应[9],但这种方法的长期稳定性仍有待考察,并且步骤繁琐,不易被神经科学研究者掌握。相比之下,采用步进式的电极阵列设计将会更加适用于多通道的神经电生理学研究[10]。
因此,本文介绍了一种简化的多脑区光调控和电生理记录的方法。我们开发了一种用于采集在体四脑区神经电生理信号的新型金属丝记录/刺激电极。简化了电化学修饰的工艺,实现了对电极表面进行快速修饰,并通过交流阻抗谱和循环伏安扫描检测,确认修饰后的电极具有更好的电化学性能。将这种进行修饰和检测的电极用于动物的在体电生理记录,同时在四个脑区采集到了局部场电位和峰电位信号,并对采集到的信号脑区之间的相关性进行分析和神经元放电分析。此外,我们还对记录后的动物大脑进行了免疫荧光染色,证实了多脑区电极记录位点的准确性。
2 实验部分
2.1 电极制备
首先定制规格为 7.0 mm ×8.5 mm 的印刷电路板(Printed Circuit Board,PCB)板,并根据特定脑区所在位点预留相应尺寸的圆孔。例如,本实验中 PCB 板上包含有 7 个圆孔,其中 3 个用于电极骨架的固定,4 个用于电极的引导和固定(图1(a))。通过对应尺寸的螺钉将 3 块 PCB板以图1(b)中平行的方式固定成一个电极骨架,其中螺钉位于 PCB 板顶角附近。随后,截取同等长度的聚酰胺硅管和光纤,并将硅管均匀排布在光纤周围。硅管个数与四电极或双电极数目相同。将排好的硅管插入相应位点的孔洞中,调整合适位置后将硅管快速固定在骨架上。另取两个 32 通道的排针,固定在电极骨架两侧。
在制作好的电极骨架上,借助显微镜将四电极或双电极以平行于硅管的角度穿入硅管中。其中四电极或双电极是通过将带有绝缘层的 Φ17 μm的 Ni/Cr 金属丝均匀缠绕成双电极或四电极制作而成。电极丝一端以不锈钢管为度量剪去多余长度,另一端按照通道顺序排列一一焊接到已固定好的排针引脚,将焊接完成的电极丝与电极排针一同封装。最终获得的电极如图1(c)所示。
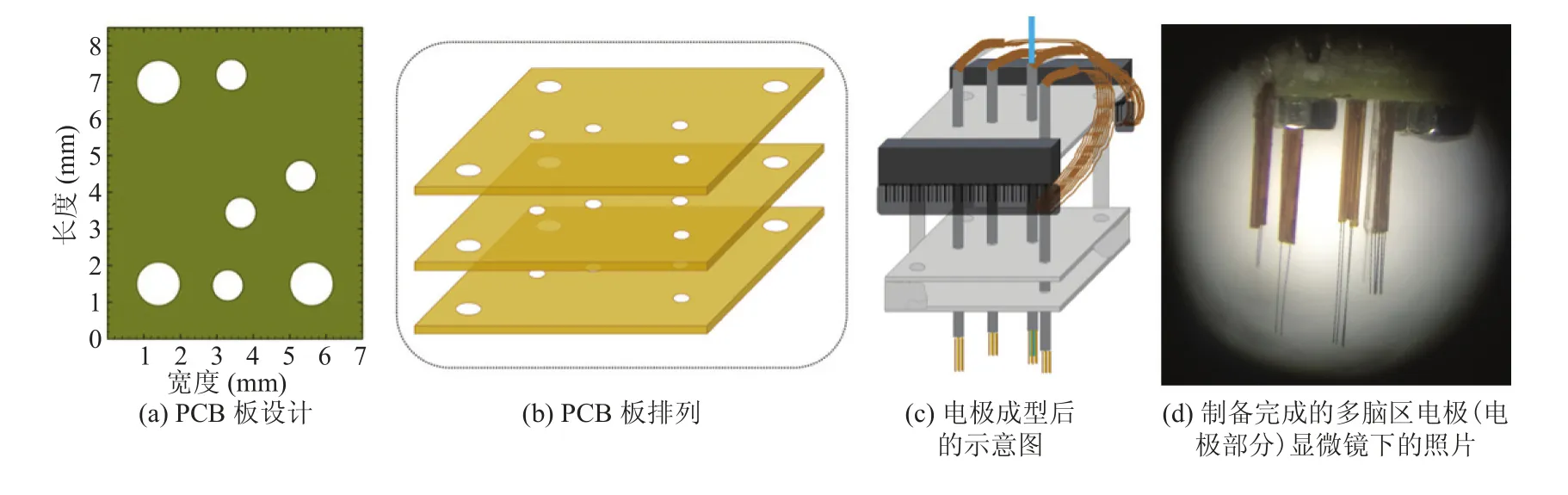
图1 电极制作过程部分示意图Fig. 1 The design and fabrication of multi-circuit optrode arrays
2.2 电化学修饰和检测
电化学修饰常用电镀铂黑的方法[11],本实验简化了该方法的工艺达到快速修饰电极的目的。其中电镀使用的铂酸溶液配制比为 2 mmol/L PtCl4:100 mmol/L HCl。
电化学修饰和电化学性能检测在 Gamry 电化学工作站上进行。电镀采用恒电位法-0.25 V(vs. SCE),电流达到 20~22 nA 为止,恒电位持续时间约 20 s。电化学性能检测采用交流阻抗谱和循环伏安曲线完成,交流阻抗谱的范围为1~105Hz,扰动点位为 10 mV,循环伏安曲线使用的电位范围为-0.6~+0.6 V (vs. SCE),扫描速率为 50 mV/s。
2.3 在体多脑区电生理记录和免疫染色
麻醉电生理实验的手术方法与已有文献中报道一致,区别在于需要同时在四个记录位点的颅骨上开骨窗。本次实验电生理记录的位点包括:海马(HPC)、伏隔核(NAc)、前额叶皮层(mPFC)和杏仁核(Amy)。实验中,当电极尖端接触到杏仁核位点上方的软脑膜时调整微推进器z 轴坐标为 0 点,并通过软件控制固定电极的微推进器操控电极步进下降,到达目标位置后开始电生理记录或光刺激。多通道电生理记录系统为96 通道的 Plexon 系统。
为确认电极在目标脑区的确切位置,我们采取心脏灌流的方法对完成实验的动物脑组织进行固定。动物脑组织经后固定、脱水后包埋切片,获取相应脑区的脑片并进行尼氏染色或 4', 6-二脒基-2-苯基吲哚染色,用 Leica 倒置荧光显微镜或共聚焦荧光显微镜拍摄电极痕迹和记录位置。
2.4 数据分析
本研究中电生理以 40 kHz 采样率记录采集脑区原始宽频信号,通过低通滤波获得局部场电位信号,高通滤波提取神经元峰电位信号。数据分析主要包括来自4个不同脑区的独立信号分析,以及脑区之间的相干性信息。本文将简单分析上述信息,具体如下:
(1)神经元峰电位的检测和聚类
由于单根电极会接收来自不同细胞的放电信号,因此需要根据波形将峰电位进行聚类,分离出单个细胞的峰电位放电序列。本次实验主要采用 Plexon 公司的 Offline Sorter 软件进行。首先将记录的 .plx 格式文件导入软件中,将电极类型改为四电极,选择记录数据的通道,用 Butterworth 滤波器进行高通滤波,截止频率为 300 Hz。本文使用的峰电位检测方法是进行阈值检测,选择信号标准差的-6 倍作为阈值线,超过该阈值线的作为峰电位。由于每个峰电位波形不一样,因此阈值线与原始信号相交点并不对应着峰电位不同的区间时刻,因此需要将峰电位的波峰进行对齐,之后进行降维聚类。本次实验中主要采用主成分分析法进行降维,利用模板匹配与 k 均值算法对峰电位进行聚类分析。选择的 3 个主成分可以根据4个通道的信噪比来选择信噪比较高的多个或一个通道的第一主成分、第二主成分、第三主成分等,确定每一团的中心之后利用模板匹配的方法进行聚类,根据波形去除检测出来的噪声,保留峰电位信号。所有通道分析完成之后,将数据存储为 .plx 或 .nex格式的文件便于用 Matlab 进行读入与分析处理。
(2)功率谱分析
为了研究随着时间变化或外界刺激下不同频段的功率变化情况,需要进行功率谱分析,该步骤可以用 Matlab 或 NeuroExplorer 软件进行处理分析。对于上述数字信号,选取 0~100 Hz 频段计算对应功率,并且选取固定时间窗,计算该时间窗之内信号的自相关并进行傅里叶变换,计算功率。颜色从蓝到红表示数值从小到大。随后,移动时间窗,计算了 120~210 s 的功率谱,其中 160~190 s为光遗传刺激的时间阶段。
(3)相干性分析
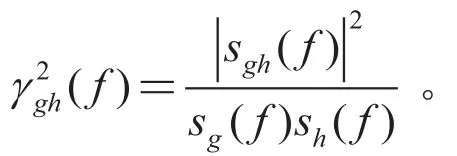
3 实验结果和讨论
3.1 电极及其电化学性能
本文基于可步进电极的电极支架,设计了一种由电极支架支撑并确定电极位置的多脑区记录/刺激电极,根据上文中实验部分电极制备的方法即可获得如图1(d)中所示的四脑区电极。该实例中的电极拟用于杏仁核、海马、皮层和伏隔核的同时记录,可得单个神经元放电以及局部场电位记录。此外,通过在电极上耦合上光纤,本实验还实现了单个或某两个脑区的同步光刺激。电极制备完成后,为确保每个通道能够记录到高信噪比的神经信号,我们对每个通道逐一检测电极性能,并对检测正常的电极进行电化学修饰。通道不正常的可能因素包括接触不良导致的断路、相邻通道之间短路、电极绝缘层破损等。电极由12~17 µm 的金属丝制成,在 1000 Hz 下的阻抗在 2 MΩ 左右,而多通道电生理记录仪在获得良好的记录信号信噪比情况下需要电极阻抗在 500 kΩ左右(小于 1 MΩ)。因此为记录到良好的电生理信号,获得理想的信噪比,需要对电极表面进行电化学修饰,改善电极阻值。本文采用恒电位法电镀铂黑的方法,电镀曲线如图2(a)所示,电镀15.5 s 后电流达到 21.54 nA。
为检测电化学修饰之后电极性能,我们采用循环伏安扫描和交流阻抗谱两种方法进行电化学检测,整个检测过程在人工脑脊液中以三电极体系连接进行。本实验使用的参比电极为饱和甘汞电极,对电极为铂丝电极。结果如图2(b)和图2(c) 所示。其中红色为电极制成后的检测结果,蓝色为电镀铂黑之后的检测结果。如图2 所示,电镀前电极的电容性差、阻抗高,电镀之后电极电容性有明显提高,且阻抗有明显降低,如在电生理测试相关的最受关注的 1000 Hz 下阻抗,从2.4 MΩ 下降到了 412 KΩ。电极修饰至该阻抗时通常能获得信噪比较好的信号。
3.2 电生理记录及其位置确认
我们将电镀并检测好的四脑区电极在 VGATChR2 转基因动物上进行电生理记录,同时采集局部场电位和神经元放电信号,并在特定脑区进行光刺激记录光刺激对各脑区神经元的影响。图3 所示为四脑区同步电生理记录及光刺激原始数据。其中图3(a)为神经元放电连续信号,为原始信号 300 Hz 高通滤波所得;(b)为局部场电位信号。黑色、蓝色、绿色和洋红色四个通道分别选自四个脑区,所有记录到的信号不止于这几个通道。光刺激第四个通道所在脑区,刺激参数为频率 60 Hz、光强 10 mW 的波长为 473 nm 蓝光,每次刺激持续 30 s。从图3(a)中可以看出,光刺激时胞体神经元被激活兴奋产生动作电位,而第二个和第三个通道所处脑区电活动显著性被抑制,第一个通道所处脑区活动被激活,更细致的信息可通过后续电生理信号分析获得。由图3(b)可看出,除了光刺激本地的局部场电位受到光刺激的影响,其他三个脑区都在光刺激期间以及光刺激结束后发生变化。

图2 电镀铂黑前(红)后(蓝)电极电化学性能对比Fig. 2 Electrochemical characteristics before (red) and after (blue) electrical deposition

图3 四脑区同步电生理记录及光刺激Fig. 3 Representative examples of electrophysiological recordings in4brain regions
为确认电生理信号记录的来源是否属于目标的核团,在记录后将动物进行灌注固定以及免疫染色,对电极、光纤的位置进行拍照确认,如图4 所示。
3.3 多脑区电生理数据分析
电生理信号是脑内神经元各类电活动变化的综合,包含信息通常较多且较为复杂,其中场电位信号反应局部电活动变化,一般需要通过数据处理进行进一步解析。本文同时记录了四个脑区的电生理信号,并加入光刺激事件,通过计算光刺激前后局部场电位的能量谱以及脑区之间场电位相干性分析,分别如图5 和图6 所示,解析光刺激对四个脑区电活动的影响。

图4 光电极(箭头所示)位置确认 (标尺=250 μm)Fig.4DAPI-labeled brain sections showing the locations of optrode tips (arrows)(bar=250 μm)

图5 光刺激杏仁核引发的局部场电位能量谱分析(蓝色标记为光刺激时间)Fig. 5 The time-frequencypower spectrum before and during light stimulation(The thick blue line denotes the 30 s stimulation period)
从图5 的局部场电位功率谱我们可以发现光刺激脑区 d,图5(a)中显示光刺激结束后在不同频段上能量均有明显的上升,图5(b-c)与(a)相似。图6 显示了多脑区之间的场电位相干性分析。黑色为正常 VGAT-ChR2 转基因动物上脑区间场电位相关性,图中虚线表示在 P 值为 99%时对应的置信水平;蓝色为光刺激激活杏仁核脑区中抑制性神经元时脑区间的场电位相干性。图6(b)中 20 Hz 左右频段处光刺激显著升高了NAc-BLA 两个脑区间的局部场电位相干性,而在该频段其他两个脑区之间的局部场电位相关性随光刺激影响不大。
4 结 论
目前光遗传技术研究工具的发展相对滞后,无法完全满足科研的需求。大脑特定功能的实现是不同脑区神经元协同作用的结果。在神经网络中多脑区神经活动的记录要求下,犹他电极[7]的使用受到了较大的限制,记录深部脑区或是同时记录几个脑区都很难用犹他电极来实现,而密歇根电极[8]则因其空间尺寸较纤细而在麻醉电生理和清醒固定的电生理记录中占有一定优势。目前报道的自由活动电极主要为单个脑区或双脑区同时记录[12],而多脑区同时记录的自由活动电极尚未报道过。本文解决了动物在体水平多个脑区的同步电生理记录与光神经调控技术的关键技术——多脑区光电极阵列。

图6 VGAT-ChR2 小鼠在光遗传刺激前(黑)后(蓝)的场电位相干分析Fig. 6 The LFP coherences of VGAT-ChR2 transgenic mice before (black) and during (blue) optogenetic stimulations
本文设计并制备了用于海马、杏仁核、伏隔核和前额叶等四个脑区光遗传刺激和电生理记录的多脑区多通道光电极阵列,并且简化了电化学修饰方法。此外,还通过循环伏安法和交流阻抗法对光电极阵列进行了检测,证实了这种光电极阵列具有较高的电容性和较低的电化学阻抗,可获得比较好的信噪比。随后,将该光电极阵列成功植入到小鼠的四个目标脑区进行电生理记录与光刺激,同时获得了自发和光刺激时的四个脑区的神经元放电和局部场电位信号,克服了动物在体水平多脑区同步电生理记录的障碍。另外,通过荧光染色方法确认的记录位点,对记录的电生理信号进行了分析,研究了光遗传刺激对脑区间同步化的影响。综上所述,本文发展的多脑区光电极阵列制备方法进一步完善了光遗传技术,非常适用于对神经精神疾病发病机制和治疗机理的研究,以及病理状态下神经环路的精确解析。
[1] Alivisatos AP,Chun M,Church GM,et al. The brain activity map [J]. Science,2013,339(6125):1284-1285.
[2] Underwood E. Brain project draws presidential interest, but mixed reactions [J]. Science,2013,339(6123):1022-1023.
[3] Schmidt EM. Computer separation of multiunit neuroelectric data: a review [J].Journal of Neuroscience Methods,1984,12(2): 95-111.
[4] Maynard EM,Nordhausen CT,Normann RA. The utah intracortical electrode array: a recording structure for potential brain-computer interfaces[J]. Electroencephalography and Clinical Neurophysiology, 1997,102(3):228-239.
[5] Vetter RJ,Olsson RH,Hetke JF,et al.Siliconsubstrate intracortical microelectrode arrays with integrated electronics for chronic cortical recording[C] // Proceedings of the 25th Annual International Conference of the IEEE Engineering in Medicine and Biology Society,2003,3: 17-21.
[6] Gray CM,Maldonado PE,Wilson M,et al. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multiunit recordings in cat striate cortex [J].Journal of Neuroscience Methods, 1995, 63(1-2): 43-54.
[7] McNaughton BL, O'Keefe J, Barnes CA. The stereotrode: a new technique for simultaneous isolation of several single units in the central nervous system from multiple unit records [J]. Journal of Neuroscience Methods,1983,8(4):391-397.
[8] Likhtik E, Stujenske JM,Topiwala MA,et al. Prefrontal entrainment of amygdala activity signals safety in learned fear and innate anxiety [J]. Nature Neuroscience,2014, 17(1):106-113.
[9] Lu Y,Li Y,Pan J,et al. Poly(3,4-ethylenedioxythiophene)/poly(styrenesulfonate)-poly(vinyl alcohol)/poly(acrylic acid) interpenetrating polymer networks for improving optrode-neural tissue interface in optogenetics [J]. Biomaterials,2012,33(2): 378-394.
[10] Lin L,Chen G,Xie K,et al. Large-scale neural ensemble recording in the brains of freely behaving mice [J]. Journal of Neuroscience Methods, 2006,155(1): 28-38.
[11] Rui Y, Liu J,Yang C. Implantable Pt-black coated microelectrode for electrical stimulation [J]. Nanotechnology and Precision Engine, 2012,10(2): 103-107.
[12] Anikeeva P,Andalman AS,Witten I,et al.Optetrode:a multichannel readout for optogenetic control in freely moving mice [J].Nature Neuroscience,2012,15(1):163-170.
Optrode Arrays for Multi-Circuit Dissection
LIU Yaohan1,2LI Juan1,2ZHONG Cheng1,2TANG Yongqiang1LU Yi1
1( Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China )
2( University of Chinese Academy of Sciences, Beijing 100049, China )
Optogenetics has been successfully applied to understand the mechanisms of neuropsychiatric diseases through the precise temporal control of specific neural circuitries. However, it remains a great challenge to integrate optogenetic modulation with electrophysiological recordings in multiple brain regions in vivo. In this study, a simplified method for the fabrication and electrochemical modification of the multicircuit optrode arrays was developed. The modified optrode arrays exhibited a significantly higher capacitance and lower electrochemical impedance at 1 kHz as compared to unmodified optrodes. The optrode arrays were chronically implanted into the brain of VGAT-ChR2 transgenic mice. Spontaneous action potentials and local field potentials as well as light-evoked responses were obtained in4different brain regions in vivo. The crossarea synchronizations were analyzed and the localizations of the implanted optrode arrays were confirmed by 4', 6-diamidino-2-phenylindole immunofluorescence staining. All these characteristics are greatly desired in optogenetic applications, and the fabrication method of the optrodes can be easily integrated with other in vivotechniques to build more advanced tools for the dissection of neural circuitry.
optogenetics; multiple brain regions; neural circuitry dissection; optrode array; surface modification
Q 189 Q 424
A
2015-04-03
2015-04-28
刘瑶函,硕士研究生,研究方向为神经生物学;李娟,硕士研究生,研究方向为神经信号处理;钟成,博士研究生,研究方向为神经电生理;唐永强,研究助理,研究方向为神经电生理;鲁艺(通讯作者),副研究员,研究方向为脑图谱解析技术,E-mail:luyi@siat.ac.cn。

