不同地区灰飞虱对吡虫啉的抗性
刘淑华,施必富,葛赏书,杨保军*,刘泽文
(1. 中国水稻研究所水稻生物学国家重点实验室, 杭州 310006;2. 南京市六合区冶山镇农业服务中心,南京 211524; 3. 南京农业大学植物保护学院,农业部华东作物有害生物综合治理重点实验室, 南京 210095)
不同地区灰飞虱对吡虫啉的抗性
刘淑华1,施必富2,葛赏书3,杨保军1*,刘泽文3
(1. 中国水稻研究所水稻生物学国家重点实验室, 杭州 310006;2. 南京市六合区冶山镇农业服务中心,南京 211524; 3. 南京农业大学植物保护学院,农业部华东作物有害生物综合治理重点实验室, 南京 210095)
为了明确全国不同稻区灰飞虱对吡虫啉的抗药性水平及其抗性机制,2012年采用点滴法测定了16个灰飞虱田间种群对吡虫啉的抗性倍数和3种增效剂在10个抗性种群中对吡虫啉的增效作用。结果表明,安徽安庆、合肥、江苏南京、盐城和无锡5个地区种群达到高抗水平(抗性倍数为74.1~91.2);浙江杭州、台州、湖州3个种群达到中等水平抗性(抗性倍数为35.8~47.7),福建福州和广东广州达到低水平抗性(抗性倍数为18.4~21.3),其他地区种群处于敏感性下降阶段。增效剂增效结果表明,氧化胡椒基丁醚(PBO)和磷酸三苯酯(TPP)在5个高抗种群和2个低抗种群中对吡虫啉均具有增效作用,表明P450单加氧酶和羧酸酯酶是抗性产生的主要代谢机制,而3个中抗种群中,仅PBO对吡虫啉表现出显著的增效作用,说明这3个种群仅有P450单加氧酶是其抗性上升的主要代谢机制。顺丁烯二酸二乙酯(DEM)在测定的10个种群中对吡虫啉均没有增效作用,说明谷胱甘肽S-转移酶没有参与其抗性上升。建议在中等水平至高水平抗性地区暂停使用吡虫啉防治灰飞虱。
灰飞虱; 吡虫啉抗性; 增效作用; 生化机制
灰飞虱[Laodelphaxstriatellus(Fallén)]属半翅目、飞虱科,主要分布于从菲律宾至西伯利亚一带的亚洲和欧洲温带地区[1],我国各水稻种植区均有发生。该虫除以成、若虫直接刺吸为害水稻、小麦等作物外,还传播水稻条纹叶枯病、水稻黑条矮缩病、小麦丛矮病和玉米粗缩病等病毒病,从而造成水稻、小麦和玉米产量损失,发生严重时导致颗粒无收[2-5]。在我国20世纪90年代之前灰飞虱尚属于次要害虫,一般不需要专门防治。然而自2000年以后,由于没有理想的抗病品种和防治病毒病的特效药剂,灰飞虱传毒引起的病毒病给我国长江中下游稻区水稻产量带来了严重损失。为了控制病毒病的传播,生产上通常采用“治虫防病”的策略来挽回产量损失,主要使用化学杀虫剂防治该虫。由于技术指导不到位,化学农药滥用,使灰飞虱对多种杀虫剂产生了抗性,有报道表明其对有机氯、有机磷及氨基甲酸酯类杀虫剂产生了不同程度的抗性[6-8]。Sone等[9]曾报道对残杀威高抗的室内灰飞虱品系对吡虫啉具有中等水平抗性。吡虫啉(imidacloprid)是一种氯化烟碱类杀虫剂,对飞虱、粉虱、蚜虫等害虫具有优异的防治效果,其不仅具有触杀活性,还有极好的内吸活性,20世纪90年代初期被引入我国,因具有高杀虫活性、持效期长及卓越的内吸活性等优点而迅速成为防治褐飞虱等刺吸式口器害虫的当家品种[10-11]。我国长江流域稻区水稻种植结构复杂多样,实行稻、麦轮作制度面积广,使得稻田褐飞虱、白背飞虱和灰飞虱3种稻飞虱经常混合发生。吡虫啉在各地很长时间被作为田间防治飞虱类害虫的首选或必选药剂,使田间稻飞虱长期处于高水平的吡虫啉选择压力之下,导致了2005-2006年田间褐飞虱对吡虫啉抗性水平剧增,发生数量急剧增加从而引起水稻大面积减产[12]。之后由于连续数年监测表明我国田间褐飞虱对吡虫啉的抗性达高水平以上,农业部发布通知要求暂停使用吡虫啉来防治褐飞虱[13]。尽管如此,由于吡虫啉对白背飞虱具有的良好效果使其仍被广泛使用。在防治白背飞虱的同时,田间混合发生的灰飞虱也处于吡虫啉的选择压力下。国外Endo等[14]较早报道了灰飞虱对吡虫啉的抗性监测结果,发现于1992-1994年采自日本的2个种群、越南的1个种群和中国的2个种群(浙江富阳和云南景洪)对吡虫啉尚敏感。我国科研人员于2006-2008年对江苏建湖、武进、无锡和浙江湖州的灰飞虱的抗性监测表明,其对吡虫啉已有高水平抗性[15-18],而其他地区灰飞虱对吡虫啉的抗性现状目前还不清楚。关于其抗性机制报道也较少,仅有报道与P450单加氧酶和酯酶活性以及乙酰胆碱酯酶靶标不敏感性有关[18-19]。因此,开展不同地区灰飞虱对吡虫啉的抗药性监测及其机制探索十分必要,为制定灰飞虱区域治理策略提供理论依据,并可以据此建立多点多样治理的全国性布局。本文采用点滴法,测定了国内11个省(直辖市)16个地区的水稻田灰飞虱种群对吡虫啉的抗药性水平,明确灰飞虱田间种群对吡虫啉的抗性现状。利用3种增效剂氧化胡椒基丁醚(PBO)、磷酸三苯酯(TPP)和顺丁烯二酸二乙酯(DEM)在吡虫啉对10个田间种群毒力测定中的增效作用,初步研究了不同地区灰飞虱种群的抗性生化机制的异同,为灰飞虱的综合治理提供依据。
1 材料与方法
1.1 供试虫源及饲养
敏感种群(Sus)来自江苏省农业科学院植物保护研究所,于2001年采集于江苏省农科院水稻试验田,不接触任何杀虫剂室内连续饲养130余代。田间种群于2012年5-6月采自国内11个省(直辖市)16个地区水稻田,每种群初始试虫为800~1 200头高龄若虫或成虫,各种群采集信息见表1。饲养方法参照王利华等[17],分别在‘武育粳3号’3~5叶秧龄稻苗上分批产卵2 d,然后在(25±1)℃、相对湿度70 %±10 %、光周期L∥D=14 h∥10 h的人工气候箱中饲养,用F1代羽化后2~3 d未交配的长翅雌成虫作为生物测定试虫。
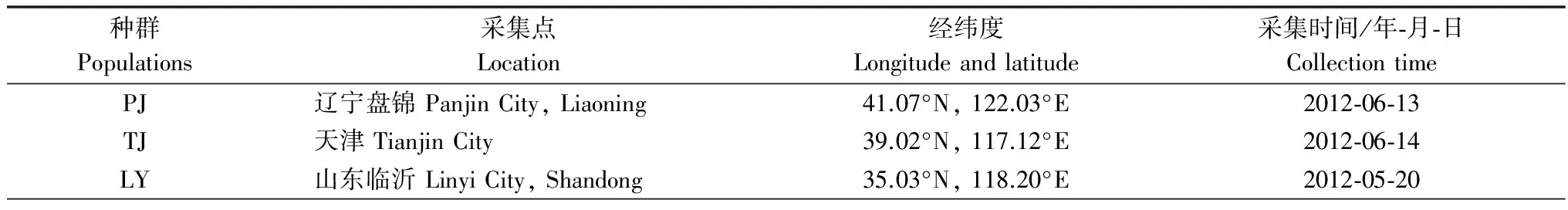
表1 灰飞虱的采集信息
续表1 Table 1(Continued)
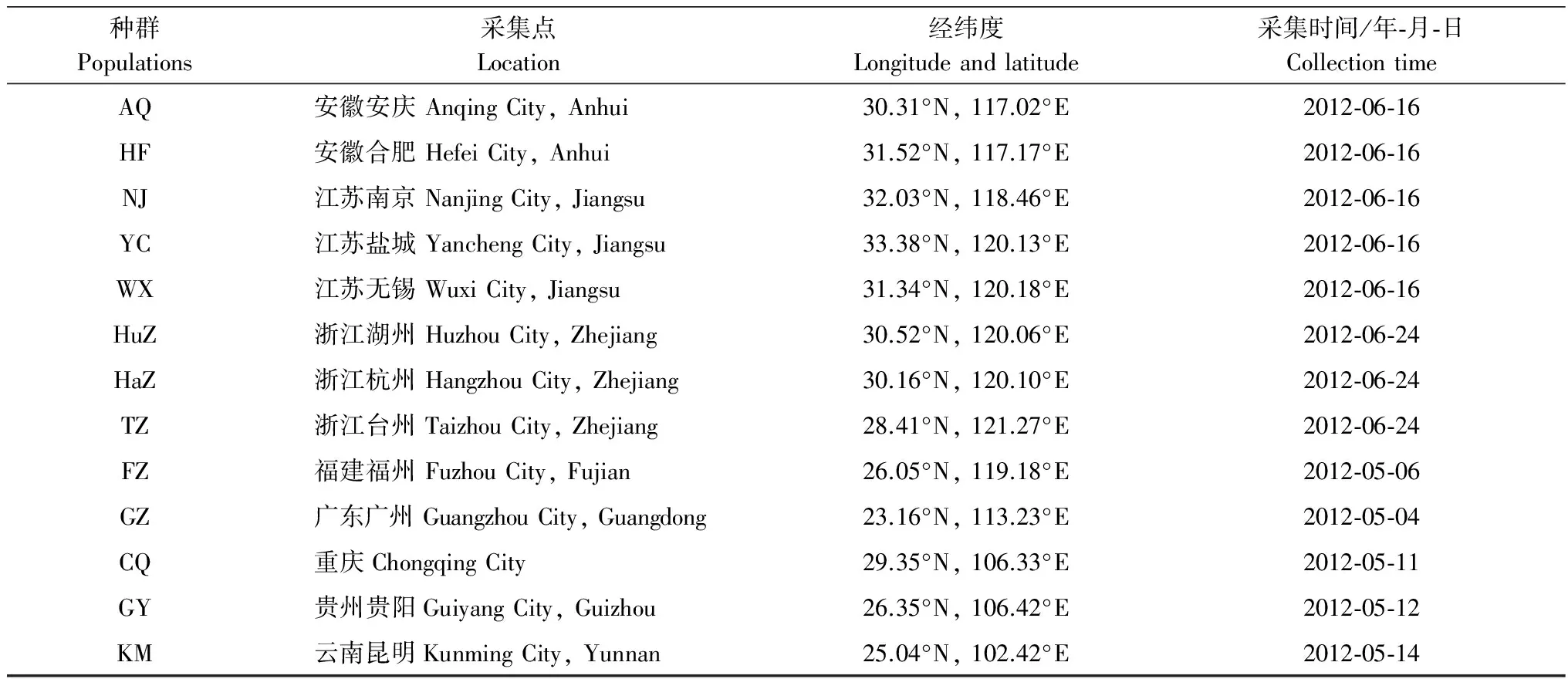
种群Populations采集点Location经纬度Longitudeandlatitude采集时间/年⁃月⁃日CollectiontimeAQ安徽安庆AnqingCity,Anhui30.31°N,117.02°E2012⁃06⁃16HF安徽合肥HefeiCity,Anhui31.52°N,117.17°E2012⁃06⁃16NJ江苏南京NanjingCity,Jiangsu32.03°N,118.46°E2012⁃06⁃16YC江苏盐城YanchengCity,Jiangsu33.38°N,120.13°E2012⁃06⁃16WX江苏无锡WuxiCity,Jiangsu31.34°N,120.18°E2012⁃06⁃16HuZ浙江湖州HuzhouCity,Zhejiang30.52°N,120.06°E2012⁃06⁃24HaZ浙江杭州HangzhouCity,Zhejiang30.16°N,120.10°E2012⁃06⁃24TZ浙江台州TaizhouCity,Zhejiang28.41°N,121.27°E2012⁃06⁃24FZ福建福州FuzhouCity,Fujian26.05°N,119.18°E2012⁃05⁃06GZ广东广州GuangzhouCity,Guangdong23.16°N,113.23°E2012⁃05⁃04CQ重庆ChongqingCity29.35°N,106.33°E2012⁃05⁃11GY贵州贵阳GuiyangCity,Guizhou26.35°N,106.42°E2012⁃05⁃12KM云南昆明KunmingCity,Yunnan25.04°N,102.42°E2012⁃05⁃14
1.2 供试药剂
95%吡虫啉原药,江苏克胜集团生产;氧化胡椒基丁醚(PBO),分析纯,Sigma公司产品;磷酸三苯酯(TPP),分析纯,北京生化制剂厂产品;顺丁烯二酸二乙酯(DEM),分析纯,上海生化制剂厂产品。
1.3 毒力及增效作用测定
生测方法采用Nagata[20]的微量点滴法并加以改进。将吡虫啉用丙酮稀释成5~6个系列浓度,试虫用CO2麻醉25~30 s,然后用自动微量点滴仪(Burkard Manufacturing Co. Ltd, Richmansworth,UK)将药液点滴在前胸背板上,点滴量为0.04 μL/头。每处理试虫数为15头,重复4次,用丙酮点滴作对照。处理后的试虫移入有‘武育粳3号’12~15 d秧龄稻苗4~5株并用人工基质固定的饲养杯中,然后置于饲养条件为温度(27±1)℃、光周期 L∥D=16 h∥8 h的人工气候箱饲养,24 h检查结果。以轻触虫体无明显反应者为死亡。3种增效剂PBO、TPP和DEM活体增效作用测定时,先按2 μL/头的剂量点滴1种增效剂,1 h后再点滴吡虫啉及溶剂丙酮,其他处理方法均与前述相同。
1.4 统计分析方法
采用DPS 14.1计算毒力回归方程、LD50及95%置信区间,以95%置信区间不重叠作为判断不同杀虫剂间毒力差异显著的标准。抗性倍数(resistance ratio, RR)=田间种群的LD50/敏感品系的LD50。抗性水平分级标准参考沈晋良等报道[21]定义为:RR<3时为敏感;3≤ RR<5时为敏感性下降;5≤ RR<10时为低水平抗性;10≤ RR<40时为中等水平抗性;40≤ RR<160时为高水平抗性;≥160倍时为极高水平抗性。计算增效比(synergism ratio, SR)来评价活体增效作用,SR=药剂单用时的LD50/用增效剂预处理后的LD50。
2 结果与分析
2.1 不同地区灰飞虱种群对吡虫啉的抗性比较
16个灰飞虱种群对吡虫啉的抗性监测结果表明(图1),各地区种群抗性倍数(RR)各不相同。其中一些相近地域种群RR呈现出相近趋势,如安徽和江苏2省的5个种群RR为74.1~91.2(达到高水平抗性);浙江杭州、台州和湖州3个种群RR分别为41.5、47.7和35.8(刚达到高水平抗性或接近高水平抗性);福建福州、广东广州和云南昆明3个种群RR为11.1~21.3(处于中等水平抗性)。其他如天津、山东临沂、重庆和贵州贵阳4个种群RR为7.1~8.9(低水平抗性),辽宁盘锦种群为RR为4.4(敏感性下降)。
为了开展不同抗性种群抗性机制的差异研究,将抗性水平达中等和高水平中的10个种群按RR值接近程度,人为进行分组(图1)。将抗性倍数为74.1~91.2的安徽安庆、合肥、江苏南京、盐城和无锡5个种群归于高抗种群,抗性倍数处于35.8~47.7的浙江杭州、台州和湖州3个种群归于中抗种群,抗性倍数为18.4~21.3的福建福州和广东广州种群归于低抗种群,分别进一步进行不同增效剂对吡虫啉的活体增效试验。
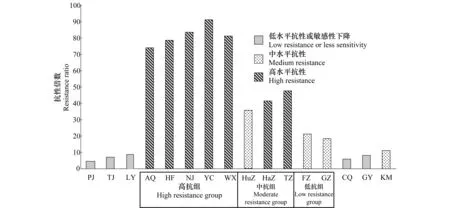
图1 16个灰飞虱田间种群对吡虫啉的抗性水平Fig.1 Resistance level to imidacloprid in sixteen populations of Laodelphax striatellus
2.2 3种增效剂在10个灰飞虱田间种群中对吡虫啉的增效作用
3种增效剂在灰飞虱敏感品系(Sus)中的增效作用均不明显(图2),SR为0.88~1.03(数据未在图中显示)。当用PBO预处理后,测定的3个种群组的灰飞虱(共10个种群)对吡虫啉均有增效作用,抗性倍数显著减小,SR为2.17~4.64,表明所测的10个种群抗性水平上升均与P450单加氧酶活性升高有关。用TPP预处理后,测定的3个种群组的灰飞虱只有高抗组和低抗组的灰飞虱(7个种群)对吡虫啉有明显的增效作用,抗性倍数显著减小,SR为1.48~2.03,表明这7个灰飞虱种群抗性上升与酯酶活性增强有关,而TPP在中抗组的3个种群(浙江湖州、杭州和台州)中对吡虫啉没有显示出增效作用,SR仅为0.99~1.05,表明这3个种群的羧酸酯酶没有促进其产生抗性。此外,DEM在所测定的10个种群中对吡虫啉均没有显示出增效作用,SR为0.95~1.05,说明在这10个灰飞虱种群中谷胱甘肽S-转移酶与其对吡虫啉的抗性产生无关。
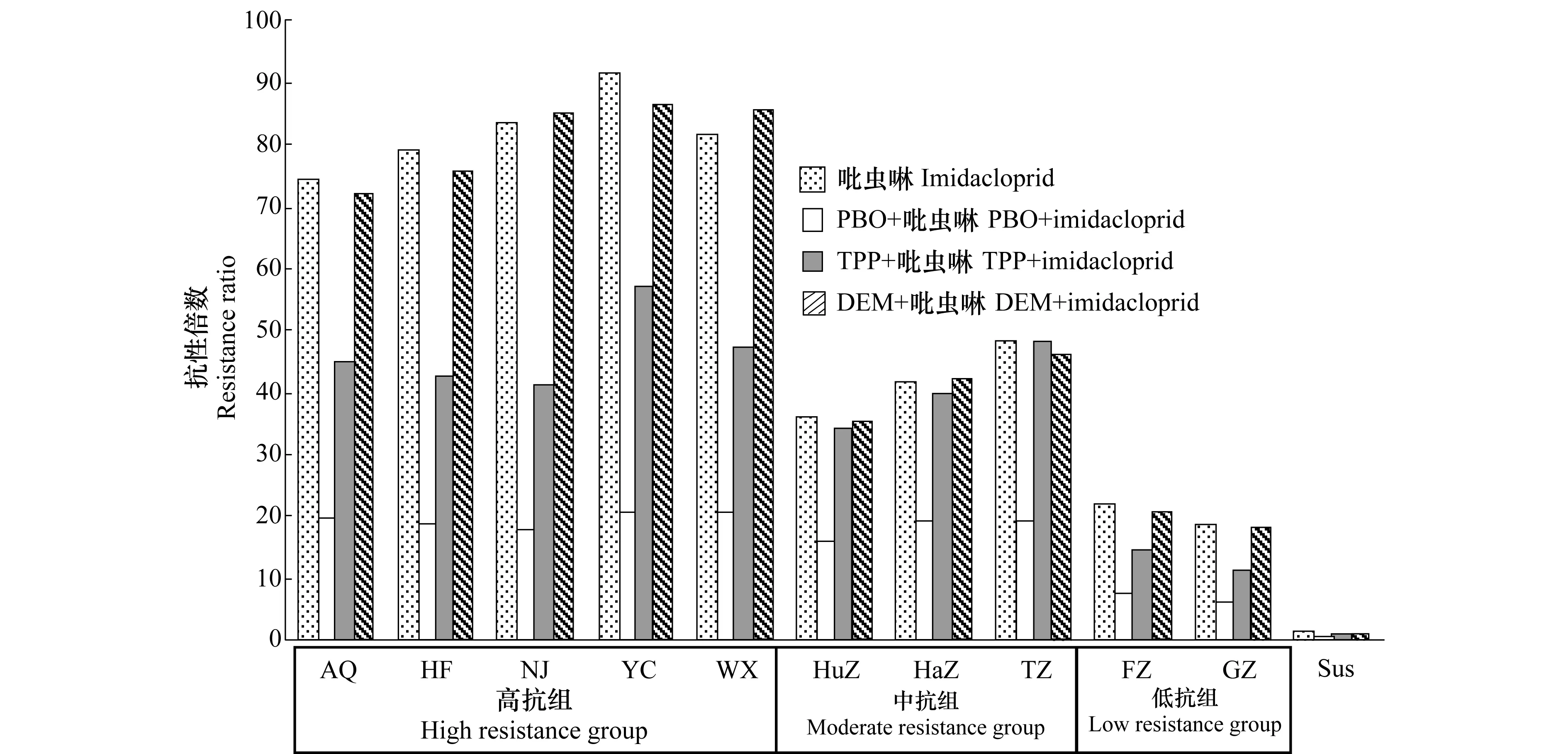
图2 PBO、TPP和DEM在10个抗性灰飞虱田间种群中对吡虫啉的增效作用Fig.2 Synergism of PBO, TPP, and DEM on imidacloprid in 10 resistant field populations of L.striatellus
3 讨论
害虫对杀虫剂的抗性现状调查是害虫综合防治中杀虫剂选用的重要依据。在我国尽管由于褐飞虱对吡虫啉产生严重抗性问题被暂停用于防治该虫,但其对白背飞虱具有良好防治效果,生产上仍然被作为备选药剂之一来防治白背飞虱,使得田间灰飞虱仍可能处于吡虫啉的选择压力下,存在抗性上升风险。最早对灰飞虱抗性监测报道是利用点滴法证实其对马拉硫磷产生了抗性[22]。国外20世纪90年代在吡虫啉获得应用之后不久Sone等[9]和Endo等[14]监测到日本、越南以及我国云南、浙江的5个灰飞虱种群对吡虫啉均尚处于敏感状态。我国早期对此方面报道较少,Gao等[18]采用点滴法检测到2006年江苏3个灰飞虱种群对吡虫啉的抗性倍数达68.1~108,福建福州和广东广州种群对吡虫啉抗性倍数达26.6~28.6,马崇勇等[15]采用点滴法也检测到2006年江苏无锡种群对吡虫啉抗性水平达79.6,浙江湖州种群对吡虫啉抗性倍数达44.6。本研究结果显示出2012年安徽、江苏5个灰飞虱种群对吡虫啉抗性水平均达高水平抗性,浙江3个灰飞虱种群对吡虫啉抗性水平已经接近或达到高水平抗性,而福建福州和广东广州抗性水平均达到中等水平,这些结果与Gao等[18]和马崇勇等[15]报道结果接近,显示出这些地区灰飞虱一直处于吡虫啉选择作用之下。Gao等报道2006年云南昆明灰飞虱对吡虫啉尚很敏感[18],本研究结果显示2012年云南昆明灰飞虱种群对吡虫啉抗性已达到低水平抗性,表明云南地区灰飞虱对吡虫啉抗性发展处于上升趋势,这与该地区吡虫啉的使用量或使用次数增加有关,也可能是由于其他农药与吡虫啉存在交互抗性,导致该地区灰飞虱对吡虫啉低水平抗性形成。王利华等[17]利用浸苗法检测到2007年江苏6个灰飞虱种群和安徽庐江灰飞虱种群对吡虫啉均处于敏感状态,这与本研究结果不同,可能与所采用生测方法、敏感品系、采集地域以及采集田块用药背景等因素不同有关。
阐明害虫抗性机制是生产上选择适合杀虫剂以及害虫抗性治理的基础,害虫抗药性的形成机制主要涉及代谢抗性增强和靶标敏感性下降两方面,其中代谢抗性主要是由于各种解毒酶活性增高所致。如羧酸酯酶活力的上升可促进灰飞虱对马拉硫磷[23]、毒死蜱[24]的抗性,P450单加氧酶的过量表达引起灰飞虱对噻嗪酮的抗性[25],多功能氧化酶和羧酸酯酶活力上升共同促进了田间灰飞虱对多种杀虫剂的抗性[18]。增效剂PBO、TPP和DEM可分别抑制昆虫体内P450单加氧酶、羧酸酯酶和谷胱甘肽S-转移酶等解毒酶的活性,从而对杀虫剂表现出增效作用,提高药剂的防治效果,克服和延缓害虫抗性发展,同时可根据不同增效剂产生的增效作用判断试虫代谢抗性的机制[26]。本研究利用这一方法的结果表明,所测的10个田间抗性种群对吡虫啉抗性与P450单加氧酶活性有关,而与谷胱甘肽S-转移酶无关,这与Gao等[18]的结果相似;高抗组的安徽和江苏省5个灰飞虱种群和低抗组的福建福州和广东广州种群抗性与羧酸酯酶有关,但中抗组的3个浙江种群与羧酸酯酶无关,表明不同地区灰飞虱种群之间抗性机制存在差异。然而这一差异究竟与特定生存环境下地理种群不同[27]还是与杀虫剂种类、用药次数和用药量不同而造成抗性水平差异有关尚不清楚,也可能是两者协同作用所致,这是因为稻飞虱所处田间环境的复杂性是多方面的,包括越冬后寄主转移,接受某一杀虫剂的生育期,特殊生境下受不同农药(杀虫剂、杀菌剂、除草剂[28]等)的轮流刺激以及迁飞习性造成的基因交流,这些因素都可能引起解毒酶表达响应。灰飞虱靶标不敏感是其产生抗药性的另外一个途径,如灰飞虱乙酰胆碱酯酶表达改变使其对有机磷杀虫剂和氨基甲酸酯类杀虫剂产生抗性[29],而不同灰飞虱对吡虫啉靶标不敏感性等机制差异以及抗性种群与其他杀虫剂交互抗性分析尚需进一步研究。
由于一些稻区近年来灰飞虱对吡虫啉的抗性并未下降,甚至还出现上升之势,应严格控制吡虫啉的使用时机和使用量,加强田间褐飞虱、白背飞虱和灰飞虱系统调查工作,根据田间飞虱种类、数量和防治目标,进行选择性防治,在白背飞虱与褐飞虱或灰飞虱混合发生时应暂时停用吡虫啉,搭配使用具有不同作用机制且与吡虫啉无交互抗性的新型药剂,可将噻虫嗪、噻嗪酮、烯啶虫胺、毒死蜱、吡蚜酮、异丙威以及敌敌畏等作为备选杀虫剂[15]。当前缺少有效防治由稻飞虱传毒引起的水稻病毒病药剂,可选的抗病毒水稻品种数量也有限,一些农业栽培措施值得推广,如适当推迟水稻播种期、苗床覆盖防虫网、翻耕麦田等,均可大大降低灰飞虱的虫口数量,减少田间用药次数,从而延缓抗性的产生和发展。田间灰飞虱种群暴发形成的机制十分复杂[30],相近地域种群对杀虫剂的抗性水平常呈现出相近趋势,与各地灰飞虱的寄主作物种植结构,以及施药方式、施药水平统一化关系密切,各地应当针对地域特点制定适宜的防治策略和方法。
[1] Kisimoto R. Flexible diapause response to photoperiod of a laboratory selected line in the small brown planthopper,LaodelphaxstriatellusFallén [J]. Applied Entomology and Zoology,1989,24:157-159.
[2] Vidano C. Phases ofMaizeroughdwarfvirusmultiplication in the vectorLaodelphaxstriatellusFallén [J]. Virology,1970,41(2):218-232.
[3] Wu A Z, Zao Y, Qu Z C, et al. Subcellular localization of the stripe disease-specific protein encoded byRicestripevirus(RSV) in its vector, the small brown planthopper,Laodelphaxstriatellus[J]. Chinese Science Bulletin,2001,46(21):1819-1822.
[4] 林凌伟,董国堃,汪恩国.水稻黑条矮缩病传毒昆虫的防治实践与研究[J].昆虫知识,2001,38(6):426-428.
[5] 谢联辉,魏太云,林含新,等.水稻条纹病毒的分子生物学[J].福建农业大学学报,2001,30(3):269-279.
[6] Nagata T, Ohira Y. Insecticide resistance of the small brown planthopper,LaodelphaxstriatellusFallén (Hemiptera: Delphacidae), collected in Kyushu and on the East China Sea [J]. Applied Entomology and Zoology, 1986, 21: 216-219.
[7] Kimura Y. Resistance to BHC in the smaller brown planthopper,LaodelphaxstriatellusFallén, in Hiroshima prefecture [J]. Chugoku Agricultural Research, 1973, 47: 123-124.
[8] Ozaki K, Kassai T. Patterns of insecticide resistance in field populations of the small brown planthopper,LaodelphaxstriatellusFallén [J]. Proceedings of the Association for Plant Protection of Shikoku, 1971, 6: 81-87.
[9] Sone S, Hattori Y, Tsuboi S, et al. Difference in susceptibility to imidacloprid of the populations of the small brown planthopper,LaodelphaxstriatellusFallén, from various localities in Japan [J]. Journal of Pesticide Science,1995,20:541-543.
[10]孙建中,方继朝,杜正文,等.吡虫啉——一种超高效多用途的内吸杀虫剂[J].植物保护,1995,21(2):44-45.
[11]章玉苹,黄炳球.吡虫啉的研究现状与进展[J].世界农药,2000,22(6):23-28.
[12]高希武,彭丽年,梁帝允.对2005年水稻褐飞虱大发生的思考[J].植物保护,2006,32(2):23-24.
[13]张帅,邵振润. 2012年全国农业有害生物抗药性监测结果及科学用药建议[J]. 中国植保导刊, 2013, 33(3):49-52.
[14]Endo S, Takahashi A, Tsurumachi M. Insecticide susceptibility of the small brown planthopper,LaodelphaxstriatellusFallén (Homoptera: Delphacidae), collected from East Asia [J]. Journal of Applied Entomology and Zoology,2002,37(1):79-84.
[15]马崇勇, 高聪芬, 韦华杰, 等. 灰飞虱对几类杀虫剂的抗性和敏感性[J]. 中国水稻科学, 2007, 21(5):555-558.
[16]张晓婕,陈建明,陈列忠,等.浙江省灰飞虱对吡虫啉、锐劲特和毒死蜱的抗药性监测[J].浙江农业学报,2007,19(6):435-438.
[17]王利华,方继朝,刘宝生.几类杀虫剂对灰飞虱的相对毒力及田间种群的抗药性现状[J].昆虫学报,2008,51(9):930-937.
[18]Gao Baoli, Wu Juan, Huang Shuijin, et al. Insecticide resistance in field populations ofLaodelphaxstriatellusFallén (Homoptera: Delphacidae) in China and its possible mechanisms [J]. International Journal of Pest Management, 2008, 54 (1): 13-19.
[19]Endo S, Tsurumachi M. Insecticide resistance and insensitive acetylcholinesterase in small brown planthopper,Laodelphaxstriatellus[J]. Journal of Pesticide Science,2000,25:395-397.
[20]Nagata T. Insecticide resistance and chemical control of the brown planthopper,Nilaparvatalugens(Stål) [J]. Bulletin of the Kyushu National Agricultural Experiment Station,1982,22:49-164.
[21]沈晋良,谭建国,肖斌,等.我国棉铃虫对拟除虫菊酯类农药的抗性监测及预报[J].昆虫知识,1991,28(6):337-341.
[22]Kimura Y. Resistance to malathion in the small brown planthopper,LaodelphaxstriatellusFallén [J]. Japanese Journal of Applied Entomology and Zoology, 1965, 9: 251-258.
[23]Sakata K, Miyata T J. Correlation of esterase isozymes to malathion resistance in the small brown planthopper (Homoptera: Delphacidae) [J]. Journal of Economic Entomology, 1994, 87(2): 326-333.
[24]Zhang Yueliang, Wang Lihua, Guo Huifang, et al. A transcriptome-based screen of carboxylesterase-like genes that are involved in chlorpyrifos resistance inLaodelphaxstriatellus(Fallén) [J]. Pesticide Biochemistry and Physiology, 2012, 104: 224-228.
[25]Zhang Yueliang, Guo Huifang, Yang Qiong, et al. Overexpression of a P450 gene (CYP6CW1) in buprofezin-resistantLaodelphaxstriatellus(Fallén) [J]. Pesticide Biochemistry and Physiology, 2012, 104: 277-282.
[26]彭梅,苏文伟,邓新平.3种增效剂对药剂的增效作用及酶的抑制作用[J].西南农业大学学报(自然科学版),2006,28(3):475-478.
[27]万由衷, 曲志才, 曹清玉, 等. 不同种群灰飞虱(Laodelphaxstriatellus)的RAPD分析[J]. 复旦学报(自然科学版), 2001, 40(5): 535-538.
[28]刘井兰,吴进才,袁树忠,等.经除草剂处理的水稻对褐飞虱体内几种酶及水稻受褐飞虱为害程度的影响[J].中国水稻科学,2001,15(4):303-308.
[29]Zhang Yueliang, Li Shuo, Xu Lu, et al. Overexpression of carboxylesterase-1 and mutation (F439H) of acetylcholinesterase-1 are associated with chlorpyrifos resistance inLaodelphaxstriatellus[J]. Pesticide Biochemistry and Physiology,2013,106:8-13.
[30]刘向东, 翟保平, 刘慈明. 灰飞虱种群暴发成灾原因剖析[J]. 昆虫知识, 2006, 43(2): 141-146.
Imidacloprid resistance in Laodelphax striatellus (Fallén)populations from different areas in China
Liu Shuhua1, Shi Bifu2, Ge Shangshu3, Yang Baojun1, Liu Zewen3
(1. State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006,China;2. Agricultural Service Center of Yeshan Town, Liuhe District, Nanjing 211524,China;3. College of Plant Protection, Key Laboratory of Integrated Pest Management of Crop in East China, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095,China)
The resistant level of imidacloprid in 16 field populations of the small brown planthopper (SBPH),Laodelphaxstriatellus(Fallén), collected from different areas in China, were determined in 2012 by topical application method. The synergistic effectsinvivowith piperonyl butoxide (PBO), triphenyl phosphate (TPP) and diethyl maleate (DEM) were also determined in ten field populations with relative high resistance. The results showed that five populations from Anhui (Anqing, Hefei) and Jiangsu (Nanjing, Yancheng, Wuxi) Provinces demonstrated high resistance to imidacloprid with resistance ratios (RR) of 74.1-91.2 fold, three populations from Zhejiang Province (Hanghzou, Taizhou and Huzhou) showed medium resistance with RR of 35.8-47.7 fold, Fuzhou population from Fujian Province and Guangzhou population from Guangdong Province showed low resistance with RR of 18.4-21.3 fold, populations from other areas did not show obvious resistance to imidacloprid. Synergistic effects tests showed that PBO and TPP had significant synergistism on imidacloprid in 5 populations with high resistance and 2 populations with low resistance, indicating that the cytochrome P450-monooxygenases and carboxylesterases might be the main biochemical factors for imidacloprid resistance in these populations. By contrast, only PBO showed significant synergistic effects on imidacloprid in 3 populations with medium resistance, indicating that only P450-monooxygenases were the main factor for imidacloprid resistance in these populations. We suggest that imidacloprid should not be used in those moderate and high level resistance areas.
Laodelphaxstriatellus; imidacloprid resistance; synergistic effects; biochemical mechanisms
2014-02-26
2014-06-05
公益性行业(农业)科研专项(201003031);“十二五”农村领域科技计划(2012BAD19B01,2012BAD19B0112)
Q 965.9,S 481.4
A
10.3969/j.issn.0529-1542.2015.02.035
* 通信作者 E-mail: yangbjy@126.com

