毒杀南方根结线虫的木霉种类鉴定及活性研究
焦 俊,韩冰洁,王媛媛,朱晓峰,段玉玺,陈立杰
(沈阳农业大学植物保护学院,北方线虫研究所,沈阳 110866)
毒杀南方根结线虫的木霉种类鉴定及活性研究
焦 俊,韩冰洁,王媛媛,朱晓峰,段玉玺,陈立杰*
(沈阳农业大学植物保护学院,北方线虫研究所,沈阳 110866)
木霉是国际上研究与应用非常普遍的生防真菌之一,具有重要的科研价值和广阔的应用前景。本研究采用形态学鉴定、ITS和β-tubulin序列分析法对4株具有杀线虫活性的木霉菌株进行种类鉴定,结果显示FT311和FT312为绿色木霉(Trichodermaviride),FT1937和FT85为哈茨木霉(T.harzianum)。利用贝氏皿浸没法测定,4株木霉发酵滤液均能显著降低南方根结线虫卵的孵化和2龄幼虫(J2)的活性,其中FT1937和FT85对卵孵化抑制率和J2致死率均达到85%~92%,而FT311能够达到80%~85%,但FT312毒性较低,仅达40%~60%;2株哈茨木霉的活性好于2株绿色木霉;同时观察到发酵液对线虫卵和幼虫体壁有消解作用、抑制和延迟卵孵化,并使幼虫体内空泡化。本研究为根结线虫病害的生防防治提供了更多的木霉资源信息。
木霉; 种类鉴定; 南方根结线虫; 杀线虫活性
根结线虫(Meloidogynespp.)是茄科、葫芦科和果树等多种植物的重要病原,能够危害植物的根部,造成根系发育受阻和腐烂,给农业生产造成巨大的经济损失[1]。近年来,随着设施蔬菜种植业的迅速发展,东北地区根结线虫病害愈来愈严重,尤其在辽宁省,由南方根结线虫(MeloidogyneincognitaChitwood)引致的各类蔬菜根结线虫病正严重威胁着老棚区设施蔬菜的生产[2]。由于蔬菜的周年性生产和持续性采摘,高毒高残留的化学杀线剂被限制使用,因此开发利用安全有效的杀线剂已经成为植物线虫病害防治工作中亟待解决的问题。
木霉(Trichodermaspp.)隶属于子囊菌门(Ascomycota)粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)肉座菌科(Hypocreaceae)真菌,是世界上研究最多的有效生防真菌之一。但木霉的研究多集中于防控植物真菌病害,如用多种木霉防治水稻纹枯病[3],利用木霉制剂防治西瓜枯萎病等[4],一些研究明确了木霉的作用机制包括快速生长的竞争机制、重寄生作用以及抑菌活性等[5]。近年来也有研究发现木霉对植物线虫有一定防控效果,如长枝木霉对根结线虫的寄生作用[6],哈茨木霉防控爪哇根结线虫[7]以及哈茨木霉发酵液对根结线虫的致死作用[8]等。本文针对实验室前期筛选获得的几株对植物线虫有活性的木霉菌株,利用形态学和DNA信息鉴定到种,并检测其对南方根结线虫的活性,以期为蔬菜根结线虫病防控提供新的生防真菌资源。
1 材料与方法
1.1 试验材料
供试线虫:南方根结线虫(Meloidogyneincognita)2龄幼虫J2。繁殖自北方线虫研究所的温室大棚,将接种南方根结线虫的番茄幼苗培养40 d,待根结上产生卵囊后,将番茄根系取出,用水轻轻冲洗,置于1%的次氯酸钠中消毒3 min,再用无菌水冲洗3 次,放入内有少量无菌水的培养皿,25 ℃恒温箱中培养,每隔24 h收集一次新孵化的2龄幼虫J2。
供试菌株:菌株FT311和FT312分离自广西玉林市八角根围土壤,FT85分离自吉林省抚松县人参根际土壤,FT1937来自于实验室前期保存的菌种。
将保存菌株从冷库中取出,在PDA平板上进行菌株活化,25 ℃培养后在4 ℃恒温箱中保存待用。将活化菌株接种于查氏培养基,于25 ℃150 r/min液体摇瓶发酵5 d。发酵液抽滤出菌丝,置于4 ℃恒温箱中保存备用。经测定4种木霉菌发酵液pH为6.3~6.8之间,均呈弱酸性。
1.2 试验方法
1.2.1 木霉的形态学鉴定
将菌株用接种针挑至PDA平板中央,25 ℃恒温箱中培养,每隔12 h观察菌落的颜色和形态。48 h后于显微镜下观察和测量菌丝、分生孢子梗及分生孢子的形态与大小。依据Rifai和Bissett的方法进行分类鉴定[9-10]。
1.2.2 木霉的分子生物学鉴定
利用天根新型基因组DNA提取试剂盒提取4种木霉菌株的基因组DNA,-20 ℃保存备用。采用真菌rDNA-ITS通用引物ITS1和ITS4[11]和β-tubulin基因种间引物Bt2a和Bt2b[12]对菌株基因组DNA进行PCR扩增,引物序列如下:
ITS1:5′-TCCGTAGGTGAACCTGCGG-3′
ITS4:5′-TCCTCCGCTTATTGATATGC-3′
Bt2a:5′-GGTAACCAAATCGGTGCTGCTTTC-3′
Bt2b:5′-ACCCTCAGTGTAGTGACCCTTGGC-3′
①rDNA-ITS PCR扩增的反应体系:10×反应缓冲液(10×PCR buffer)2.5 μL,MgCl2(25 mmol/L)2.0 μL,dNTP (2.5 mmol/L)1.5 μL,Taq(5 U/μL)0.2 μL,ITS1(10 μmol/L)2.0 μL,ITS4(10 μmol/L)2.0 μL,模板2.0 μL,ddH2O 12.8 μL,总体积25.0 μL。rDNA-ITS基因PCR扩增反应的条件为:94 ℃预变性5 min;94 ℃变性30 s,51 ℃退火40 s,72 ℃延伸90 s,30个循环;72 ℃延伸7 min,最后于4 ℃保存。
②β-tubulin基因PCR扩增的反应体系:10×反应缓冲液(10×PCR buffer)2.5 μL,MgCl2(25 mmol/L)2.0 μL,dNTP (2.5 mmol/L)2.0 μL,Taq(5 U/μL)0.25 μL,Bt2a/CladAct-F3 (10 μmol/L)1.0 μL,Bt2b/CladAct-R3 (10 μmol/L)1.0 μL,模板2.0 μL,ddH2O 14.25 μL,总体积25.0 μL。β-tubulin基因PCR扩增反应的条件为:94 ℃预变性3 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸1 min,39个循环;72 ℃延伸10 min,最后于4 ℃保存。
扩增产物经1%琼脂糖凝胶电泳检测,引物合成及PCR产物的纯化和序列测定委托上海生工生物工程技术服务有限公司完成。
ITS和β-tubulin序列结果利用MEGA软件进行序列分析和比较。利用美国国家生物工程信息中心(NCBI,http:∥www.ncbi.nlm.nih.gov/BLAST)的BLAST网络工具与GenBank数据库中相关真菌菌株的序列进行最高同源性比对,并分别对ITS和β-tubulin测序结果进行基因序列数据分析,从DNA水平确定木霉属的种类及遗传进化关系。
1.2.3 木霉对南方根结线虫卵囊中卵孵化的抑制作用
将消毒后的卵囊挤压破碎,得到未孵化的线虫卵。在每个贝氏小皿中放入100粒卵并分别加入4种木霉的发酵液各800 μL,3次重复,以无菌发酵培养液为对照。分别于24、48、72、96 h观察线虫卵的孵化情况,比较木霉发酵滤液对线虫卵孵化抑制率的差异。
相对抑制率公式如下:
相对抑制率(%)=

1.2.4 木霉菌株发酵液对南方根结线虫J2活性的测定
多媒体作为新兴的科技产物,对小学生具有一定的吸引力,从而提高小学生的学习质量,提升教师的教学效果。多媒体采用音频、视频和教学相结合的方式,增加了课堂学习的趣味性和新颖性,激发了学生学习和求知的欲望,引起了学生浓厚的学习兴趣,帮助学生更好地理解教学内容,推动了学生向更深层次的追求和发展,从而促进小学数学教学效果的提升。
取800 μL木霉发酵滤液加入内含约50条J2线虫的贝氏小皿中,置于25 ℃恒温箱中培养,3次重复,以无菌发酵培养液为对照,分别在12、24 h观察J2死亡情况,若线虫呈僵直状态,使用0.5%NaClO刺激后无再次活动现象,则判定其为死亡[8]。
线虫的校正死亡率公式如下:
校正死亡率(%)=

所获数据采用Excel2013和SPSS Statistics软件进行数据处理,Duncans新复极差法进行多重比较。
2 结果与分析
2.1 木霉的形态特征
FT85与FT1937菌株在PDA培养基上生长迅速,菌落呈圆形,轮环状排列,初在边缘产生白色菌丝,渐变为绿色,最后变为暗绿色。气生菌丝较繁茂,绒毡状,产孢量大,气味不明显。初生分支与主支常呈直角或略向上弯曲。瓶梗烧瓶形,形成3~4个瓶梗轮生体,偶对生;FT1937菌株与FT85相比,在平板上的颜色相对更深,呈现深绿色,分生孢子梗分支较多,产孢量大。鉴于分生孢子梗和菌落等典型形态特征,初步鉴定FT85与FT1937为哈茨木霉(TrichodermaharzianumRifai,1991)。
FT311与FT312菌株在PDA培养基上生长较快,菌丝初期为白色,后期转变为绿色,背面无色,气味不明显。菌丝无色透明,分生孢子梗由菌丝直立伸出,夹角近似直角,末端有小梗,分生孢子为圆形或椭圆形;FT312菌株与FT311相比,生长相对较缓,最后菌落上不形成致密菌丝层,后期绿色不明显,分生孢子量较少。鉴于分生孢子梗和菌落等典型形态特征,初步鉴定FT311与FT312为绿色木霉(TrichodermaviridePers,1794)。
由于木霉属真菌在形态上差别比较难于界定,尤其是分生孢子梗和分生孢子进行形态观察时差别较小,培养性状观察较为繁琐,产生的不确定性因素较多,因此借助分子生物学技术进行DNA指纹识别鉴定将更为快速与准确。
2.2 木霉的DNA鉴定结果
将4株木霉的DNA提取后,利用ITS和β-tubulin通用引物进行PCR扩增,分别获得580 bp左右和310 bp左右的片段(图1和图2),而后测序获得其相关基因序列。
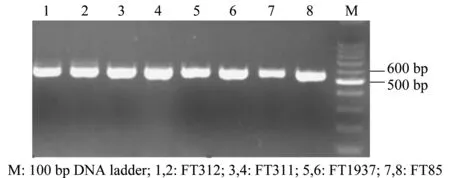
图1 ITS序列PCR扩增产物电泳图Fig.1 Electrophoresis of the PCR products of ITS
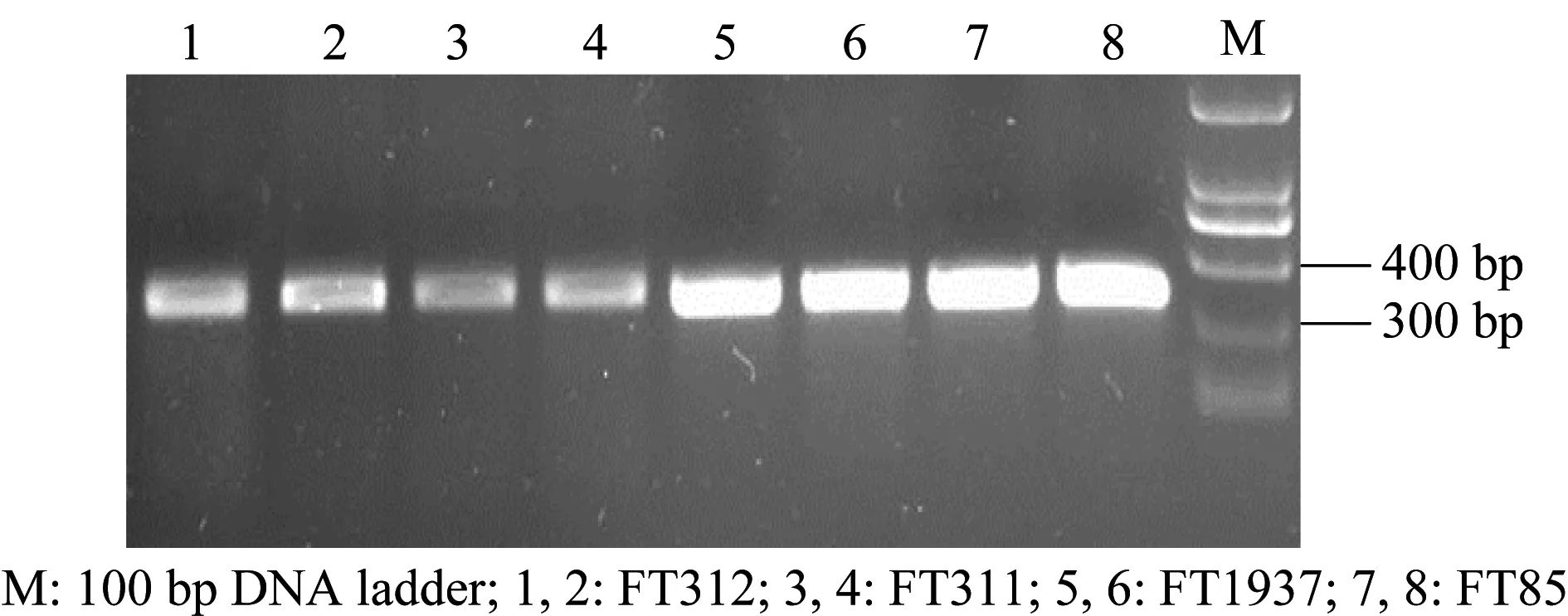
图2 β-tubulin序列PCR扩增产物电泳图Fig.2 Electrophoresis of the PCR products of β-tubulin
将得到的基因序列与GenBank数据库中的已知木霉属进行同源性搜索BLAST比对(表1),从DNA遗传信息方面进一步确定种类鉴定的准确性。
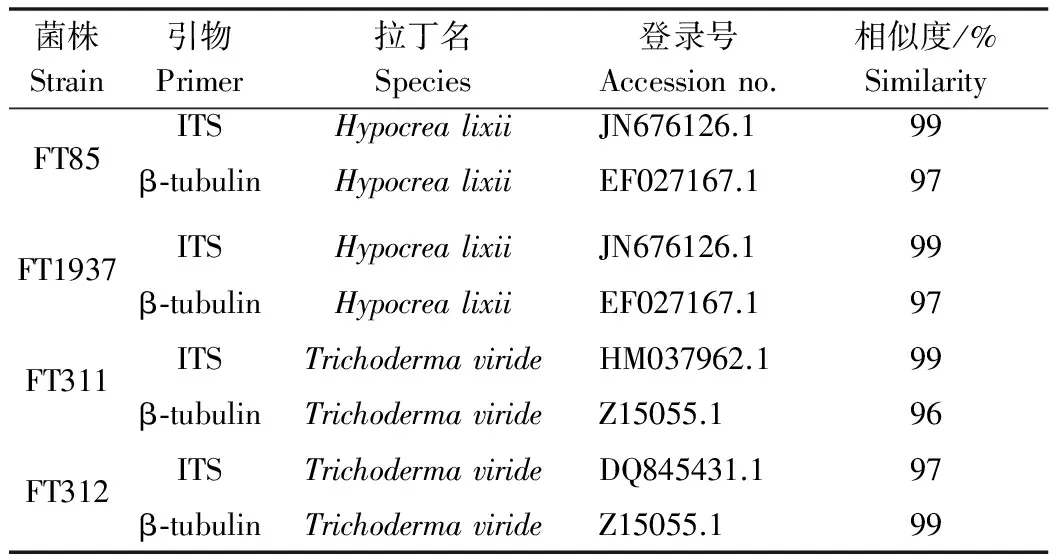
表1 木霉菌株的ITS和β-tubulin基因测序结果比对分析
FT85和FT1937菌株的ITS和β-tubulin基因测序结果显示与哈茨木霉的有性型Hypocrealixii相似度最高,系统进化树分析FT85和FT1937也被分为一组,结合其形态学鉴定,表型特征符合哈茨木霉的一般性状,最终鉴定两个菌株为哈茨木霉(Trichodermaharzianum)。
FT311和FT312菌株的ITS和β-tubulin基因测序结果显示与绿色木霉相似度最高,系统进化树分析FT311和FT312被分为一组,结合其形态学鉴定,表型特征符合绿色木霉的一般性状,最终鉴定两个菌株为绿色木霉(Trichodermaviride)。
根据4株木霉菌株的ITS和β-tubulin基因序列比对,利用MEGA软件进行序列分析,结果(图3)表明,FT85和FT1937菌株被分为一组,其中ITS序列与哈茨木霉(EF568084.1)同源性达到99%,但β-tubulin序列与哈茨木霉(EF027167.1)的同源性较低,仅为79%。菌株FT311和FT312被分为一组,其同源性很高,ITS序列与绿色木霉(DQ315457.1)同源性达到98%,β-tubulin序列与绿色木霉(Z15055.1)同源性达到100%。
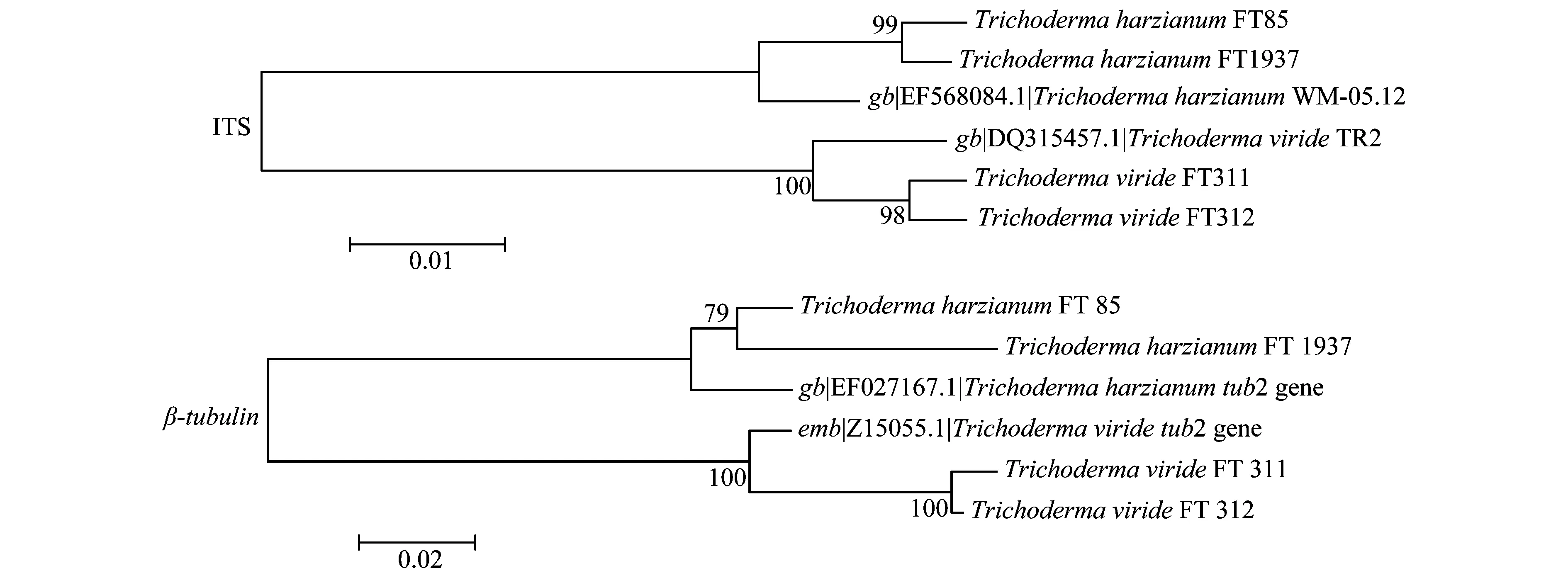
图3 4株木霉的基因序列遗传聚类分析Fig.3 Phylogenetic analysis of gene sequences of Trichoderma
2.3 木霉菌株发酵液对南方根结线虫卵孵化的影响
在木霉发酵滤液对南方根结线虫卵孵化抑制率的测定中,处理24 h时线虫的卵几乎没有孵化,从48 h开始到96 h的测试中,4株木霉均能显著降低南方根结线虫卵的孵化。其中菌株FT1937和FT85属于哈茨木霉,对卵孵化的抑制效果非常明显,48 h处理抑制率最高达92%,96 h处理抑制率降低,但也能达到80%以上。菌株FT311属于绿色木霉,也能稳定地将卵孵化抑制率维持在80%~85%水平,但绿色木霉FT312的抑制效果一般,仅能维持在55%~60%水平(图4)。此外,与对照相比,试验中观察到经木霉发酵液处理的线虫存在卵被消解、线虫卵孵化被延迟的现象,即使孵化出的幼虫也有部分呈僵直状死亡。
2.4 木霉菌株发酵液对南方根结线虫2龄幼虫的毒力测定
发酵液浸没南方根结线虫J2处理12 h,FT1937菌株对J2的毒杀作用表现突出,能达到40%的致死率;24 h后哈茨木霉FT85和FT1937菌株的致死效果相一致,达到90%左右,绿色木霉FT311菌株对J2的致死率也达到80%,这3株木霉菌株对J2都有较好的毒杀效果。但绿色木霉FT312菌株对J2致死效果不突出,24 h处理致死率仅达到30%,其对卵孵化的抑制效果也不明显,说明不是所有的木霉菌株都对线虫有很高的活性(图5)。观察到死亡线虫体内产生空泡,体壁变薄,有的虫体有消解现象,与正常线虫具有明显的差异。
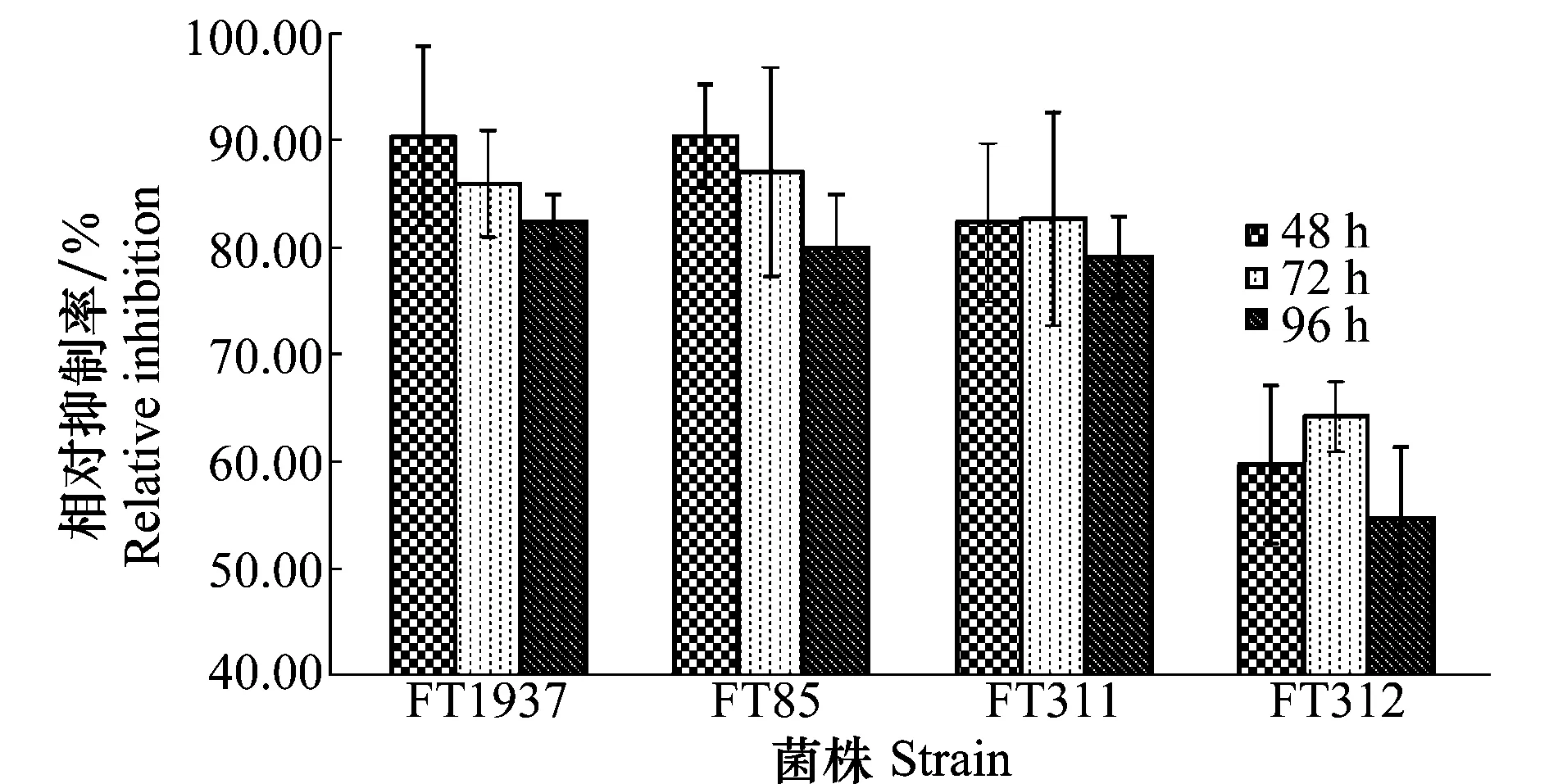
图4 木霉对南方根结线虫卵孵化的抑制作用Fig.4 Inhibition of Trichoderma against egg hatching of Meloidogyne incognita
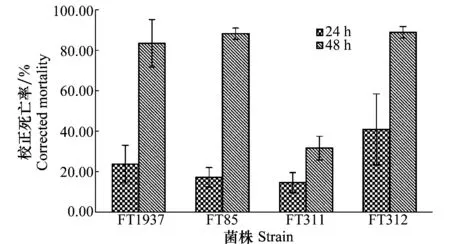
图5 木霉菌株发酵液对南方根结线虫J2的致死作用Fig.5 Effects of the fermentation broth of Trichoderma strains on J2 of Meloidogyne incognita
3 讨论
自木霉被发现对植物病原菌有抑制作用以来,一直作为一种重要的植物病害生物防治因子而备受关注,用其防治水稻、番茄、黄瓜等的真菌病害已获得显著成果。近年来,人们对木霉在植物线虫学领域的生防应用、生防机制等方面做了一些尝试和研究,已发现多种木霉如深绿木霉(T.atrovirideP.Karsten)、哈茨木霉(T.harzianum)、绒毛木霉(T.tomentosumBissett)、绿木霉(T.virensMiller,Giddens & Foster)和棘孢木霉(T.asperellumSamuels,Lieckfeldt & Nirenberg)等均对根结线虫具有一定的抑制作用[13-14],其中哈茨木霉和深绿木霉因其广谱而高效的杀菌和杀线虫活性而成为研究的热点[15-16]。
本文对前期获得的4株具有杀线虫活性的木霉进行形态学和基因序列鉴定,结果显示其中2株是哈茨木霉,另外2株是绿色木霉,而2株哈茨木霉的发酵液对南方根结线虫卵孵化抑制作用和对J2毒性要好于绿色木霉,其中绿色木霉FT312菌株对线虫的毒力作用较弱。说明木霉属中不是所有种类都对植物线虫有很强毒性,因此大量筛选获得能够稳定遗传的对线虫有作用的菌株很有必要。近几年关于木霉对植物线虫的作用研究进展比较迅速,已发现14种木霉对植物线虫具有防控效果[17]。
Szabó等[18]研究表明哈茨木霉的几丁质酶、丝氨酸蛋白酶和天冬氨酸蛋白酶等基因协同表达,在对线虫卵寄生过程中都起重要作用。笔者在试验过程中也观察到南方根结线虫的卵被消解和延迟孵化现象,部分幼虫即使孵化出来也僵直死亡;另外2龄幼虫被毒杀致死过程中,线虫体壁变薄、体内产生空泡,这些现象可能是木霉的次生代谢产物中某些胞外蛋白酶的作用。Szabó等[19]研究显示几丁质酶和蛋白酶对线虫的卵寄生过程中降解卵壳中几丁质等有重要作用。
目前木霉杀线虫的作用机理研究还较少,具体其发酵液中产生何种代谢产物起何种作用,都需要进行深入研究。随着基因组学和蛋白质组学在农业领域的应用,木霉对植物线虫病害的生物防治机理与应用研究将与日俱增。尤其木霉本身的竞争优势,加之对线虫的活性代谢产物研究深入开展,会强力推进木霉防控植物病害尤其是线虫病害的研究与开发,并将能够深入探讨木霉与线虫和植物的复杂互作机制。
[1] 段玉玺.植物线虫学[M].北京:科学出版社,2011:1-9.
[2] 赵磊,段玉玺,白春明,等.辽宁省根结线虫发生种类与分布[J].湖北农业科学,2010,49(4):865-868.
[3] Srivastava R K,Singh R K,Prasad R D.Relative antagonistic effect of different isolates ofTrichodermavirideandTrichodermaharzianumagainstRhizoctoniasolani[J].National Academy Science Letters,2012,35(1):49-52.
[4] 张丽荣,康萍芝,杜玉宁,等.木霉制剂对西瓜枯萎病的田间防治效果[J].北方园艺,2011(17):148-149.
[5] 孙虎,杨丽荣,全鑫,等.木霉生防机制及应用的研究进展[J].中国农学通报,2011,27(3):242-246.
[6] 张树武,徐秉良,薛应钰,等.长枝木霉对南方根结线虫致死和寄生作用的显微观察及测定[J].植物保护, 2013, 39(4): 46-51.
[7] Murslain M,Javed N,Khan S A,et al.Efficacy of moringa leaves andTrichodermaharzianumon the invasion and development ofMeloidogynejavanica[J].Pakistan Journal of Phytopathology,2013,25(1):59-64.
[8] 段玉玺,靳莹莹,王胜君,等.生防菌株Snef85的鉴定及其发酵液对不同种类线虫的毒力[J].植物保护学报,2008,35(2):132-136.
[9] Rifai M A.A revision of the genusTrichoderma[J].Mycological Papers,1969,116:1-56.
[10]Bissett J.A revision of the genusTrichoderma.III.SectionPachybasium[J]. Canadian Journal of Botany, 1991, 69: 2373-2417.
[11]White T J,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics [J].PCR protocols:a guide to methods and applications. New York: Academic Press,1990:315-322.
[12]Glass N L,Donaldson G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J].Applied and Environmental Microbiology,1995,61(4):1323-1330.
[13]Daragó A,Szabó M,Hrács K,et al.In vitro investigations on the biological control ofXiphinemaindexwithTrichodermaspecies [J].Helminthologia,2013,50(2):132-137.
[14]Affokpon A,Coyne D L,Htay C C,et al.Biocontrol potential of nativeTrichodermaisolates against root-knot nematodes in west African vegetable production systems [J].Soil Biology and Biochemistry,2011,43:600-608.
[15]Sharon E,Bar-Eyal M,Chet I,et al.Biological control of the root-knot NematodeMeloidogynejavanicabyTrichodermaharzianum[J].Phytopathology,2001,91(7):687-693.
[16]Spiegel Y,Chet I.Evaluation ofTrichodermaspp. as a biocontrol agent against soilborne fungi and plant-parasitic nematodes in Israel [J].Integrated Pest Management Reviews,1998,3(3):169-175.
[17]Sahebani N,Hadavi N.Biological control of the root-knot nematodeMeloidogynejavanicabyTrichodermaharzianum[J].Soil Biology and Biochemistry,2008,40:2016-2020.
[18]Szabó M,Urbán P,Virányi F,et al.Comparative gene expression profiles ofTrichodermaharzianumproteases during in vitro nematode egg-parasitism[J].Biological Control,2013,67(3):337-343.
[19]Szabó M,Csepregi K,Gálber M,et al.Control plant-parasitic nematodes withTrichodermaspecies and nematode-trapping fungi:The role of chi18-5 and chi18-12 genes in nematode egg-parasitism [J].Biological Control,2012,63:121-128.
Identification of Trichoderma and its toxicity to Meloidogyne incognita
Jiao Jun,Han Bingjie,Wang Yuanyuan,Zhu Xiaofeng,Duan Yuxi,Chen Lijie
(College of Plant Protection,Shenyang Agricultural University,Nematology Institute of Northern China, Shenyang 110866, China)
Trichodermais a famous biocontrol fungus in the world. Many species of the genus play an important role in controlling plant diseases, and have important scientific value and wide application prospects. In order to identifyTrichoderma, the morphology, ITS andβ-tubulinsequences were used to investigate the four strains, FT311, FT312, FT1937 and FT85, in this study. The four strains had been screened previously as biological nematicidal factors against plant nematodes in our laboratory. The results showed that FT311 and FT312 wereTrichodermaviride, and FT1937 and FT85 wereT.harzianum. The four strains could significantly inhibit the egg hatchability and were highly toxic to the secondary juveniles (J2) ofMeloidogyneincognitawith Bayesian dish immersion method. FT1937 and FT85 had high toxicity toM.incognitawith a J2corrected mortality of about 85%-92%, and FT311 had a J2corrected mortality of about 80%-85%, but FT312 had low toxicity, with a corrected mortality of about 40%-60%. Also, the cuticle of juveniles and shell of eggs were digested, eggs hatching delayed, and the intestinal cavity of larvae showed vacuolation. Furthermore, two strains ofT.harzianumwere better thanT.viridein their activity toM.incognita. The study provides more information for the control of the root knot nematode disease withTrichodermain our country.
Trichoderma; identification;Meloidogyneincognita; nematicidal activity
2014-03-05
2014-05-21
公益性行业(农业)科研专项(201103018);国家自然科学基金(31171823);沈阳农业大学天柱山学者资助计划
S 476
A
10.3969/j.issn.0529-1542.2015.02.011
* 通信作者 E-mail: chenlijie0210@163.com

