淡紫灰链霉菌除草活性物质对苘麻叶片生理生化的影响
魏松红,杨亚飞,李平生,蔺丽文,东 琴,纪明山
(沈阳农业大学植物保护学院, 沈阳 110866)
研究报告
Research Reports
淡紫灰链霉菌除草活性物质对苘麻叶片生理生化的影响
魏松红,杨亚飞,李平生,蔺丽文,东 琴,纪明山
(沈阳农业大学植物保护学院, 沈阳 110866)
以苘麻成株叶片为材料,采用植物抗性生理分析测定技术研究了淡紫灰链霉菌除草活性物质D -13组分对苘麻叶片细胞膜透性、叶片内MAD含量、SOD、CAT和APX酶活性变化的影响,以及对膜系统的影响。结果表明,苘麻叶片经D -13组分处理后,细胞膜透性随着D -13组分浓度的增加而增加,MDA含量在D -13组分处理后,随着D -13组分浓度的增加而升高。在电镜观察下,叶片细胞的膜系统随着D -13组分浓度的升高呈现出不同的受害情况。随着D -13组分处理时间的延长,SOD、CAT、APX活性均出现了不同程度的下降,与对照相比,SOD、CAT、APX在40 h时活性达到最低,分别比对照活性降低超过了60%、30%和50%。可见,淡紫灰链霉菌除草活性物质可严重降低苘麻叶片的生理生化活性。
除草活性物质; 膜透性; MDA; 酶活性; 超微结构
苘麻(AbutilontheophrastiMedicus),是锦葵科(Malvaceae)苘麻属(AbutilonMiller)一年生亚灌木状草本,主要危害玉米、棉花、豆类、蔬菜等作物,荒地、路旁亦有生长[1]。由于其具有广泛的适生性和较强的繁殖特性,已经成为普遍的危害物种。目前,化学除草剂在杂草防治中占有较大比重,但化学除草剂的大量使用也引发了一系列问题,诸如环境污染日趋严重、耐药和抗药杂草种群的上升、对非杂草生物的危害等。许多微生物寄主存在专一性,产生的毒素首先渗入宿主杂草,破坏其内部结构,进而使杂草产生病斑或枯萎,最终造成杂草的死亡。Kim等[2]报道不等弯孢霉产生的棘壳孢素pyrenocine A和pyrenocine B均可引起百慕大草坪的电解质渗漏和叶片尖端枯萎。从百日草链格孢(Alternariazinniae)内分离到的毒素zinniol,可抑制番茄、西瓜、柑橘和胡萝卜种子萌发,引起西瓜、西葫芦、燕麦等植物幼苗的萎蔫,可以干扰细胞的钙素调节过程而使细胞死亡[3]。据不完全统计,被研究的生防真菌多达150余种[4]。本试验筛选出对苘麻具除草活性的淡紫灰链霉菌(Streptomyceslavendulae)[5],其次级产物D -13组分可以使苘麻叶片萎蔫、干枯,研究D -13组分对苘麻叶片伤害的生理生化影响,能够为利用浅紫灰链霉菌的代谢产物作为控制苘麻的生物源除草剂开发提供依据。
1 材料与方法
1.1 材料
苘麻(AbutilontheophrastiMedicus)采自沈阳农业大学实验基地,对种子进行自然风干处理,装入牛皮纸袋中,放置于阴凉干燥处备用。
淡紫灰链霉菌株从土壤中分离筛选获得。将菌种活化,接种到改良的高氏一号培养基上,培养5 d。用正丁醇混合萃取、合并有机相。减压浓缩,获得粗提取物,提取物经一级、二级柱层析分离及生物测定得到活性组分D -13。
1.2 细胞膜透性的测定
选取生长一致的露白苘麻种子在温室内培育,至幼苗长出3~4对叶时,取幼苗倒数第3对叶片。用流水冲洗30 min,再用蒸馏水清洗3次,滤纸吸干水分。切成0.5 cm×0.5 cm方块,称取0.5 g,浸入盛有浓度50、100、500、1 000 μg/mL的D -13组分溶液的试管中,真空减压处理30 min,28 ℃光照下2 h,每个处理3次重复。取出叶片,用蒸馏水冲洗3次,用滤纸吸干叶片表面水分,置于盛有10 mL蒸馏水的20 mL试管中,用滤网使叶片完全浸入水中,于8、16、24、32和40 h后,在室温下用电导仪测定叶组织浸出液的电导率,将各处理材料煮沸15 min,冷却至室温后测定叶片组织细胞膜彻底破坏后的最大电导率值[6],计算D -13组分对叶片组织细胞膜的伤害率。伤害率用相对电导率来表示。
1.3 丙二醛(MDA)含量的测定
叶片处理同1.2,用蒸馏水冲洗3次,用滤纸吸干叶片表面的水分,加入5 mL磷酸缓冲液(pH7.8,内含1% PVP),冰浴研磨成匀浆,于2 500 r/min离心10 min,取上清液2 mL与2 mL硫代巴比妥酸溶液(内含20%三氯乙酸,0.5%硫代巴比妥酸)混合,100 ℃水浴30 min,冷却后于2 500 r/min离心10 min,取上清液分别在450、532和600 nm处测消光度值A450、A532和A600,按公式Y532=-0.001 98+0.088A450,MDA的消光度值D=A532-A600-Y532,求出样品的MDA含量[6]。
1.4 细胞叶绿体超微结构的观察
幼苗长出3~4对叶时,取幼苗倒数第3对叶片叶脉附近叶肉组织,切成1 mm×3 mm长条。2.5%戊二醛固定2 h,蒸馏水清洗3次,1%锇酸固定2 h,PBS(二钾砷酸钠缓冲液配制)清洗2 h。50%、70%乙醇脱水各0.5 h,80%、90%的丙酮脱水各0.5 h,100%的丙酮脱水3次各10 min。Epon-812#环氧树脂渗透过夜,Epon-812#环氧树脂包埋。在35、45、60 ℃条件下依次聚合24 h,LKB-5超薄切片仪切片。醋酸双氧铀,醋酸铀与柠檬酸铅双重染色[7]。H-7650型透射电镜观察。
1.5 酶活性的测定
超氧化物歧化酶(superoxide dismutase,SOD)活性测定[6]:取长势均匀,生长至3~4对叶的苘麻叶片0.5 g于预冷的研钵中,加1 mL预冷的磷酸缓冲液在冰浴上研磨成匀浆,加缓冲液使终体积为5 mL。在4 ℃条件下10 000 r/min离心20 min,上清液即为SOD粗提液。取2.65 mL SOD反应液(1.5 mL 0.05 mol/L 磷酸缓冲液pH 7.8、0.3 mL 130 mmol/L甲硫氨酸溶液、0.3 mL 750 μmol/L氮蓝四唑溶液、0.3 mL 100 μmol/L EDTA-Na2溶液、0.25 mL蒸馏水)于10 mL试管中,加入50 μL酶提取液,再加入300 μL核黄素溶液,混匀(以pH7.8磷酸缓冲液代替酶液做对照)。在4 000 lx日光下反应20 min,黑暗终止反应,于560 nm下测吸光值。SOD活性以1 g鲜重样品1 min抑制氮蓝四唑光化还原的50%(即酶单位)来表示。
过氧化氢酶(catalase,CAT)酶活性测定[8]:取各处理的苘麻叶片0.5 g置研钵中,加2~3 mL 4 ℃下预冷的pH=7.8的磷酸盐缓冲液和少量石英砂研磨成匀浆后,转入25 mL容量瓶中,并用缓冲液冲洗研钵数次,合并缓冲洗液,并定容到刻度。混合均匀,将容量瓶置5 ℃静置10 min,取上部澄清液在4 000 r/min下离心15 min,上清液即为过氧化氢酶粗提液,5 ℃下保存备用。取2.5 mL酶液于50 mL三角瓶中(对照加煮死酶液2.5 mL),再加入2.5 mL 0.1 mol/L H2O2,同时计时,于30 ℃恒温水浴中保温10 min,立即加入10% H2SO42.5 mL用0.1 mol/L KMnO4标准溶液滴定,至出现粉红色(在30 min内不消失)为终点。CAT酶活性用1 g鲜重样品1 min内分解H2O2的毫克数表示。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性的测定:将各处理的苘麻叶片0.5 g加入提取液,研磨匀浆,15 000 r/min离心15 min,上清液定容至5 mL,取部分上清液经适当稀释后用于酶活测定。在3 mL的反应体系中,加入50 mmol/L pH=7.0 PBS 1.8 mL,15 mmol/L AsA 0.1 mL,酶液0.1 mL,0.3 mmol/L H2O21 mL(以不加酶液为对照),记录A290变化。以1 min内A290变0.01定义为1个酶活性单位(U)。
2 结果与分析
2.1 D -13组分对苘麻叶片细胞膜透性的影响
D -13组分对苘麻叶片细胞膜透性的影响见图1。浸出液的相对电导率随D -13组分浓度和处理时间的变化而增强。D -13组分溶液浓度在50~100 μg/mL的范围内时,随着时间的延长涨幅较小,曲线较为平缓。当D -13组分浓度超过100 μg/mL,相对电导率显著增加时间出现在24 h左右。当D -13组分浓度达到500 μg/mL时,细胞液渗出率比对照增加35%。结果表明D -13组分对苘麻叶片细胞膜透性有影响,能够明显地引起叶片组织电解质的外渗。
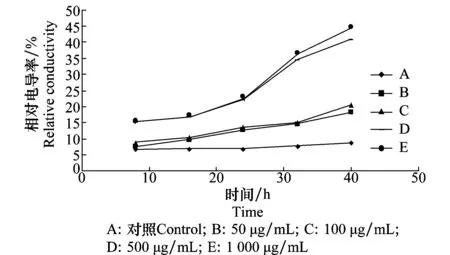
图1 D -13组分对苘麻叶片细胞膜透性的影响Fig.1 Influences of D -13 on the permeability of cell membrane of A. theophrasti leaves
2.2 D -13组分对细胞内丙二醛(MDA)含量的影响
用D -13组分处理苘麻叶片后,细胞内MDA的含量见图2,结果表明D -13组分处理能增加叶片组织MDA的含量,当D -13组分浓度在100 μg/mL以下时,MDA的含量上升不明显,而D -13组分浓度在100 μg/mL以上时,MDA的含量随D -13组分浓度的增加而上升,当D -13组分浓度达到1000 μg/mL时MDA的含量比对照增加237%。试验结果表明D -13组分能引起苘麻叶片细胞组织内膜脂过氧化作用,导致MDA的大量渗漏。
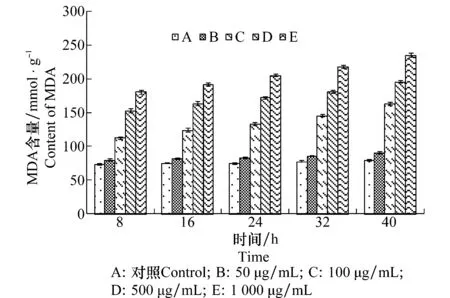
图2 D -13组分对苘麻叶片细胞内MDA含量的影响Fig.2 Influences of D -13 on MDA content of A. theophrasti leaves
2.3 D -13组分对苘麻叶片细胞叶绿体超微结构的影响
未经D -13组分处理的苘麻叶片细胞叶绿体分布均匀(图3a),排列整齐,多成不规则椭圆形,基质分布均匀,膜结构清晰,基粒类囊体排列整齐紧密。经100 μg/mL D -13组分处理后,叶片的超微结构发生变化(图3b),壁间偶有不明物质,叶绿体发生扭曲变形,基粒片层排列正常。经500 μg/mL D -13组分处理后(图3c),可见细胞质壁分离严重,叶绿体膜变形受损变得模糊不清,偶有空泡化,大部分叶绿体的基质片层排列紊乱,且嗜锇颗粒增多。经1 000 μg/mL D -13组分处理后(图3d),叶绿体空泡化加剧,叶绿体膨胀较严重,基粒片层排列不规则且肿胀分解,嗜锇颗粒进一步增多。未经D -13组分处理的苘麻叶片细胞线粒体、质膜结构正常(图3e),线粒体基质、脊清晰可见,质膜双层结构清晰。经500 μg/mL D -13组分处理后(图3f~g)线粒体变形、脊数量减少,质膜出现局部破裂,内含物外流。

图3 D -13组分对苘麻叶片细胞超微结构的影响Fig.3 Influences of D -13 on cell ultrastructure of A. theophrasti leaves
2.4 D -13组分对苘麻叶片酶活性的影响
D -13组分对苘麻叶片中SOD、CAT和APX酶活性的影响分别见图4~6,结果表明浓度在500 μg/mL时,苘麻叶片中CAT、APX和SOD 3种抗氧化酶活性的变化大小和变化趋势各不相同。作为植物抗氧化系统第一道防线的SOD,处理16 h时对其活性没有明显的影响,活性仅略有降低。随着处理时间的延长,SOD活性迅速下降,40 h时降低超过60%。CAT活性在D -13组分处理的过程中其检测值缓慢降低,前期CAT活性没有太大波动,但在24 h时CAT活性大为降低,比对照降低32%。APX活性在处理16 h后略有升高,随着处理时间的延长,APX的活性大幅下降,处理时间为40 h时活性大幅度降低,比对照降低51%。
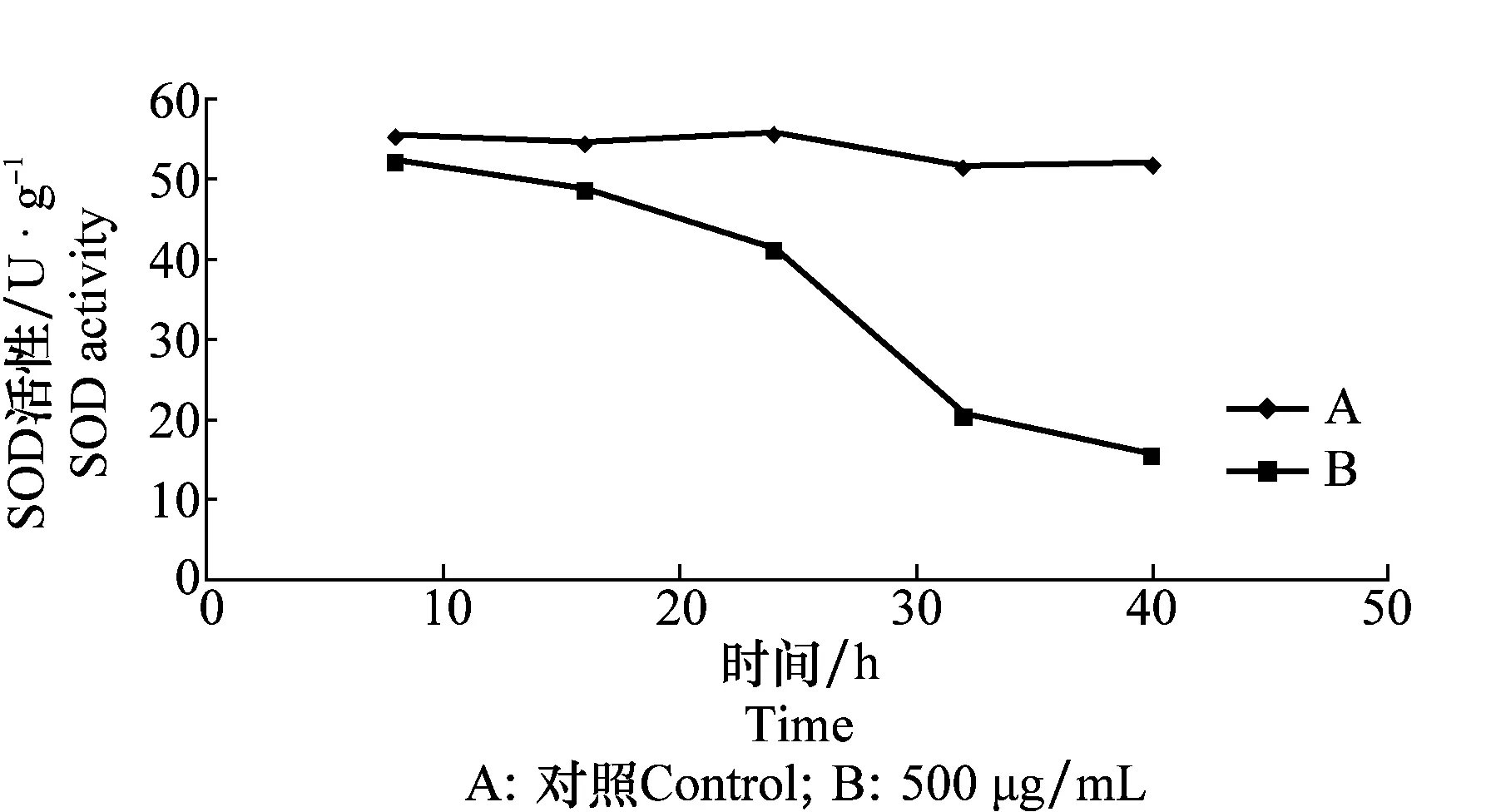
图4 D -13组分对苘麻叶片超氧化物歧化酶活性的影响Fig.4 Influences of D -13 on SOD activity of A. theophrasti leaves
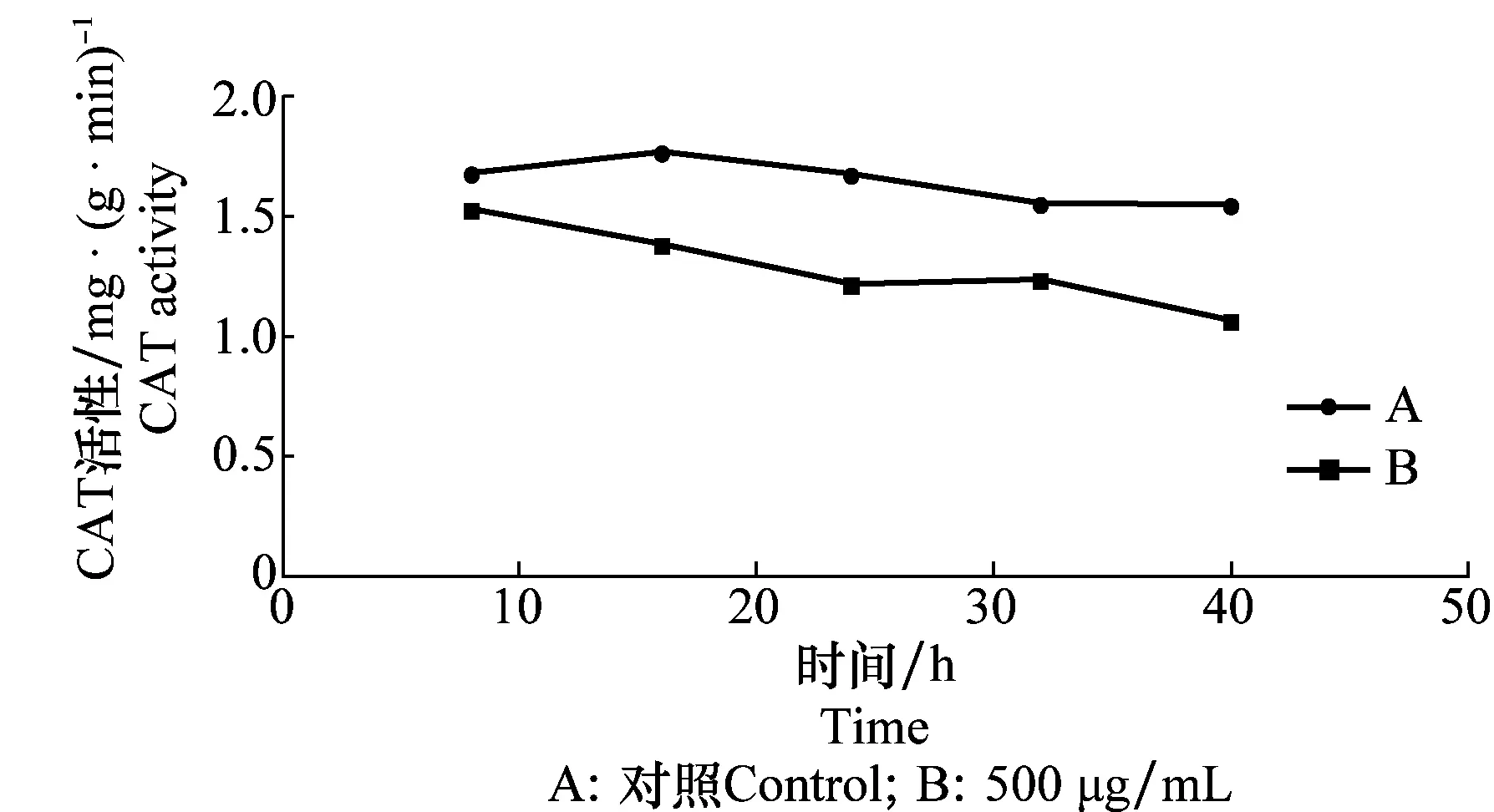
图5 D -13组分对苘麻叶片过氧化氢酶活性的影响Fig.5 Influences of D -13 on CAT activity of A. theophrasti leaves
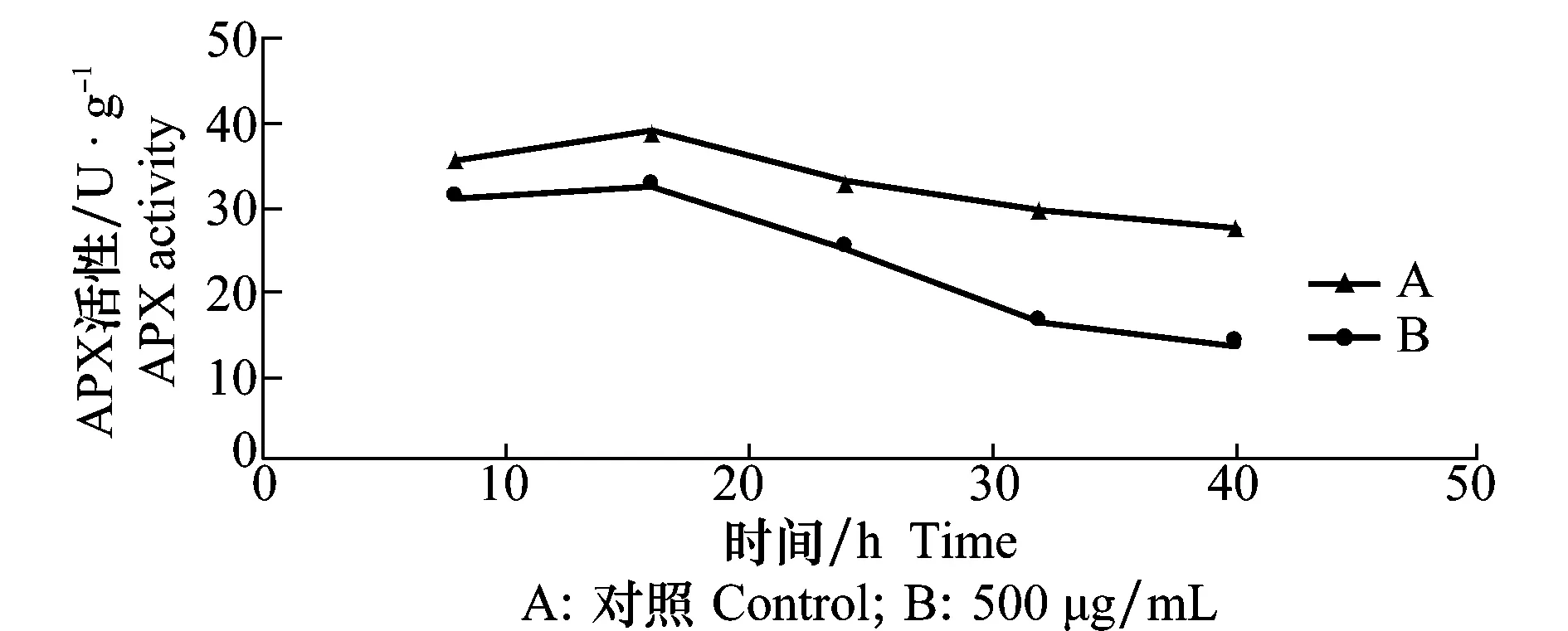
图6 D -13组分对苘麻叶片抗坏血酸过氧化物酶活性的影响Fig.6 Influences of D -13 on APX activity of A.theophrasti leaves
3 结论与讨论
活性物质主要的作用方式有:破坏寄主细胞膜的结构、影响寄主体内正常的生理代谢等[9]。淡紫灰链霉菌D -13组分是病原生物代谢过程中产生的,在生理浓度范围内干扰植物正常生理功能的化合物,可以引起苘麻叶片萎蔫、坏死。
细胞超微结构改变是植物一系列生理活动异常的细胞学基础,研究植物受D -13组分毒害后细胞超微结构的变化,可以从细胞水平上揭示D -13组分毒害植物的机理[11],张云霞等[12]报道,用莲子草假隔链格孢毒素处理空心莲子草叶片后,叶肉细胞超微结构发生改变,具体表现为叶绿体、质膜、线粒体等细胞器结构受到伤害。用D -13组分处理苘麻叶片后叶肉细胞超微结构发生改变,表现为叶绿体、线粒体、质膜等细胞器结构受到伤害。这些结果表明D -13组分对苘麻叶片细胞膜结构具有破坏作用。
SOD是植物体内第一道防线[13],试验中SOD活性在低D -13组分浓度处理下只稍有波动,但随着D -13组分浓度增大,SOD活性明显受到抑制。CAT是清除高等植物叶绿体内H2O2的重要防御酶[14],但在应对D -13组分处理中酶活性持续下降,这可能是D -13组分作用于叶绿体时产生过多的活性氧,活性氧破坏了膜系统,进而抑制了CAT的活性。APX酶在处理初期虽有短暂上升,但随着时间延长酶活性也大幅降低。这一结果与姜述君等[15](用狭卵链格孢菌毒素细交链孢菌酮酸处理稗草)及李荣金和强胜[10](用百日草链格孢菌毒素处理加拿大一枝黄花叶片)所做研究叶片细胞生理生化特性的变化趋势相似。
综上所述,D -13组分对苘麻叶片细胞膜系统和抗氧化酶系统伤害的顺序为:D -13组分处理下,苘麻叶片细胞内产生的活性氧远大于抗氧化酶系统的清除能力,活性氧积累,进而破坏膜系统,膜透性增大,胞质外渗(表现为受害叶片呈水浸状),胞内正常的生理代谢被打乱,最终导致细胞受到不可逆伤害,所以D -13组分对苘麻伤害的实质是对苘麻膜系统的破坏。
[1] 李扬汉.中国杂草志[M].北京:中国农业出版社,1998:694-695.
[2] Kim J C, Choi G, Heung T, et al. Pathogenicity and pyrenocine production ofCurvulariainaequalisisolated from zoysia grass [J]. Plant Disease, 2000, 84: 684-688.
[3] 李荣金. 百日草链格孢菌毒素的生产、分离、纯化和鉴定及其作为微生物源除草剂潜力的研究[D].南京:南京农业大学,2005.
[4] 唐树戈, 牟林, 郑其格, 等. 玉米弯孢叶斑病菌毒素稳定性的研究[J]. 植物保护, 2009, 35(1): 111-113.
[5] 付丹妮. 具除草活性放线菌筛选及其活性物质研究[D]. 沈阳: 沈阳农业大学, 2011.
[6] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[7] 宇克莉,孟庆敏,邹金华.镉对玉米幼苗生长、叶绿素含量及细胞超微结构的影响[J].华北农学报,2010,25(3):118-123.
[8] Amalo K, Chen G X, Asade K. Separate assays specific for ascorbate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase implants[J]. Plant and Cell Physiology, 1994, 35: 497-504.
[9] 万佐玺, 朱晶晶, 强胜. 链格孢菌毒素对紫茎泽兰的致病机理[J]. 植物资源与环境学报, 2001, 10(3): 47-50.[10]李荣金,强胜.百日草链格孢菌毒素对加拿大一枝黄花叶片伤害的生理生化研究[J].西北植物学报,2006,26(5):995-1000.
[11]张静, 朱为民. 低温胁迫下番茄细胞超微结构的变化[J]. 河南农业科学, 2012, 41(2): 108-110, 114.
[12]张云霞, 范兰兰, 施祖荣, 等. 莲子草假隔链格孢毒素对空心莲子草叶片和根尖组织超微结构的影响[J]. 华中农业大学学报, 2011, 30(1): 84-88.
[13]Gao Junjie, Li Tao, Yu Xianchang. Gene expression and activities of SOD in cucumber seedlings were related with concentrations of Mn2+, Cu2+, or Zn2+under low temperature stress[J]. Agricultural Sciences in China, 2009,8(6): 678-684.
[14]Chen Shiguo, Yin Chunyan, Jörg Reto, et al. Reactive oxygen species from chloroplasts contribute to 3-acetyl-5-isopropyltetramic acid-induced leaf necrosis ofArabidopsisthaliana[J]. Plant Physiology and Biochemistry, 2012, 52: 38-51.
[15]姜述君, 张国庆, 于涵, 等. 狭卵链格孢菌毒素细交链孢菌酮酸对稗草细胞膜脂质过氧化作用的影响[J]. 植物保护学报, 2011, 38(2): 178-182.
Physiological effects of the substances with herbicidal activity fromStreptomyceslavendulaeonAbutilontheophrastileaves
Wei Songhong, Yang Yafei, Li Pingsheng, Lin Liwen, Dong Qin, Ji Mingshan
(College of Plant Protection, Shenyang Agricultural University, Shenyang 110866, China)
The effects of the substances with herbicidal activity, D -13 components, fromStreptomyceslavendulaeon membrane permeability, MDA content, SOD, CAT and APX activities in cells ofAbutilontheophrastiMedicus leaves were studied through analyzing the resistance physiology. The results showed that the cell membrane permeability and the MDA content increased with the increase of D -13 concentration. Under the electron microscope, leaf cell membrane system showed different symptoms with the increase of D -13 concentration. SOD, CAT and APX activities declined to different degrees with the extension of processing time of D -13 components. Compared with the controls, SOD, CAT and AXP activities were the lowest at 40 h, decreasing more than 60%, 30% and 50%, respectively, compared with the control. It is concluded that D -13 components could effectively depressed the physiological activities ofA.theophrastileaves.
substance with herbicidal activity; membrane permeability; MDA; enzyme activity; ultramicrostructure
2014-02-25
2014-05-11
公益性行业(农业)科研专项(201303031)
S 451,S 476
A
10.3969/j.issn.0529-1542.2015.02.004
联系方式 E-mail: songhongw125@163.com

