麦长管蚜OBP7基因的RNA干扰
杨 爽, 尹 姣, 曹雅忠, 樊 东, 李克斌*
(1. 东北农业大学农学院, 哈尔滨 150030; 2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
麦长管蚜OBP7基因的RNA干扰
杨 爽1,2, 尹 姣2, 曹雅忠2, 樊 东1*, 李克斌2*
(1. 东北农业大学农学院, 哈尔滨 150030; 2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室, 北京 100193)
OBP是蚜虫嗅觉功能中的一类重要分泌蛋白,能选择性地结合气味分子并进行信号转导。本试验使用显微注射法将麦长管蚜OBP7的小干扰RNA(siRNA)导入麦长管蚜体内,通过qRT-PCR检测OBP7 mRNA相对表达量的变化情况。结果发现在siRNA浓度0.32 μg/μL,注射量23 nL,注射后24 h,麦长管蚜成蚜的mRNA相对表达量降低到37.1%,证明了显微注射方式进行RNA干扰的可行性。在注射23 nL的siRNA-467,经过36 h后,麦长管蚜出现了对EβF趋性行为的改变(P<0.05),表明OBP7蛋白在麦蚜对EβF的识别过程中具有重要作用。
麦长管蚜; OBP7; RNA干扰; 荧光定量PCR
OBP7(odorant binding protein 7,OBP7)是钟涛在麦长管蚜中发现的一种气味结合蛋白基因,基因登录号为GQ847859.2,全长为616个碱基对;该蛋白对报警信息素的主要成分反-β-法尼烯(EβF)有很强的结合特性,钟涛推测它可能是报警信息素结合受体[1]。气味结合蛋白(odorant binding protein,OBP)是蚜虫嗅觉功能中的一类重要分泌蛋白,它主要识别6个保守位置的半胱氨酸,并形成3对内锁的二硫键结构[2],能选择性地结合气味分子并能进行信号转导[3]。嗅觉是蚜虫与外部环境进行信息交流的主要手段,在觅食、聚集、选择生境及危险规避等行为中起着重要作用[4]。
麦长管蚜[Sitobionmiscanthi(Takahashi)]在分类学上属半翅目胸喙亚目蚜科,通常进行周期性的孤雌生殖[5],是我国各麦区的优势种。它通过刺吸式口器吸食小麦营养、影响其光合作用,而且还传播麦类病毒如大麦黄矮病毒(Barleyyellowdwarfvirus,BYDV)等,导致小麦减产和品质下降,严重威胁小麦生产[6]。20世纪70年代以来,麦蚜的危害由间歇性增长发生变成如今的常发性发生,发生数量和面积呈现逐年上升趋势[7]。
RNA干扰(RNA interference,RNAi)是Fire等发现的一种能特异性干扰目的基因mRNA表达的技术[8]。通过向目标生物体内导入特定双链RNA(double-stranded RNA,dsRNA)能引起转录后水平的基因沉默[9]。小干扰RNA(small interference RNA, siRNA)能与Dicer以及Argonaute蛋白的PAZ区结合形成RNA诱导沉默复合物(RNA-induced silencing complex, RISC)。RISC在ATP作用下被激活并解链,与目的mRNA配对的一条链引导RISC特异性切割 mRNA并使之降解[10],另一条链在RNA依赖性的RNA聚合酶(RNA dependent RNA polymerase,RdRP)的作用下,扩增生成大量新的siRNA。新生成的siRNA又形成RISC,然后继续降解目的mRNA。通过此机制将RNA干扰信号不断在细胞内放大[11],最终使目的基因mRNA的表达量降低。
将dsRNA或siRNA导入生物体内的方法有浸泡法、喂食法、注射法等[12]。Fire 等最早通过浸泡法在线虫体内发现了RNA干扰现象[8]。于文娟和王晖等通过Parafilm膜夹营养液喂食法成功对麦长管蚜进行了RNA干扰试验,并取得了较好的干扰效果[13-14]。注射siRNA法能精确地对注入的siRNA剂量及注射部位进行调整从而取得高水平的干扰效果。本试验选择显微注射法向麦长管蚜体内导入siRNA,研究siRNA对麦长管蚜OBP7 mRNA干扰的效果,以期为探索或解析OBP7的功能奠定基础。
1 材料与方法
1.1 材料与试剂
麦长管蚜于2013年4月采自河北省廊坊市中国农业科学院廊坊科研中试基地。在室温(20±2)℃、相对湿度60%~80%,光照周期L∥D=16 h∥8 h的条件下用小麦苗进行饲养繁殖。当土培小麦苗出土约3 cm时,把麦长管蚜转移到麦苗上。小麦品种是感蚜虫品种‘中旱101’。
RNA提取试剂TRIzol Reagent购自Invitrogen公司,反转录试剂盒PrimeScriptTMRT Reagent Kit(Perfect real time),荧光定量试剂SYBR Premix ExTaqTMⅡ(Tli RNaseH Plus)购自TaKaRa公司,普通PCR试剂TaqMix购自Biomed公司。显微注射仪Nanoliter 2010,购自World Precision Instruments公司。反-β-法尼烯购自Sigma Aldrich公司,石蜡油购自广达恒益公司,大气采样仪购自北京市劳动保护科学研究所。
1.2 试验方法
1.2.1 总RNA提取及cDNA合成
选取2日龄麦长管蚜成蚜若干头,按照TRIzol Reagent技术手册提取RNA,用1.2%琼脂糖凝胶电泳及微量紫外分光光度计对RNA进行质量检测,合格后留存放入-80 ℃冰箱中备用。
使用PrimeScriptTMRT Reagent Kit反转录试剂盒对RNA进行反转录,合成荧光定量PCR所需要的模板cDNA。Oligo (dT)引物和随机六聚体引物按1∶1的体积比混合作为反转录引物,具体步骤参见PrimeScriptTMRT Reagent Kit试剂盒的操作说明。
1.2.2 引物设计和siRNA的合成
实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)选择β-actin基因作为内参基因,利用Primer Premier 5软件设计引物。表1中F1、R1和F2、R2分别为OBP7和β-actin基因PCR及qPCR的上下游引物,扩增片段长度分别为241 bp和230 bp;siRNA-467是以OBP7 mRNA为靶序列设计的双链小干扰RNA,由上海吉玛公司设计合成。siRNA-467的一条链与图1所示的灰色部分碱基互补,双链的3′端添加了“TT”臂。siRNA-NC为双链无意义序列对照。siRNA配制成0.32 μg/μL终浓度的试剂备用。

表1 试验所用引物及siRNA序列

图1 OBP7基因的siRNA干扰位点Fig.1 The interfering site of small interference RNA in OBP7 gene
普通PCR反应体系:forward primer (10 μmol/L)0.5 μL,reverse primer (10 μmol/L)0.5 μL,TaqMix 12.5 μL,cDNA 模板0.5 μL,超纯水定容至25 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s, 35个循环;72 ℃终止延伸10 min;用1.2%琼脂糖凝胶电泳检测结果。
1.2.3 荧光定量PCR标准曲线绘制
提取未处理的麦长管蚜成蚜总RNA,反转录后将cDNA模板按100、101、102、103、104倍数进行稀释,每个浓度3次重复来绘制实时荧光定量PCR的标准曲线。实时荧光定量PCR体系:SYBR PremixExTaqⅡ(2×)10.0 μL,forward primer (10 μmol/L)0.4 μL,reverse primer (10 μmol/L)0.4 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,cDNA 2.0 μL,ddH2O 6.8 μL,总体积20 μL。
荧光定量PCR反应条件为:95 ℃ 30 s;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。
1.2.4 麦长管蚜siRNA的显微注射及相对表达量检测
选择麦长管蚜2龄成蚜,放置于装有琼脂糖凝胶的培养皿上并用适量的CO2气体使其昏迷。使用显微注射仪Nanoliter 2010通过毛细管将0.32 μg/μL siRNA-467注射至麦长管蚜腹部,设置15 nL和23 nL两个注射量,以注射DEPC水为空白对照组,注射siRNA-NC为阴性对照组。保证每组麦长管蚜存活数量为30头,将注射后的麦长管蚜转移到装有水培麦苗的离心管中饲养。注射过程中,丢弃由于机械损伤造成体液外流的麦蚜。
分别在注射后12、24和36 h,每组随机抽取10头麦长管蚜,通过荧光定量PCR进行OBP7 mRNA的相对表达量检测, 另外20头进行对EβF的趋性试验。
1.2.5 麦长管蚜“Y”形管行为测定
“Y”形嗅觉仪试验装置如图2所示,嗅觉仪三臂长10 cm,内径2 cm,两臂夹角75°,主臂接大气采样仪作为抽气泵。把一根形状与“Y”形管相似的铁丝放入“Y”形管中便于麦长管蚜行动。图2装置中接口处均用Teflon管连接。
试验前将一侧进气管放入装有水的水杯中,另一侧堵塞,开启大气采样仪检测装置气密性,两侧检测完毕后进行试验。试验前配制气源物,分别将0.2、2、4、8 μg EβF用20 μL石蜡油稀释后滴加在滤纸条上放入气源瓶中作为气味源。对照组气源瓶内放入直接滴加20 μL石蜡油的滤纸。试验中大气采样仪流速控制为100 mL/min,将“Y”形管主臂用黑布盖住,根据荧光定量PCR试验结果,选择干扰效果最好的处理组麦长管蚜20头放于“Y”形管铁丝上,10 min为1次观测时段,在观测时间内蚜虫进入侧臂超过3 cm,停留1 min及以上定义为趋性反应。

图2 麦长管蚜对EβF的趋向反应装置Fig.2 Y-typed olfactometer for testing orientation of S.miscanthi to EβF
1.2.6 数据的计算与处理
采用2-ΔΔCt法进行mRNA相对表达量的计算,基本方程为N=N0(1+E)Ct,N0为起始模板cDNA拷贝数,N为循环数Ct之后拷贝数,E为该基因扩增效率。
2-ΔΔCt计算步骤:
① 用内参基因校正样品间差异,Ct目的基因-Ct内参基因=ΔCt;
② 处理样品与参照样品进行比较,ΔCt处理样品-ΔCt参照样品=ΔΔCt;
③ 处理样品mRNA相对于参照样品的表达量=2-ΔΔCt。
试验数据使用统计软件SAS 9.1进行分析。不同处理间差异显著性检验的统计分析,使用ANOVA/LSD方法分析和检验,确定差异显著水平为P<0.05。
2 结果与分析
2.1 引物特异性检测
图3泳道2为241 bp的OBP7单一条带,泳道4为230 bp的β-actin单一条带,无模板对照泳道1、3无条带。荧光定量PCR熔解曲线中可以看到OBP7和β-actin都是单峰且无杂带,证明设计引物特异性良好(图4)。
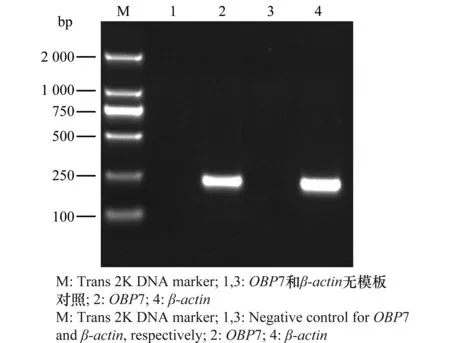
图3 OBP7和β-actin的PCR产物Fig.3 PCR products of OBP7 and β-actin

图4 OBP7和β-actin的熔解曲线Fig.4 Dissociation curves of OBP7 and β-actin
2.2 荧光定量标准曲线
如图5所示,通过ABI 7500型荧光定量PCR仪得到OBP7和β-actin标准曲线方程分别为:Y=-3.13X+27.045,R2=0.994,扩增效率=108.7%;Y=-3.197X+22.8,R2=0.995,扩增效率=105.5%。ABI 7500给出的目的基因OBP7与内参基因β-actin的扩增效率分别为108%和105%,一致率为100%,两方程R2均大于0.990,符合2-ΔΔCt法计算要求。

图5 荧光定量PCR中OBP7和β-actin的标准曲线Fig.5 Standard curves of OBP7 and β-actin in qPCR
2.3 siRNA干扰效果分析
图6为在15 nL siRNA-467注射量时OBP7 mRNA在处理后不同时间的相对表达量。当注射后时间相同时,处理组siRNA-467与空白对照组DEPC水之间差异显著(P<0.05)。OBP7 mRNA相对表达量最低值在24 h后出现,最低值为46.3%,在36 h时OBP7的相对表达量有一定回升,注射后24 h与12 h和36 h差异显著(P<0.05),注射后12 h与36 h差异不显著(P>0.05)。
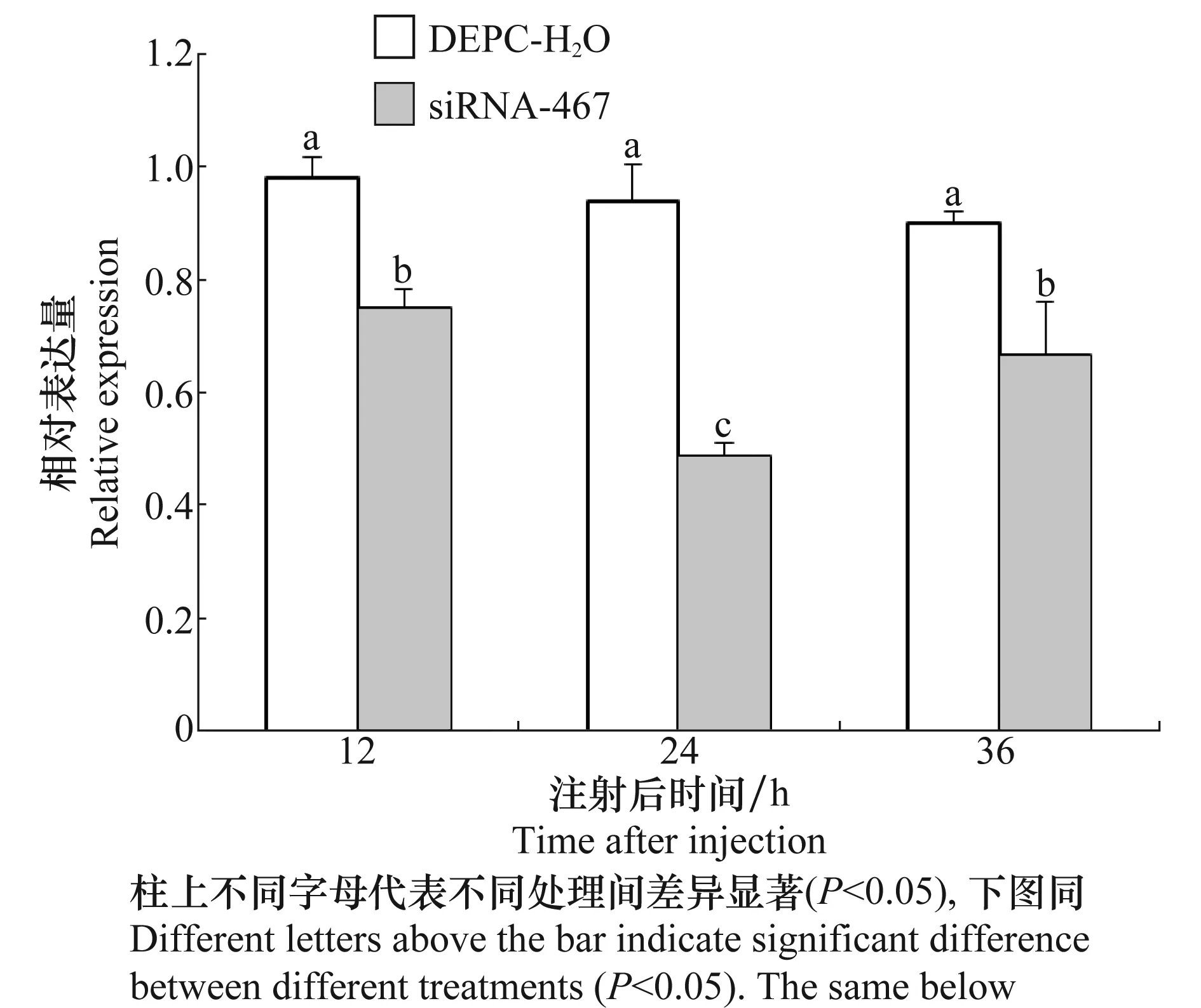
图6 注射量为15 nL下不同时间处理的mRNA相对表达量Fig.6 Relative expression levels of OBP7 mRNA under different processing times with an injecting volume of 15 nL siRNA
图7为在23 nL siRNA-467注射量时OBP7 mRNA在处理后不同时间的相对表达量。从图中可以看出,处理组siRNA-467与对照组DEPC水之间差异显著。OBP7 mRNA相对表达量最低值在注射后24 h出现,最低值为46.3%,在36 h时的相对表达量有一定回升,24 h与12 h差异显著,12 h处理与36 h处理差异不显著。整体结果与注射量为15 nL时相似,而干扰效率高于注射15 nL,因此后续试验中选用注射23 nL siRNA-467的麦长管蚜进行“Y”形管行为试验。
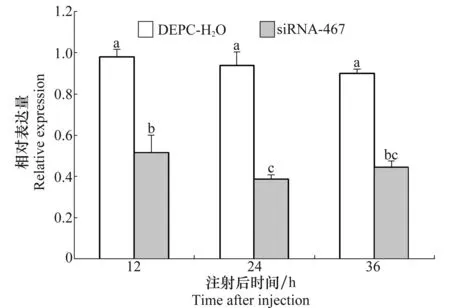
图7 注射量为23 nL下不同时间处理的mRNA相对表达量Fig.7 Relative expression levels of OBP7 mRNA under different processing times with an injecting volume of 23 nL siRNA
如图8所示为麦长管蚜在分别注射23 nL DEPC水、siRNA-467和siRNA-NC后0 h和12 h时的OBP7 mRNA相对表达量。注射后0 h时,3种不同注射处理下麦长管蚜的OBP7 mRNA相对表达量两两间差异不显著(P>0.05)。12 h时,siRNA-NC处理与DEPC水处理间差异不显著(P>0.05),siRNA-467处理分别与DEPC水和siRNA-NC间差异显著(P<0.05)。表明,OBP7 mRNA相对表达量仅在siRNA-467注射后出现改变,试验中并未出现脱靶效应。
2.4 麦长管蚜“Y”形管行为分析
当试验开始时,大多数麦长管蚜沿铁丝逆气流方向运动,部分爬行较快,部分爬行较慢,其触角不断前后左右摆动。当进入铁丝分叉口时略微停留,随后进入其中一臂。
表2为未处理麦长管蚜进行“Y”形管试验的结果。空白对照中EβF臂的虫口数与石蜡油臂中的虫口数差异不显著(P>0.05)。使用0.2 μg EβF时,EβF臂的虫口数与石蜡油臂中的虫口数差异不显著(P>0.05),此浓度的EβF对麦长管蚜行动影响不大。而当使用2、4、8 μg EβF时,EβF臂的虫口数与石蜡油臂中的虫口数差异显著(P<0.05),麦长管蚜表现出对EβF臂的强烈的驱避性。因此后续试验选择使用8 μg EβF进行试验。
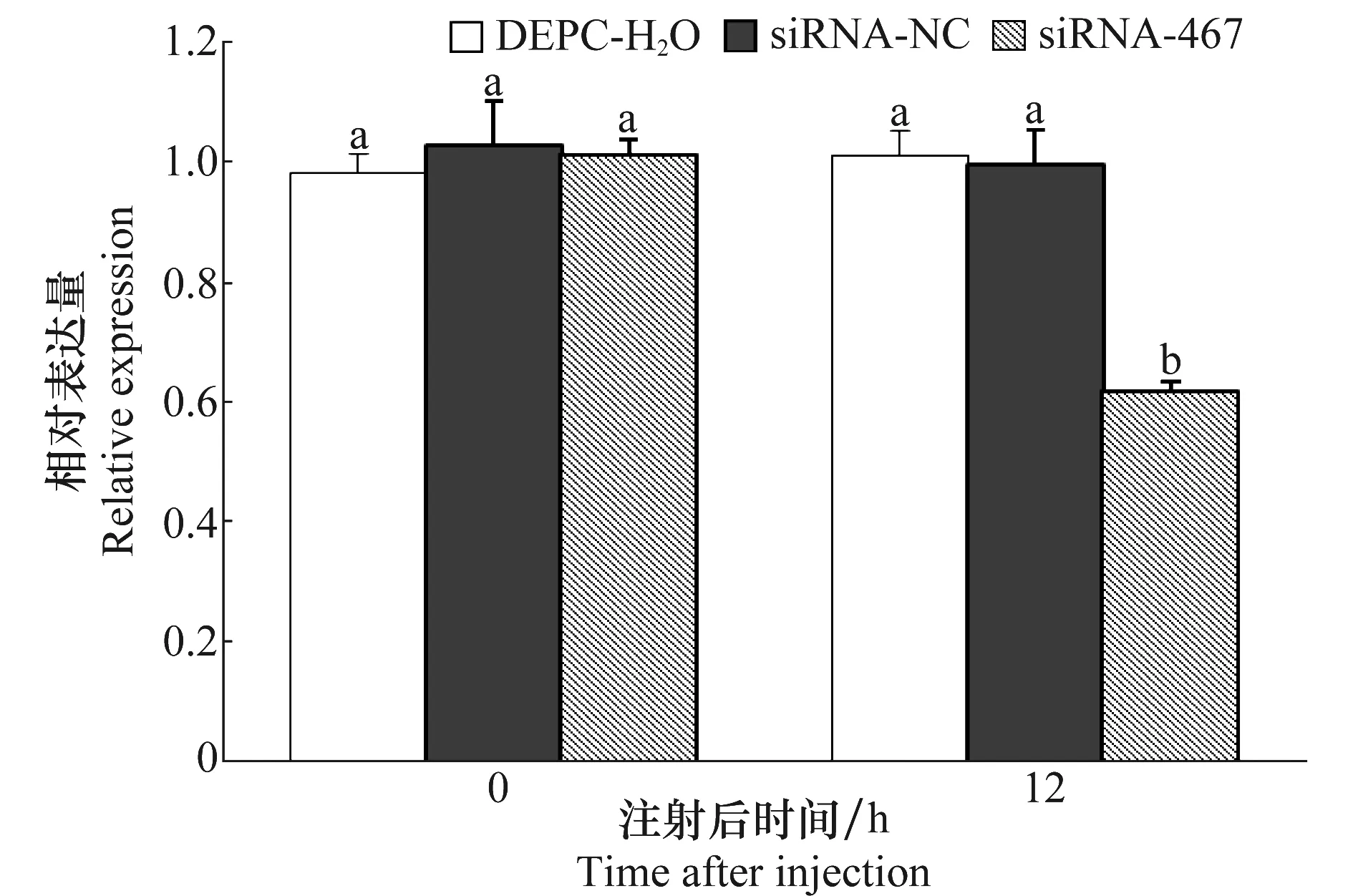
图8 不同注射处理下OBP7 mRNA相对表达量Fig.8 Relative expression of OBP7 mRNAin different injection treatments
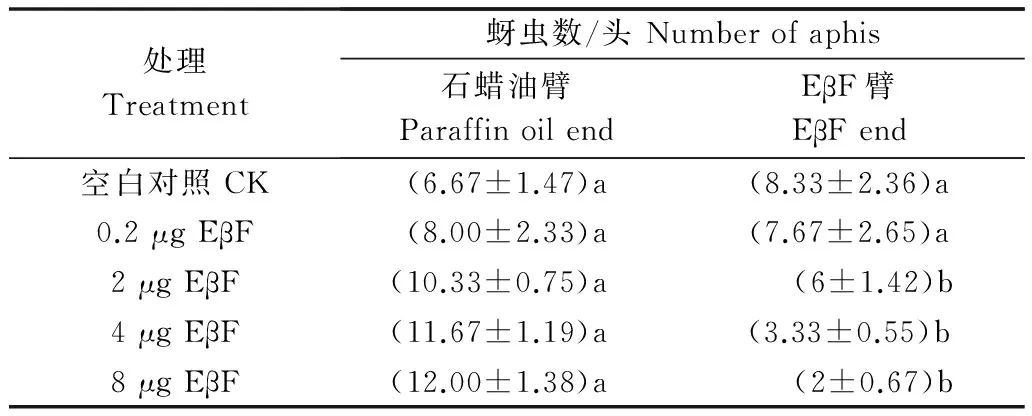
处理Treatment蚜虫数/头Numberofaphis石蜡油臂ParaffinoilendEβF臂EβFend空白对照CK(6.67±1.47)a(8.33±2.36)a0.2μgEβF(8.00±2.33)a(7.67±2.65)a2μgEβF(10.33±0.75)a (6±1.42)b4μgEβF(11.67±1.19)a(3.33±0.55)b8μgEβF(12.00±1.38)a (2±0.67)b
1) 表中同列数据后不同小写字母表示差异显著(P<0.05),下同。
Data with different lowercase letters in the same column indicate significant difference (P<0.05). The same below.
如表3所示,空白对照组中,EβF臂的虫口数与石蜡油臂中的虫口数差异显著(P<0.05)。注射siRNA-467后12 h和24 h时,EβF臂中的虫口数与石蜡油臂中的虫口数差异显著(P<0.05),说明此时的麦长管蚜对EβF的趋性并未受到影响;而注射siRNA-467后36 h,EBF臂的虫口数与石蜡油臂中的虫口数差异不显著(P>0.05),说明麦长管蚜的趋性发生了变化,即OBP7的mRNA表达被干扰影响了麦长管蚜对EβF的识别能力。
3 结论与讨论
通过人工合成与OBP7 mRNA同源的21 bp的siRNA-467,利用显微注射的方法实现了对麦长管蚜OBP7的RNA干扰,并且通过注射无意义的siRNA-NC为对照确定干扰效果并未出现脱靶效应。然后在不同注射量与注射后不同时间段使用qPCR技术对OBP7 mRNA的相对表达量进行了检测。在siRNA浓度为320 ng/μL时,注射量23 nL的干扰效果在3个不同检测时间始终高于注射量15 nL,这与Turner等利用RNA干扰苹淡褐卷蛾CXE1及PBP1基因时发现喂食不同数量的dsRNA能导致不同效率的RNAi结论一致[15]。Mutti等用显微注射siRNA的方法干扰豌豆蚜唾液基因时发现在siRNA浓度为10 μg/μL,注射量为5 nL的条件下,豌豆蚜的致死率最高[16]。

表3 注射23 nL siRNA-467后麦长管蚜对
当RNA干扰时间不同时,发现siRNA注射量为15 nL时,前24 hOBP7 mRNA干扰效果随时间增加呈下降趋势,但在36 h时mRNA表达量回升。当siRNA注射量为23 nL时,前24 h RNA干扰效果随时间增加呈下降趋势,处理后24 h与36 h的RNA干扰效果基本相同。王晖等用喂食法干扰麦长管蚜P450基因时发现使用浓度为7.5 ng/μL的dsRNA喂食时,干扰效果随时间增加而增加,P450 mRNA相对表达量在8 d后达到最低值36.29%,与本试验的最低值37.1%相似[14]。Turner等在研究苹淡褐卷蛾时发现,EposCXE1基因mRNA的表达量随着dsRNA喂食时间的延长呈下降趋势,下降到一定量后出现一个较低的稳定表达量[15]。推测可能的原因是mRNA的表达量变化是一个动态的过程,由于DNA能够转录生成mRNA,当生物体的某种蛋白或多肽缺失时,会产生信号并诱导mRNA的合成来进一步指导翻译过程。所以RNA干扰初期会出现mRNA表达量的显著下降,但是最后进入一个平稳期。与mRNA表达量变化不同的是,由于mRNA缺失造成的功能蛋白的减少会导致生物体的死亡率随着RNA干扰时间的延长而增加。
通过“Y”形管对麦长管蚜进行行为测定,发现麦长管蚜对EβF有很强的驱避作用。而当对麦长管蚜被注射siRNA-467后36 h时由于OBP7的表达缺陷造成麦长管蚜的趋性发生了变化,说明麦长管蚜丧失了对EβF的驱避能力,证实OBP7蛋白与EβF间有一定作用关系,而是否OBP7基因就是报警信息素结合蛋白受体基因,有待更多的试验验证。如能开发一种能够随时检测OBP7蛋白表达量变化的技术,当麦长管蚜被RNA干扰后丧失对EβF的感知能力时,通过检测此时麦长管蚜体内OBP7蛋白含量的多少就能进一步确定它与EβF即报警信息素之间的关系。
[1] 钟涛. 麦长管蚜气味结合蛋白的结合特性及组织定位[D].北京:中国农业科学院, 2012.
[2] Pelosi P, Calvello M, Ban L P.Diversity of odorant-binding proteins and chemosensory proteins in insects[J].Chemical Senses, 2005, 30(S 1): i291-i292.
[3] 陈伟. 褐飞虱对水稻挥发物的触角电位反应及其气味结合蛋白基因的克隆[D].武汉:华中农业大学,2012.
[4] 李兆防. 昆虫的嗅觉[J].生物学教学,2011, 36(7):64-66.
[5] Simon J C, Rispe C, Sunnucks P.Ecology and evolution of sex in aphids [J].Trends in Ecology & Evolution,2002,17(1):34-39.
[6] 曹雅忠,尹姣,李克斌,等.小麦蚜虫不断猖獗原因及控制对策的探讨[J].植物保护,2006,32(5):72-75.
[7] 张烨. 微卫星标记对不同地理种群麦长管蚜体色的遗传多样性分析[D].武汉:华中农业大学,2009.
[8] Fire A, Xu S Q, Montgomery M K, et al. Potent and specific genetic interference by double-stranded RNA inCaenorhabditiselegans[J].Nature,1998, 391(6669):806-811.
[9] Liu Shuhua, Ding Zhiping, Zhang Chengwei, et al. Gene knockdown by intro-thoracic injection of double-stranded RNA in the brown planthopper,Nilaparvatalugens[J].Insect Biochemistry and Molecular Biology,2010,40(9):666-671.
[10]Martinez J, Patkaniowska A, Urlaub H, et al. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi[J].Cell,2002, 110(5):563-574.
[11]Nykänen A, Haley B, Zamore P D.ATP requirements and small interfering RNA structure in the RNA interference pathway [J].Cell, 2001, 107(3):309-321.
[12]杨中侠,文礼章,吴青君,等. RNAi 技术在昆虫功能基因研究中的应用进展[J].昆虫学报,2008, 51(10):1077-1082.
[13]于文娟,陈巨莲,程登发,等.dsRNA 喂养对麦长管蚜 Cdc42 mRNA 相对表达量的影响[M]∥吴孔明.植保科技创新与病虫防控专业化——中国植物保护学会 2011 年学术年会论文集. 北京:中国农业科学技术出版社,2011.
[14]王晖,张珉,张小红,等. 利用 RNAi 技术沉默麦长管蚜与桃蚜细胞色素 P450[J].中国农业科学,2012,45(17):3463-3472.
[15]Turner C T, Davy M W, MacDiarmid R M, et al. RNA interference in the light brown apple moth,Epiphyaspostvittana(Walker) induced by double‐stranded RNA feeding [J].Insect Molecular Biology, 2006, 15(3):383-391.
[16]Mutti N S, Park Y, Reese J C, et al. RNAi knockdown of a salivary transcript leading to lethality in the pea aphid,Acyrthosiphonpisum[J].Journal of Insect Science, 2006, 6:38.
(责任编辑:杨明丽)
RNA interference ofOBP7 gene inSitobionmiscanthi
Yang Shuang1,2, Yin Jiao2, Cao Yazhong2, Fan Dong1, Li Kebin2
(1. College of Agriculture, Northeast Agricultural University, Harbin 150030, China; 2. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Odorant binding protein (OBP) is one of the most important functional proteins in olfaction of the aphids, with which aphids can combine odor molecules and transduce them. A microinjection method was used to deliver small interference RNAs which were synthesized specifically forOBP7 gene into the adult aphids. The variation of the relative expression of the mRNA in adult aphids was detected by using qRT-PCR technique. The mRNA relative expression decreased to the lowest level of 37.1% in 24 hours when injected with 23 nL of siRNA at a concentration of 0.32 μg/μL, which demonstrates the feasibility of microinjection for RNA interference. Aphids changed their taxic behavior to EβF significantly (P<0.05) after 36 hours when treated with 23 nL siRNA.It indicates that OBP7 play a very important role in aphid alarm pheromone(EβF) discrimination.
Sitobionmiscanthi; odorant binding protein 7; RNA interference; real-time PCR
2014-04-18
2014-09-11
公益性行业(农业)科研专项 (201103022)
Q 963
A
10.3969/j.issn.0529-1542.2015.03.020
* 通信作者 E-mail:dnfd@163.com;likebin54@163.com

