鸭短喙-侏儒综合征病原的初步鉴定
李传峰,李 琦,陈宗艳,唐井玉,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
鸭短喙-侏儒综合征病原的初步鉴定
李传峰,李 琦,陈宗艳,唐井玉,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
2014年下半年以来,在我国华东地区商品肉鸭养殖地区暴发了一种以生长迟缓、鸭喙变短、舌头外露下垂、跛行、瘫痪、拉稀以及翅腿易折断为主要临床特征的传染性疾病,暂命名为鸭短喙-侏儒综合征。剖检时可见发病鸭胰腺、肺脏和胸腺等组织出血。组织病理学变化主要表现为心脏、胰腺、肾脏、肺脏和肝脏等组织细胞变性、坏死以及充血、出血。RT-PCR/PCR检测结果显示,在患鸭组织中存在类似鹅细小病毒(Goose parvovirus,GPV)的特异性核酸,未见其他水禽病毒核酸。系统进化树分析显示本病病原与经典GPV密切相关。免疫组化进一步检测发现,患鸭组织中存在GPV特异性的抗原。鉴于本病与经典水禽细小病毒病的临床表征、剖检及组织病理学变化的差异性,我们初步确定鸭短喙-侏儒综合征病原为一种与GPV密切相关的新型鸭细小病毒(Novel duck parvovirus,NDPV)。
鸭短喙侏儒综合征;鹅细小病毒;免疫组化;PCR
2014年下半年以来,在我国江苏省、安徽省、山东省等地的商品肉鸭养殖地区暴发了一种以生长迟缓、鸭(上下)喙变短、舌头外露下垂、跛行、瘫痪、拉稀以及翅、腿易折断为主要临床特征的传染性疾病,暂命名为鸭短喙-侏儒综合征。目前,本病已蔓延到全国大部分养鸭地区。根据本实验室初步流行病学调查发现,鸭短喙-侏儒综合征主要发生于10~25日龄肉鸭,发病鸭常因采食和饮水困难而消瘦,甚至死亡,发病率20%~30%,甚至高达50%,给养鸭业造成了巨大的经济损失。为了明确鸭短喙-侏儒综合征的病因,本实验室从安徽省砀山县养鸭场采集具有典型临床症状的发病鸭主要组织器官,结合前期流行病学调查、临床症状、剖检变化和一系列的实验室检测方法,初步鉴定本病的病原为一种与鹅细小病毒(Goose parvovirus,GPV)密切相关的新型鸭细小病毒(Novel duck parvovirus,NDPV)。
1 材料与方法
1.1 病料的采集与处理 本研究病料来自于2015年6月安徽省砀山县某养鸭场发病鸭,20~25日龄,发病率为10%~20%。采集发病鸭的主要组织器官,经常规方法匀浆,反复冻融3次后10 800×g离心10 min,小心取出上清液经0.22 μm滤膜过滤后保存备用。
1.2 主要试剂 组织DNA抽提试剂盒(Tissue DNA Kit)为OMEGA公司产品;质粒小量提取试剂盒和DNA凝胶回收试剂盒购自Axygen公司;LA Taq酶、T4 DNA连接酶、dNTP和pMD19-T 载体均购自Tamara宝生物工程(大连)公司;感受态细胞E.coli DH5α购自北京全式金生物技术有限公司;兔抗鹅细小病毒(Goose parvovirus,GPV)多克隆抗体(琼扩效价为1∶16)由本实验制备和保存;辣根过氧化物酶(Horseradish peroxidase,HRP)标记的羊抗兔多克隆抗体购自Sigma公司;免疫组织化学染色试剂盒购于北京中杉金桥生物技术有限公司。
1.3 剖检和组织病理学变化 观察并记录发病鸭的典型临床症状和剖检变化,采集心脏、肝脏、脾脏、肺脏、肾脏、胰腺、小肠、直肠、胸腺和法氏囊等组织,用4%多聚甲醛固定后,经常规脱水、透明、浸蜡、包埋、切片和HE染色,光镜观察组织病理变化。
1.4 免疫组化法检测 根据文献[1]将石蜡包埋组织进行免疫组化染色检测抗原。
1.5 RT-PCR/PCR鉴定 按照组织DNA抽提试剂盒说明书抽提患鸭组织DNA,然后根据文献[2、3]中设计的不同水禽病毒鉴定引物和反应条件进行PCR扩增,PCR产物用1%琼脂糖凝胶电泳进行检测。引物由上海英骏生物工程技术服务有限公司合成。
1.6 VP3基因系统进化树分析 根据GenBank登录的GPV B株(登录号:U25749)全基因组序列,设计一对能涵盖VP3基因的引物[4],由上海英俊生物工程技术服务有限公司合成。上游引物GF:5'-AACCTGTGGCAGCATCTGAA-3',下游引物GR:5'-GCGCCAGGAAGTGCTTTATT-3'。取1.5中所述患鸭组织DNA为PCR模板,根据文献[4]的反应条件进行扩增后,PCR产物经琼脂糖凝胶电泳检测并克隆至pMD19-T载体进行鉴定。对鉴定正确的重组质粒进行测序和分析,并利用Mega6.0软件与GenBank中登录的GPV和番鸭细小病毒(Muscovy duck parvovirus,MDPV)参考株VP3序列及其编码氨基酸进行序列比对,构建系统进化树进行遗传进化分析。
2 结果
2.1 临床症状和剖检变化 患病鸭临床症状主要表现:精神萎顿,站立不稳,行走时双脚向外岔开或翻滚,严重的可出现跛行甚至瘫痪;鸭上下喙质地正常但变短,舌头外露下垂(图1A和B);鸭生长缓慢,翅腿易折断,部分患鸭出现腹泻,排草绿色稀粪(图1C)。剖检时,部分患鸭的胰腺表面有散在针尖大小出血点或弥漫性出血(图1D),肺脏充血、出血,胸腺轻微出血,脾脏稍萎缩,其余大部分内脏器官未见明显异常。
2.2 组织病理学变化 患鸭心脏心肌纤维出现水肿、坏死、断裂,间质充血和出血,并伴有炎性细胞灶性浸润(图2A)。胰腺组织中,部分腺泡出现水肿坏死;胰岛与腺泡边界不清晰,胰岛出现轻度损伤(图2B)。肾脏组织中可见炎性细胞呈灶性浸润;肾小管管腔出现扩张,肾小管上皮细胞水肿坏死,间质血管充血、出血(图2C)。肺脏组织严重的充血、出血,且可见部分肺组织出现局灶性坏死和炎性细胞灶性浸润(图2D)。此外,患鸭的肝脏脾脏、胸腺、小肠和直肠等组织也出现不同程度细胞肿胀、变性、坏死等组织病理学变化。
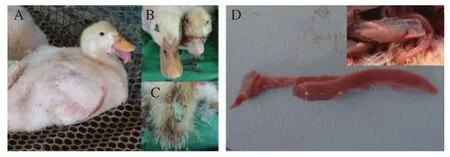
图1 患病鸭的主要临床症状和剖检变化Fig.1 The main clinical symptoms and autopsy changes of sick ducks

图2 患鸭部分器官组织病理学变化(200×)Fig.2 Histopathological changes of some organs from sick ducks (200×)
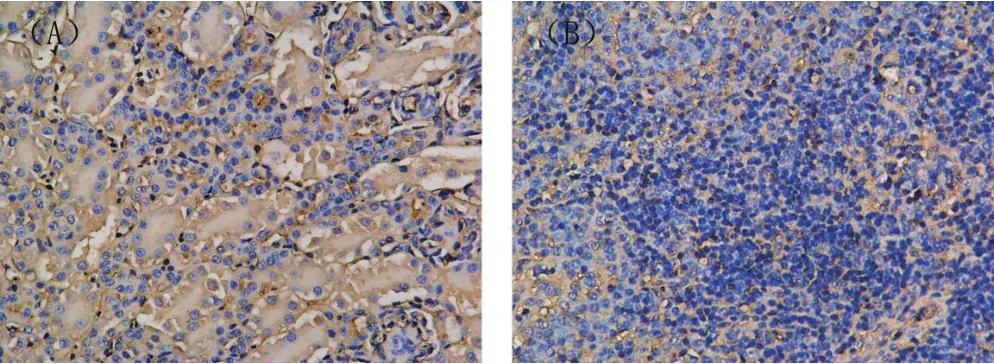
图3 患鸭组织中病毒抗原的免疫组化检测(200×)Fig.3 Immunohistochemistry assay results of viral antigens in tissues of sick ducks (200×)
2.3 免疫组化检测 利用本实验室制备的兔抗GPV多克隆抗体,可在患鸭的肾脏的肾小管上皮细胞和脾脏的淋巴细胞中检测到强阳性信号(图3)。
2.4 RT-PCR/PCR 鉴定 根据设计8对特异性引物对病原进行RT-PCR/PCR产物鉴定。结果显示,仅扩增出GPV的特异性条带,大小为465 bp,其余MDPV、禽流感病毒(Avian influenza virus,AIV)、新城疫病毒(Newcastle disease virus,NDV)、网状内皮增生病病毒(Reticuloendotheliosis virus,REV)、鸭甲肝病毒(Duck hepatitis A virus,DHAV)、呼肠孤病毒(Reovirus,RV)和鸭坦布苏病毒(Duck tembusu virus,DTMUV)以及阴性对照(图略)均未扩增出特异性条带(图4)。
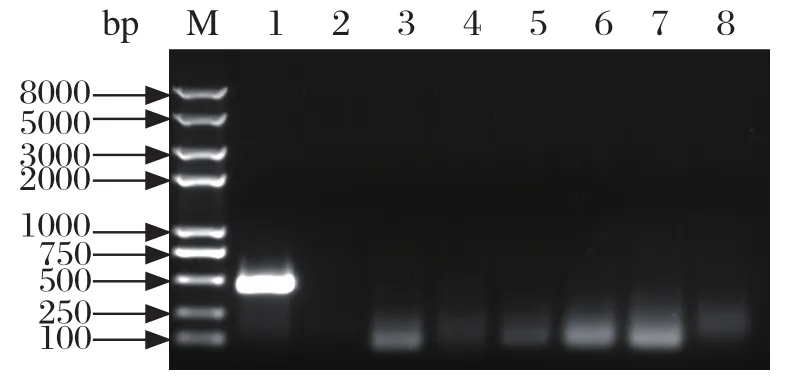
图4 PCR方法鉴定患鸭组织中的病毒Fig.4 Viruses identifi cation in tissues of sick ducks by PCR
2.5 VP3基因测序与进化分析 根据测序结果分析可知,NDPV的VP3基因大小为1605 bp,编码534个氨基酸,大小约为60 kDa。应用Mega6.0软件绘制VP3基因及其编码的氨基酸序列的系统进化树(图5和图6),发现水禽细小病毒可以分为3个明显的进化群:经典GPV群、经典MDPV群以及GPV和MDPV重组或变异群。本研究中的NDPV与经典GPV亲缘关系最近,而与MDPV亲缘关系较远。进一步分析发现,NDPV VP3基因与台湾鹅源GPV野毒82-0408株和GPV疫苗毒82-0321v株遗传进化关系最近,核苷酸同源性最高,可达98.4%,然而其编码氨基酸却与匈牙利GPV强毒B株以及德国GPV疫苗毒VG32/1株同源性最高,可达98.5%。
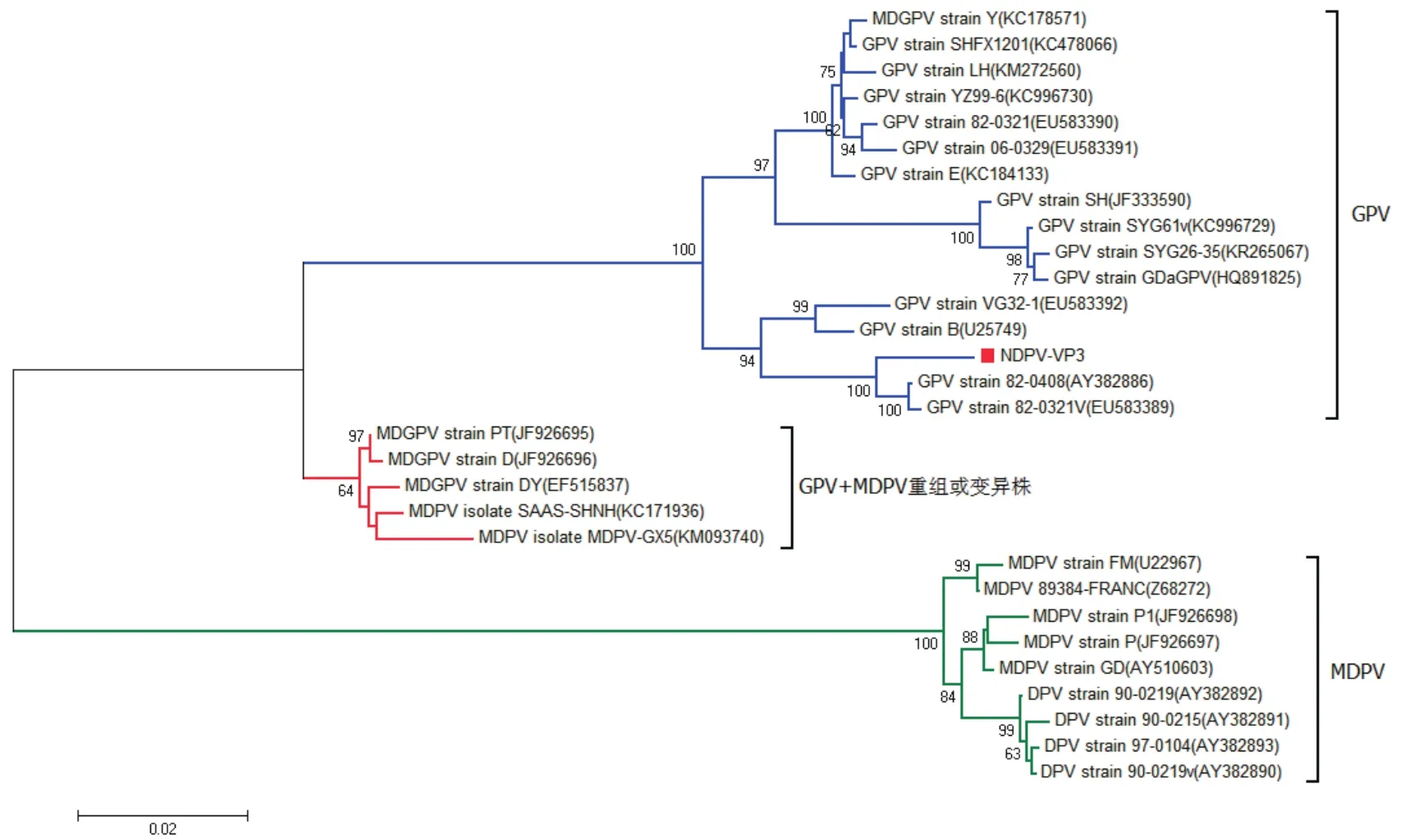
图5 基于水禽细小病毒VP3基因的系统进化树Fig.5 Phylogenetic tree based on VP3 gene of waterfowl Parvovirus strains

图6 基于水禽细小病毒VP3基因编码氨基酸序列的系统进化树Fig.6 Phylogenetic tree based on the deduced amino acid sequences of VP3 genes of waterfowl Parvovirus strains
3 讨论
水禽细小病毒属于细小病毒科(Parvoviridae)、细小病毒亚科(Parvovirinae)、依赖细小病毒属成员,主要包括GPV和MDPV。尽管GPV和MDPV在病毒形态结构、理化特性、培养特性和基因组结构等方面具有相似性,但其致病性和抗原性存在较大差异。在致病性方面,病毒具有严格宿主特异性,GPV主要感染雏鹅和雏番鸭,而MDPV仅感染雏番鸭;GPV感染特征性病变为小肠部位(空肠、回肠)急性卡他性、纤维素性坏死性肠炎(可形成“香肠样”栓塞物),而番鸭细小病毒病(俗称“三周病”)是一种以腹泻、喘气、软脚及进行性消瘦为主要症状的急性、败血性传染病。在抗原性方面,程晓霞等[5]研究表明,MDPV和GPV(番鸭源或鹅源)均只有一种血清型,两者抗原相关性较低(R<0.1),而番鸭源GPV和GPV属于同一血清型的不同亚型(0.8>R>0.25)。王永坤等研究表明,MDPV与GPV在抗原性上既存在差异,又有一定的相关性,其共同抗原主要分布在占整个衣壳蛋白比例较大的VP3上。
近年来,GPV的遗传进化更具有多样性,进化出不同的易感宿主以及血清亚型。GPV感染(又称“小鹅瘟”)最早于1956年在我国江苏省扬州市暴发,很快蔓延到全国各地,极少见番鸭发病,然而1997年后GPV在福建省多地番鸭群中暴发流行。可见,GPV具有了跨宿主传播的能力。本研究根据文献报道设计了8对水禽病毒特异性引物来鉴定鸭短喙侏儒综合征的病原,结果显示,采集的病料中仅检出GPV特异性的核酸。基于病原VP3基因及其编码氨基酸系统进化树分析也可发现,致病病原与经典GPV群处于同一个大的分支。通过免疫组化方法进一步证实,兔抗GPV抗体能够检测到患鸭组织存在GPV特异性的抗原。因此,推测本次暴发流行的鸭短喙侏儒综合征疫情的病原与GPV密切相关。然而如前所述,GPV仅感染雏鹅和雏番鸭,并未见感染商品肉鸭报道,而且本病原感染肉鸭后出现了不同于GPV或MDPV感染所致临床表型、剖检及组织病理学变化。因此,我们初步确定鸭短喙-侏儒综合征病原为一种与GPV密切相关的NDPV。
目前,NDPV与现有的水禽细小病毒(GPV和MDPV)具有何种遗传进化关系还不明确。国外学者Villatte(1989)曾报道早在20世纪70年代法国半番鸭群中也暴发了一种短喙和侏儒综合征。台湾学者Lu等[6]1989年10月从不同病毒混合感染的雏鸭群中分离一株鸭细小病毒(902193株),回归SPF雏鸭后表现出了类似的临床症状。1995年,Samorek-Salamonowicz等也报道了波兰的雏半番鸭发生短喙和侏儒综合征疫情,发病率为15%~25%。匈牙利学者Vilmos等分离病毒后在半番鸭上成功复制本病,并认为短喙和矮小综合征是由一种世系不同的鹅细小病毒引起[7]。2008年以后,中国华东和华南的半番鸭养殖地区也暴发了类似的疫病。黄瑜等[8]经过病原学检测、病毒分离鉴定和实验室感染实验发现其病原与经典MDPV在基因组特征、宿主范围和致病性存在较大的差异。因此,将该病病原暂命名为新型番鸭细小病毒(NMDPV)。陈少莺等[9]则认为该病病原为一种新型小鹅瘟病毒(NGPV)或GPV变异株。目前对引起雏半番鸭短喙和侏儒综合征的病原还未形成一致的观点,与本研究中的NDPV是否为同一种病原也缺乏有力的实验数据来支撑。因此,我们要进一步加强流行病学调查,明确NDPV的分类地位、生物学特性以及致病机制,为研制安全高效疫苗和综合防治奠定基础。
[1] 周春宇, 程安春, 汪铭书, 等. 检测鹅细小病毒的间接免疫酶组织化学法的建立[J]. 中国兽医杂志, 2006, 42(8)∶19-21.
[2] 刘家森, 姜骞, 司昌德, 等. 番鸭细小病毒与鹅细小病毒PCR 鉴别诊断方法的建立[J]. 中国兽医科学, 2007,37(6)∶ 469-472.
[3] 滕巧泱, 颜丕熙, 张旭, 等. 一种新的黄病毒导致蛋鸭产蛋下降及死亡[J]. 中国动物传染病学报, 2010, 18(6)∶1-4.
[4] 田丽红, 贾永清, 王君伟, 等. 鹅细小病毒主要结构蛋白VP3基因的克隆与序列分析[J]. 中国预防兽医学报,2002, 24(6)∶ 418-420.
[5] 程晓霞, 陈仕龙, 陈少莺, 等. 番鸭细小病毒和鹅细小病毒的抗原相关性研究[J]. 福建农业学报, 2013, 28(9)∶869-971.
[6] Lu Y S, Lin D F, Lee Y L, et al. Infectious bill atrophy syndrome caused by parvovirus in a co-outbreak with duck viral hepatitis in duckings in Taiwan [J]. Avian Dis,1993, 37(2)∶ 591-596.
[7] Palya V, Zolnai A, Benyeda Z, et al. Short beak and dwarfism syndrome of mule duck is caused by a distinct lineage of goose parvovirus[J]. Avian Pathol, 2009,38(2)∶ 175-180.
[8] 黄瑜,万春和, 傅秋玲, 等. 新型番鸭细小病毒的发现及其感染的临床表现[J]. 福建农业学报, 2015, 30(5)∶ 442-445.
[9] 陈少莺, 程晓霞, 陈仕龙, 等. 半番鸭新型小鹅瘟病毒病研究简报[J]. 福建农业科技, 2015, (7)∶ 23-25.
PRELIMINARY CHARACTERIZATION OF THE CAUSATIVE AGENT OF DUCK SHORT BEAK AND DWARFISM SYNDROME
LI Chuan-feng, LI Qi, CHEN Zong-yan, TANG Jing-yu, LIU Guang-qing
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
In the second half of 2014, a severe infectious disease temporarily called duck short beak and dwarfi sm syndrome (DSBDS)outbroke on the commercial broiler duck breeding farms in the eastern China. The aff ected ducks developed signifi cant growth retardation with short beaks, protruding and drooping tongues, locomotor dysfunction, paralysis, watery diarrhea and easily broken wings and legs. Post-mortem examinations showed hemorrhage in hearts, pancreases, lungs and thymuses. Histopathological changes were characterized by cellular degeneration, necrosis, congestion and hemorrhage in the hearts, pancreas, kidneys, lungs and livers. The genetic materials related to Goose parvoviruses (GPVs) were detected in tissues of the sick ducks in PCR, but no other viral nucleic acids were present. Phylogenetic analysis indicated that the nucleic acid sequence obtained was closely related with classical GPVs. Additionally, GPV specific antigen was detected in the sick ducks in immunohistochemistry. Therefore, the causative agent of DSBDS was preliminary determined as a GPV-related Novel duck parvovirus on the basis of clinical signs, lesions and histopathologic changes.
Duck short beak and dwarfi sm syndrome; Goose parvovirus; immunohistochemistry; PCR
S852.659.6
A
1674-6422(2015)06-0001-06
2015-11-16
上海市科委科技创新医药与农业领域项目(13391901602);国家自然科学基金(31502068、31270194);农业部公益性行业科研专项(201303046)
李传峰,男,博士,助理研究员,主要从事水禽病毒病分子生物学研究
刘光清,E-mail:liugq@shvri.ac.cn

