应用磁共振扩散加权成像早期评价淋巴瘤化疗疗效的研究
刘 岚 徐仁根 王索宇 周雪春 胡利平 孙 美 周锋江 谢 恒
本研究旨在探讨应用磁共振扩散加权成像(diffusion-weighted imaging,DWI)这一目前唯一能够在活体组织中检测水分子微观运动的技术早期评价淋巴瘤化疗疗效的可行性。
1 资料与方法
1.1 临床资料
收集2012年-2015年我院收治的淋巴瘤患者38例,其中男性26例,女性12例,年龄21~65岁,平均年龄43.5岁。入选病例同时符合以下条件:①经淋巴结穿刺或手术活检病理检查证实为淋巴瘤;②肿大的淋巴结形成实体瘤,单个结节直径大于10 mm;③准备接受淋巴瘤化疗。
1.2 检查方法
1.2.1 仪器 应用 GE Singa EXCITE 1.5T HD 高分辨磁共振成像仪。
1.2.2 MR扫描方法 每例患者分别于化疗前和化疗后第1、3、5、9、13、15 天及化疗结束时(约30 天),接受横轴位DWI序列扫描,DWI采用单次激发平面回波成像(echo planar imaging ,EPI)技术,TR 4000 ms,TE 60 ms,层厚6 mm,层间距1 mm,扩散敏感系数b值分别为0 s/mm2、800 s/mm2。同时在化疗前、化疗后第15天、化疗结束时三个时间段增加横轴位T1WI及T2WI扫描。线圈选择:中枢神经系统及颈部采用头颈联合线圈;腋窝及纵膈、腹部、盆腔及腹股沟采用8通道体部相控阵线圈(可加心电门控或呼吸门控)。
1.2.3 图像后处理及数据测量 所有DWI图像均在ADW4.3工作站上应用 Functool 4.5软件进行后处理,获得肿瘤的表观弥散系数值(apparent diffusion coefficient,ADC)图。在扫描范围内根据DWI图像确定淋巴瘤瘤灶,在多发肿大淋巴结中选取1个体积最大、病变最明显的淋巴结作为目标瘤灶,参考ADC伪彩图及常规MR图像,避开肿瘤坏死、钙化及出血区域,将大小约20 mm2的椭圆形感兴趣区(region of interest,ROI)放置于肿瘤每个层面,记录各监测时间点最小ADC值。同时通过横轴位T1WI及T2WI扫描测量三个时间点目标瘤灶最大直径(长径)。
1.3 疗效分组
按照国内统一实体瘤治疗疗效评价标准(response ebaluati criteria in solid tumors,RESIST),根据每例患者化疗前、化疗结束时(约30天)目标瘤灶最大直径(长径)变化情况,将肿瘤直径缩小>30%定义为化疗有效组,其他病例归为无效组。
1.4 统计学分析
应用SPSS 16.0软件进行统计,以独立样本t检验比较有效组和无效组化疗开始半个月内每次测得的ADC值的变化差异。
2 结果
38例淋巴瘤化疗后,有效组28例,无效组10例。两组化疗前、化疗后第15天、化疗结束时三个监测时间点的肿瘤平均最大直径比较显示,化疗后第15天38例患者肿瘤直径均无明显变化,化疗结束时有效组肿瘤平均直径小于化疗前,差异有统计学意义(表1)。

表1 有效组与无效组各监测点肿瘤平均最大直径的比较/mm
有效组肿瘤最小ADC值化疗后第1、3、5天与化疗前比较无明显变化,从第9天开始明显升高,而无效组肿瘤最小 ADC 值化疗后第 1、3、5、9、13、15 天各时间点均与化疗前比较无明显变化,两组肿瘤最小ADC值在化疗后第9、13、15天及化疗结束时比较差异有统计学意义(P<0.05)(表2)。
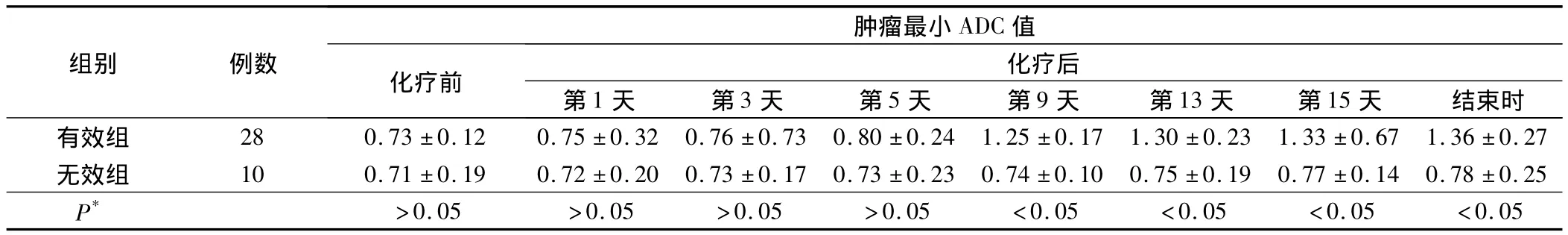
表2 有效组与无效组化疗前后各监测点肿瘤最小ADC值比较 /(×10-3mm2/s)
3 讨论
化疗药物在杀伤肿瘤细胞的同时对正常人体细胞也具有杀伤力,且相同的化疗方案作用于不同个体,预后也可能存在差异,因此早期评价淋巴瘤化疗疗效,有利于临床尽早发现对化疗不敏感的肿瘤,及时调整药物,制定个体化治疗方案。以往评价淋巴瘤疗效的常用方法是在化疗3~4个周期后(2个月至3个月左右)依据影像学(CT或MRI)检查测量肿瘤体积缩小的程度,从而评价化疗方案是否有效。本研究两组病例在化疗后早期第15天肿瘤最大径并无明显变化,在化疗后期才出现各组肿瘤最大径的变化,提示仅依靠肿瘤形态学变化来评价肿瘤早期化疗疗效并不敏感。
Guo等[1]研究表明DWI测得的ADC值与肿瘤细胞密度存在负相关,化疗药物会破坏肿瘤细胞膜的完整,使其ADC值上升 。Roth及Thoeny等[2-3]通过实验证明小鼠结肠癌及大鼠横纹肌肉瘤在化疗2天后ADC值即发生变化。北京肿瘤医院张晓鹏等[4]发现DWI可以反映直肠癌病理消退分级间的差异,放化疗反应性较好的直肠癌病例在治疗后第一周出现ADC值明显升高,但此时肿瘤体积下降不明显。DWI作为唯一能够在活体组织中监测水分子微观运动的技术,具有简单无创、无射线辐射、短期内可重复进行的独特优势,在评价肿瘤治疗效果中的作用已引起广泛关注[5]。本研究提示ADC值可以在化疗期间肿瘤体积并未缩小时早期对淋巴瘤化疗疗效做出评价。分析原因是有效的淋巴瘤化疗可导致肿瘤细胞膜完整性破坏、细胞溶解坏死、细胞密度降低、细胞外间隙增加,从而导致水分子弥散加快,ADC值升高;而无效组病例其肿瘤细胞凋亡和坏死程度均不明显,水分子弥散能力无明显增加,因此ADC值增加不显著,表明DWI对肿瘤化疗后微环境变化较为敏感,反映的功能学变化远早于常规形态学改变,可对肿瘤的治疗疗效做出早期的评价。这与国内外学者研究结果基本一致。
本研究表明有效组肿瘤ADC值在化疗后第9天开始较化疗前明显升高,第13天、第15天肿瘤ADC值继续升高,但与第9天ADC值差异无统计学意义,而无效组在相同各时间点均无明显改变,故我们认为选择第9天作为淋巴瘤化疗疗效早期监测的时间点是可行的,但由于我们收集病例数量相对较少,因此有必要在今后工作中继续收集病例得出更为客观的结论。
表观弥散系数值(apparent diffusion coefficient,ADC)是本研究DWI疗效评价的主要功能性指标,找到一种最能反映真实变化的ADC值测量方法是我们重点要解决的技术关键问题。国内外文献中有关ADC值的测量方法有多种,常用的主要有“平均ADC值测量法”和“最小ADC值测量法”。前者是沿癌灶边缘逐层手工绘制不规则兴趣区(region of interest,ROI),计算其平均ADC值;后者是将相同的小兴趣区(ROI)放置于癌灶每层ADC值最低处,记录其最小ADC值。北京大学第一医院武春雪、王宵英等[6]提出采用“最小ADC值”测量方法评估化疗疗效明显优于“平均ADC值法”。本研究考虑到在确定ROI时如果不能将肿瘤化疗前已经存在的坏死区排除在外将会影响ADC值评估肿瘤化疗反应的真实性,而采用“平均ADC值法”测量时难免会将坏死区包括在内,因此本研究对38例淋巴瘤采用了“最小ADC值测量法”,以保证测量结果的可靠性。
此外,有关于肺癌、宫颈癌[7]的研究表明治疗前ADC值可在一定程度上预测肿瘤疗效,治疗前ADC值低的肿瘤较ADC值高的肿瘤对放化疗更敏感。本研究结果显示28例化疗有效组和10例无效组肿瘤治疗前ADC差异并无统计学意义,治疗前ADC值与病变最大径缩小率无相关性。原因可能是其他恶性肿瘤治疗前ADC值高提示肿瘤内含有较多坏死组织,低氧量、低灌注的环境易导致肿瘤对化疗的敏感性下降,而淋巴瘤化疗前瘤灶内较少出现坏死,且淋巴瘤恶性程度主要与肿瘤细胞核大小及异形性有关,而与肿瘤细胞密度并不一定线性相关,其化疗疗效取决于肿瘤恶性程度、组织类型、化疗敏感度等多项因素的综合效应,因此笔者认为化疗前ADC值与淋巴瘤化疗疗效无肯定相关性,相应的病理学基础有待于进一步研究证实。
综上所述,淋巴瘤化疗后ADC值变化早于其形态学的改变,应用DWI技术监测肿瘤ADC值变化可作为早期评估淋巴瘤疗效的有效手段。
[1]Guo Y,Cai YQ,Cai ZL,et al.Differentiation of clinically benign and malignant breast lesions using diffrsion-weighted imaging.〔J〕.J Magn Reson Imaging,2002,161(2):172-178.
[2]Roth Y,Tichler T,Kostenich G,et al.High-b-value diffusionweighted MR imaging for pretreatment predietion and early monitoring of tumor response to therapy in mice〔J〕.Radiology,2004,232(3):685-692.
[3]Thoeny HC,De Keyzer F,Chen F,et al.Diffusion-weighted MR imaging in monitoring the effect of a vascular targeting agent on rhabdomyosarcoma in rat〔J〕.Radiology,2005:234(3):756-764.
[4]孙应实,张晓鹏,等.磁共振扩散成像与直肠癌术前放化疗病理反应性的对照研究〔J〕.中国肿瘤影像学,2010,16(8):58-63.
[5]张晓鹏.从实体瘤疗效评价标准发展看肿瘤影像学的任务与挑战〔J〕.中华放射学杂志,2010,44(4):341-342.
[6]武春雪,王霄英,等.磁共振扩散加权成像表观扩散系数对局部进展期乳腺癌新辅助化疗的评估〔J〕.中国医学影像技术,2009,25(11):2036-2039.
[7]刘 颖,白人驹,孙浩然.扩散加权成像预测、监测宫颈癌放化疗效果〔J〕.中国医学影像技术,2009,25(7):1269-1272.

