原发性肝癌肿瘤溶解综合征的病因及治疗进展
张玉盼,张雅敏(.天津医科大学一中心临床学院,天津 300070;.天津市第一中心医院器官移植中心,天津 3009)
肿瘤溶解综合征(TLS)是肿瘤细胞快速溶解后细胞内容物及其代谢产物迅速释放入血,引起一系列以高尿酸、高钾、高磷、低钙血症、急性肾功能不全为特征的并发症。TLS被认为主要为血液系统恶性肿瘤的并发症,近年来有关固体肿瘤TLS的病历报告逐渐增多,例如肝癌、肺癌、胃癌等。固体器官肿瘤治疗过程中,急性TLS是极罕见的并发症,因为通常认为这些器官的癌细胞对抗肿瘤治疗不敏感[1],但是固体器官急性TLS病死率高于血液系统恶性肿瘤,其原因之一是对固体器官TLS的认识不足[2]。有关原发性肝癌的TLS发病率是未知的,数据也仅限于有限的病历报道。本研究主要介绍原发性肝癌的TLS的病因及治疗。
1 病理生理
TLS发生时,肿瘤细胞裂解后使细胞内成分大量释放入血,当超出人体正常代谢能力,可影响内环境的平衡,造成高尿酸血症、 高钾血症、高磷血症、低钙血症[3]。死亡的肿瘤细胞释放大量的钾离子入血造成高钾血症,严重者可致心律失常和猝死[3]。高磷血症主要是由细胞破裂磷溢出入血引起,而循环中游离的磷酸盐和钙离子结合造成低钙血症,并引起神经肌肉兴奋性异常,严重时可引起手足搐搦症甚至癫痫发作,游离磷酸盐和钙离子大量结合也可导致磷酸钙沉淀晶体,并导致肾小管阻塞,肾钙质沉着。高尿酸血症多为肿瘤细胞溶解后释放的大量核酸代谢造成,在磷酸钙的存在下尿酸更容易析出,在尿酸的存在下钙和磷酸盐也更易析出,尿酸盐沉积在关节内可引起痛风;尿酸盐沉积在肾小管和集合管内,导致梗阻性肾病及氮质血症[3-4]。尿酸可导致急性肾损伤不仅因为结晶本身,也包括晶体独立的机制,如引起肾血管收缩、调节功能受损、肾血流量减少、氧化和炎症反应。肿瘤细胞溶解释放细胞因子,引起全身炎症反应综合征(SIRS)和多器官功能衰竭[3]。
2 危险因素
表1列出了自1998年以来报道的有关原发性肝癌的TLS的病例报告汇总。从中可以看出原发性肝癌的TLS多数发生在肝动脉化疗栓塞(TACE)术后,其次为射频消融(RFA)术及口服抗癌药物后,其中还有3例为自发性TLS[5-6]。值得关注的是,自发性TLS就是在无任何抗肿瘤治疗措施的情况下发生TLS,与其他TLS有相同的危险因素及预防措施。
危险因素:① 和肿瘤自身有关,包括肿瘤的大小、增殖能力及对肿瘤治疗的敏感性;② 和患者的基础情况有关,例如脱水、肾功能不全使清除细胞内代谢物更加困难,从而增加了TLS发生的风险[7-8]。
根据患者的实验室指标、肿瘤大小、对抗肿瘤药物的敏感性及肾功能不全、少尿、脱水或低血压、肾毒性暴露情况,可分为低、中、高3个危险等级:
2.1 低风险:以测定血清钾,磷,钙,肌酐,尿酸和尿量中有1项或无指标超过正常范围为前提。① 肿瘤中等大小,发生溶解的可能中等或未知,且不伴肾功能不全、脱水、酸中毒、低血压及肾毒性暴露;② 肿瘤体积较大,但细胞溶解风险较低。
2.2 中等风险:① 肿瘤中等大小,发生溶解的可能中等或未知,且伴肾功能不全、脱水、酸中毒、低血压及肾毒性暴露;② 肿瘤体积较大,细胞溶解风险中等或未知。
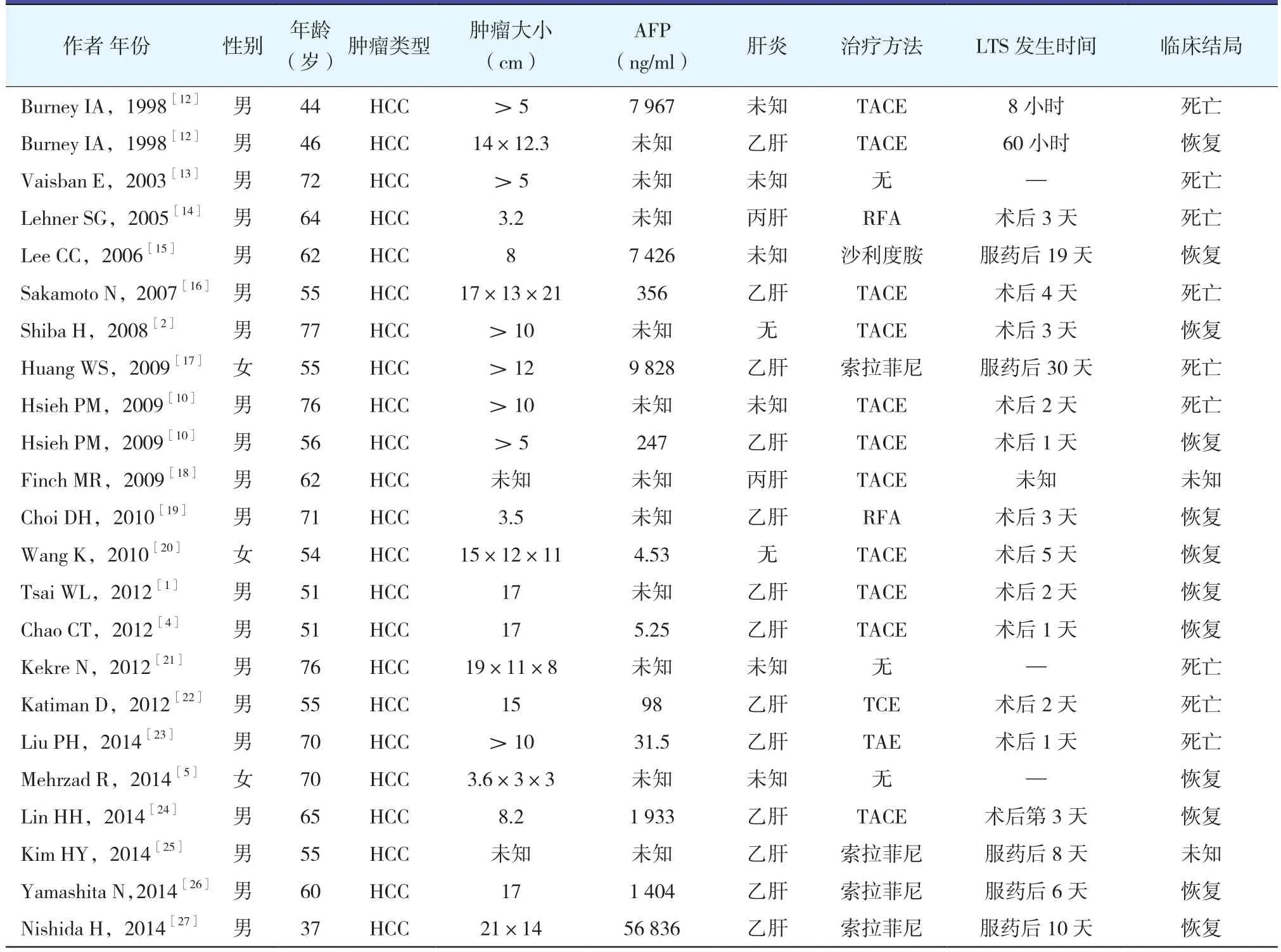
表1 1998年以来HCC TLS统计
2.3 高风险:① 肿瘤中等大小或较大,发生溶解的可能性高;② 血清钾,磷,钙,肌酐,尿酸和尿量中两项以上指标异常,但无临床症状[9]。
另外据报道,造影剂有导致肿瘤大量坏死或实质损害和肾毒性的可能。实体肿瘤和血液肿瘤治疗后发生TLS的时间及预后是不同的。前者往往发生在治疗后的几天内,而不是在几小时后[6]。
3 诊断标准
常用的是Cairo-Bishop临床诊断标准,其包括一个临床症状加两个实验室标准(见表2)[9]。
4 治 疗
水化、纠正代谢异常并积极治疗肾功能衰竭是治疗TLS的3项基本原则[10]。水化是预防TLS的关键,积极水化可迅速改善肾灌注和肾小球滤过减少性酸中毒。可使用袢利尿剂保持足够的尿量。别嘌呤醇是预防TLS的基础,主要用于预防尿酸的形成[9]。拉布立酶是第一个重组尿酸分解剂,它通过消除现有的尿酸迅速降低尿酸水平,防止黄嘌呤累积。在对TLS的预防的随机对照试验中已被证明比嘌呤醇更有效,而且也被认为TLS治疗有效;但应当指出的是,葡萄糖-6-磷酸脱氢酶(G6PD)缺乏者,使用拉布立酶后有溶血风险[9]。
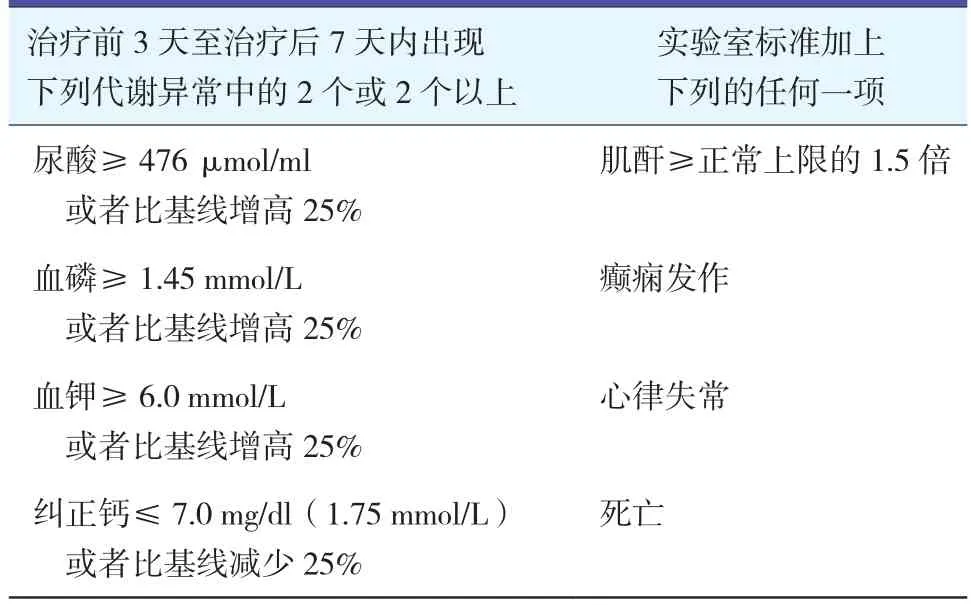
表2 Cairo-Bishop临床诊断标准
早期有建议使用碳酸氢钠碱化尿液,因为它可通过抑制将黄嘌呤转换为次黄嘌呤的酶(氧化酶)的活性降低尿酸的含量,但抑制氧化酶的活性可导致黄嘌呤和次黄嘌呤水平增加,因此碱化时两个黄嘌呤结晶磷酸钙沉淀及发生代谢性碱中毒的风险均增加,且抑制磷酸钙的溶解度,所以现已经不推荐使用碳酸氢钠预防TLS,相比之下增加尿流率是一个更好的选择[7,9]。
当药物纠正钾、磷、尿酸失败,或者肾功能不全伴少尿,水分过多或尿毒症时,及时应用血液净化治疗如血液透析(HD)连续血液滤过治疗(CHF)或持续的血液透析滤过(CHDF)[9]。连续性静脉-静脉血液透析滤过更有效地降低磷酸[3]。如果存在梗阻性肾病进展为急性肾功能衰竭应积极进行血液透析。
原发性肝癌治疗过程中,急性TLS是极罕见的并发症,因为通常认为肝癌细胞对抗肿瘤治疗不敏感。但是固体器官急性TLS病死率高于血液恶性肿瘤,其原因之一是对固体TLS的认识不足,故预防是治疗TLS的关键,对于低风险患者,坚持每天水化,使用别嘌呤醇预防肾损伤,每天检测肾功能及电解质变化;对于中度风险患者,坚持每天水化,使用别嘌呤醇或布拉立酶预防肾损伤,建议住院观察,每8~12小时检测肾功能及电解质变化;对于高风险患者,坚持每天水化,使用拉布立酶预防肾损伤,检测心脏功能,每8~12小时检测肾功能及电解质变化[3,9]。
5 结 论
TLS主要发生于血液系统恶性肿瘤的患者,但近年来原发性肝癌发生TLS的病例报道逐渐增多,原发性肝癌TLS主要发生于抗肿瘤治疗后,包括肝动脉化疗栓塞(TACE)、射频消融(RFA)、口服化疗药物后甚至少数报道有自发性TLS,其危险因素主要包括肿瘤的大小、增殖能力及对抗肿瘤治疗的敏感性及患者的基础情况。目前TLS的诊断标准主要为Cairo-Bishop临床诊断标准。TLS的病死率较高,其治疗原则主要为水化、纠正代谢异常并积极治疗肾功能衰竭,其重点为预防性治疗,可根据患者危险因素暴露情况分为低中高3个危险等级,根据不同危险等级给予不同的预防/治疗措施。

