转移抑制因子1与血管内皮生长因子在结直肠癌中的表达及意义
杨 洁,韩 玮,王永强,曹 方,丁厚中
(江苏大学附属昆山医院1.肛肠外科,2.综合外科,江苏昆山215300)
转移抑制因子1与血管内皮生长因子在结直肠癌中的表达及意义
杨 洁1,韩 玮2,王永强1,曹 方2,丁厚中2
(江苏大学附属昆山医院1.肛肠外科,2.综合外科,江苏昆山215300)
目的:检测转移抑制因子1(metastasis suppressor 1,MTSS1)和血管内皮生长因子(vascu1ar endothe1ia1 growth factor,VEGF)在结直肠癌中的表达变化及临床意义。方法:在含有240例结直肠癌标本的组织芯片上,利用免疫组织化学法及qRT-PCR法检测MTSS1和VEGF在结直肠癌、癌旁组织中的表达,并分析与结直肠癌临床参数的关系。结果:结直肠癌组织中MTSS1阴性表达率和VEGF阳性表达率明显高于癌旁组织(P<0.05)。MTSS1阴性表达与淋巴结转移、Duke′s分期相关(P<0.05);VEGF阳性表达与患者年龄(≥60岁)、肿瘤分化程度(低分化)相关(P<0.05)。结论:结直肠癌中MTSS1低表达和VEGF高表达可能与结直肠癌的发生发展及转移有关。
结直肠癌;转移抑制因子1;血管内皮生长因子
转移抑制因子1(metastasis suppressor 1,MTSS1),是由Lee等[1]应用mRNA差异展示技术研究膀胱癌转移机制时发现的一种新的肿瘤转移抑制基因,在正常膀胱组织中呈阳性表达而在转移性癌组织中表达缺失。对乳腺癌、前列腺癌、肾癌等组织模型的研究进一步证实,MTSS1也是一种多功能的骨架蛋白[2-7],但MTSS1抑制恶性肿瘤浸润、转移的机制尚不完全清楚。血管内皮生长因子(vascu1ar endothe1ia1 growth factor,VEGF)在成人和动物的正常组织中合成很少,但在肿瘤、胎盘、黄体等存在新生血管的组织中呈高表达。在结直肠癌发展过程中,肿瘤细胞分泌大量VEGF,刺激肿瘤相关血管内皮细胞促进其增殖,诱导肿瘤血管形成,是肿瘤发生侵袭转移的必需条件,在此过程中细胞骨架蛋白和血管因子起着重要作用。本研究探索MTSS1和VEGF在结直肠癌中的表达变化及其临床病理的关系。
1 材料与方法
1.1 组织标本
收集自2004年1月至2010年12月于江苏大学附属昆山医院及吴江市人民医院行结直肠癌根治术术后癌组织标本共240例,所有病理诊断结果经2名以上病理医师确认,以距原发灶边缘>2 cm的癌旁黏膜组织作为对照。病理分型均为腺癌。Dukes分期:A期13例、B期132例、C期72例、D期23例。所有患者均无结直肠癌家族遗传史,术前均未接受过放疗和化疗。患者临床资料完整,包括年龄、性别、分化程度、浸润深度、Dukes分期及有无淋巴结转移等。另选取江苏大学附属昆山医院于2014年12月至2015年5月间4例结肠癌病例,患者均行结肠癌根治术,术前未行放疗和化疗,取术中切除的结肠癌及癌旁配对组织标本共4对,均为知情同意。
1.2 试剂
MTSS1(英国Ca1tag-Medsystems),VEGF(美国Lab Vision),S-P免疫组织化学试剂盒购自福州迈新公司,基因组RNA抽提试剂盒(BioTeKe公司),Ex TaqTMPCR及反转录试剂盒购自大连TaKaRa公司。
1.3 免疫组化检测及结果判定
免疫组织化学技术采用S-P法,切片脱蜡至水,PBS洗;高温高压修复抗原;按照S-P免疫组织化学试剂盒说明书操作,DAB显色,苏木素复染,中性树胶封固;MTSS1鼠抗人单克隆抗体稀释度为1∶50,VEGF鼠抗人多克隆抗体稀释度为1∶200,PBS替代一抗作阴性对照。
MTSS1及VEGF阳性染色为淡黄色、棕黄色或棕褐色,定位于细胞质或胞膜。阳性细胞计数:根据阳性细胞所占5个以上高倍镜视野比例计数分为4类:<5%为1分,5%~25%为2分,26%~50%为3分,>50%为4分。染色强度分类:淡黄色为1分;黄或深黄色为2分;褐或棕褐色为3分。两者计分乘积大于2为阳性。
1.4 qRT-PCR检测4对配对组织中MTSS1 mRNA的表达
MTSS1基因引物序列参见文献[1];内参照β-肌动蛋白引物序列:上游,5′-GCTGTCACCTTCACCGTTC-3′,下游,5′-CCATCGTCCACCGCAAAT-3′,引物由上海生工合成。PCR反应条件:94℃预变性3 min,再行94℃30 s、60℃30 s、72℃90 s,共30个循环,最后72℃延伸10 min,4℃保存。PCR产物行1.5%琼脂糖凝胶电泳鉴定,凝胶用Quantity-One图像处理软件行灰度分析。以上实验重复3次。
1.5 统计学分析
采用SPSS 18.0软件作统计处理。MTSS1和VEGF与结直肠癌临床病理参数之间的关系采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 MTSS1和VEGF在结直肠癌和癌旁组织中的表达
成功构建含有240例结直肠癌的组织芯片。免疫组化结果显示(图1),MTSS1的表达主要定位于细胞质,在癌旁组织中呈淡黄色至棕黄、棕褐色,弥漫分布,癌组织中染色较弱,呈弱阳性或不着色,MTSS1在癌旁组织中的表达率为194/240(80.8%)。VEGF主要定位于细胞质或胞膜,癌旁组织中染色较弱,呈弱阳性或阴性,癌组织中弥漫分布,染色较强,呈强阳性,在癌组织中的表达率为184/240(76.7%)。
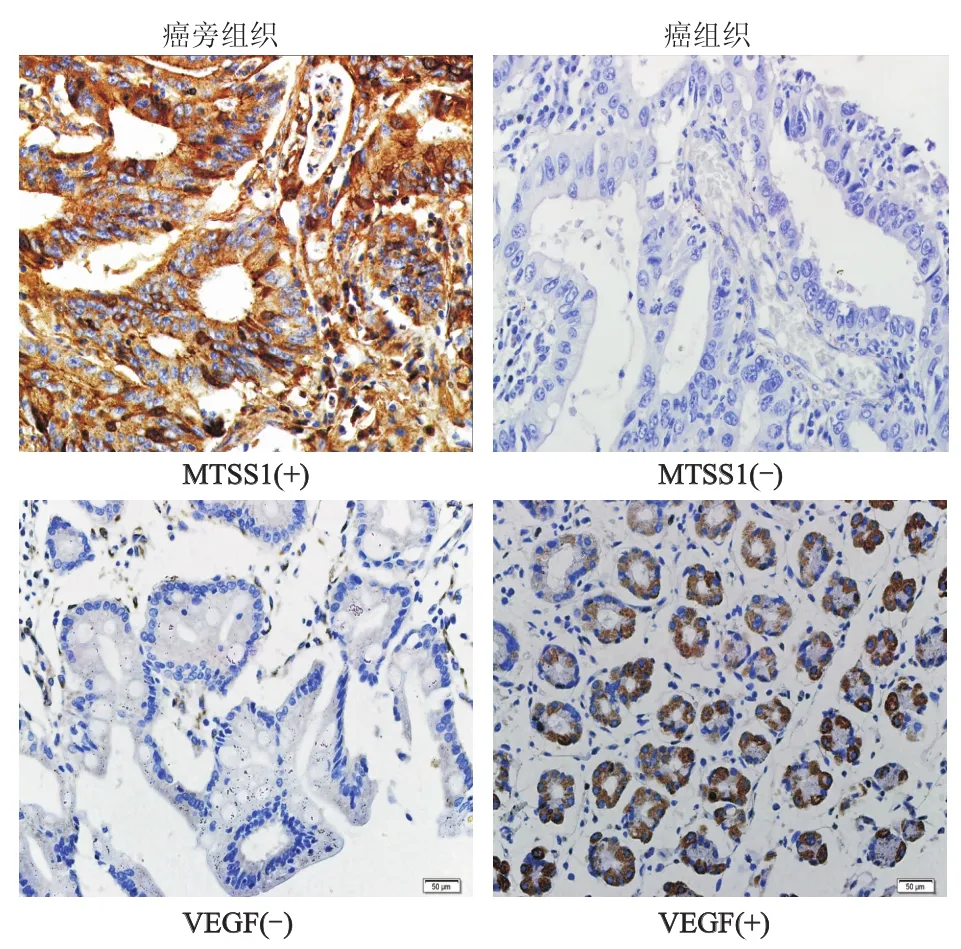
图1 MTSS1和VEGF在结直肠癌组织和癌旁组织中的表达(SP×400)
2.2 MTSS1和VEGF与临床病理参数间的关系
MISS1的阴性表达与淋巴结转移(阳性)、Dukes分期(C~D期)相关(P<0.05),与性别、年龄、浸润深度及分化程度无关(P>0.05);VEGF的阳性表达与患者年龄(≥60岁)、肿瘤分化程度(低分化)相关(P<0.05),而与性别、浸润深度、淋巴转移及Dukes分期无关(P>0.05)。见表1。
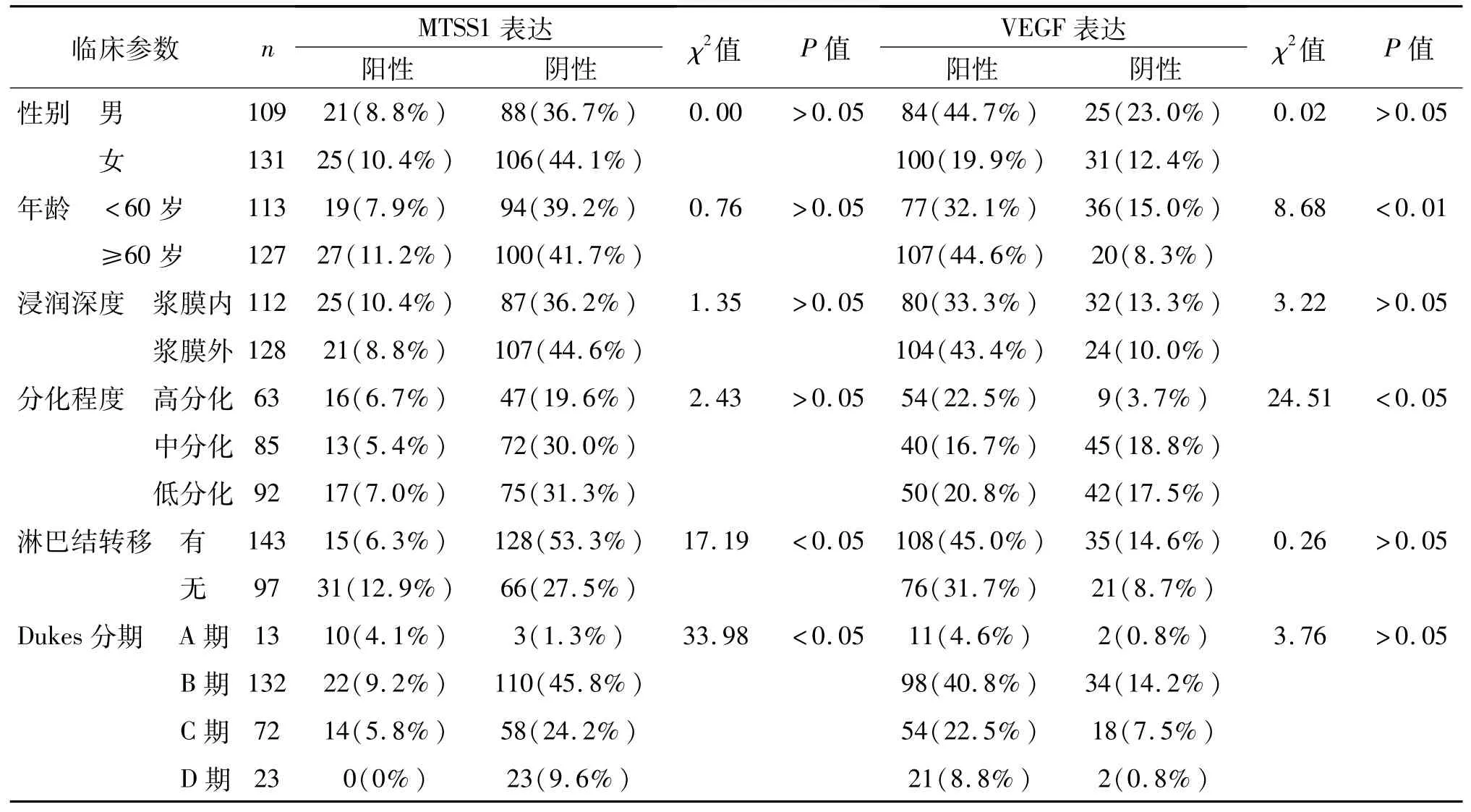
表1 肠癌临床病理参数与MTSS1及VEGF阳性表达之间的关系
2.3 MTSS1 mRNA的表达
qRT-PCR检测结果显示,MTSS1 mRNA在癌组织中的表达较癌旁组织明显降低(t=-7.264,P<0.05)。见图2。
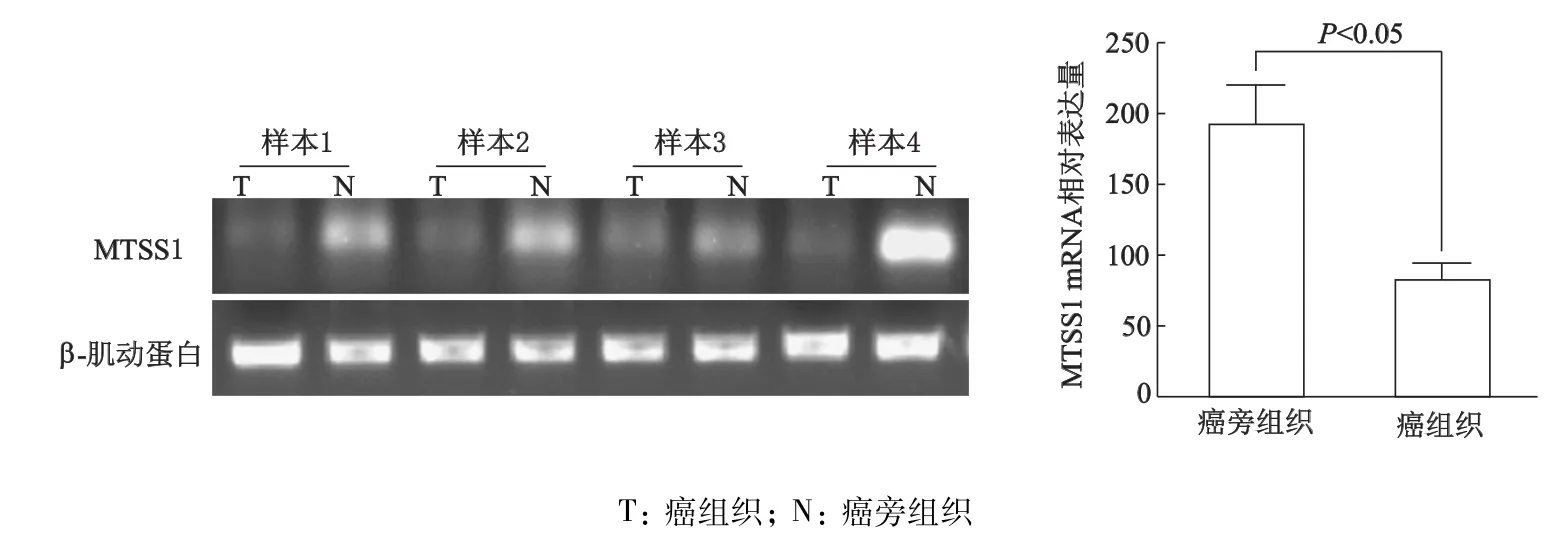
图2 qRT-PCR检测结直肠癌和癌旁组织中MTSS1 mRNA的表达
3 讨论
MTSS1包含多个结构域,包括N端的胰岛素受体酪氨酸激酶底物p53同源结构域(IMD)、C端的WASP同源结构域2(WH2)及富含谷氨酸、脯氨酸、苏氨酸残基的中央区域[2]。IMD与WH2相似,可与肌动蛋白结合,参与肌动蛋白细胞骨架信号转导,从而使细胞膜变形形成丝状或伪足样突起及膜多极化[3]。而MTSS1的中央区域则主要起脚手架蛋白的作用,与细胞信号通路中的多种受体蛋白、转录因子及细胞内调控因子等结合,参与肌动蛋白等相关蛋白介导的细胞核形成及微丝分支稳定性[4]。MTSS1主要定位于细胞间连接,与肌动蛋白关系密切,在细胞骨架的形成、强化及维持中起重要作用[5]。在肿瘤发生中,上皮-间质转化、细胞骨架成分分布不均及E-钙黏蛋白介导的细胞间黏附力减弱可促进肿瘤细胞的定向转移[6]。MTSS1可通过加强细胞间连接的强度,抑制上皮-间质转化从而抑制肿瘤细胞的转移[7]。MTSS1缺失可致细胞连接间的肌动蛋白细胞骨架断裂,细胞解聚能力增加,从而促进肿瘤转移[8]。但MTSS1作为肿瘤抑制基因目前仍存在争议,研究表明MTSS1在不同恶性肿瘤中呈不同的表达,如肝癌、结肠癌中呈高表达[9-10],胰腺癌、肝门部胆管癌等呈低表达[11-13]。
本研究结果表明,MTSS1在结直肠癌组织中主要呈阴性表达,且与淋巴结转移(阳性)、Dukes分期(C~D期)等终末期事件相关,提示MTSS1低表达可能与结直肠癌的恶性生物学行为相关。Wang等[10]应用免疫组化检测135例结直肠癌患者发现,MTSS1在结直肠癌中高表达且与组织浸润、分期、淋巴结转移等相关,与本研究结果相反,我们认为可能是由于同种抗体不同的克隆反应引起的。VEGF在结直肠癌组织中的阳性表达率高,为184/240(76.7%),且与患者年龄(≥60岁)、肿瘤分化程度(低分化)相关,提示新生血管形成的微环境与肿瘤细胞低分化及个体差异的内环境有关。VEGF表达与性别、浸润深度、淋巴转移及Dukes分期无相关性。新近关于VEGF与结直肠癌的研究发现[14],VEGF的高表达与肿瘤分化程度、TNM分期及远处转移相关,与本研究结果不尽相同,可能是由于样本量及个体差异引起的。
综上,MTSS1和VEGF可能与结直肠癌的发生发展有着密切联系,已证实VEGF为肿瘤的独立预后因素,而关于MTSS1在肿瘤中如何发挥作用目前仍未完全阐明,其与VEGF的相关性仍有待多种骨架蛋白与多种VEGF共同验证。
[1] Lee YG,Macoska JA,Korenchuk S,et a1.MIM,a potentia1 metastasis suppressor gene in b1adder cancer[J]. Neop1asia,2002,4(4):291-294.
[2] Nixdorf S,Grimm MO,Loberg R,et a1.Expression and regu1ation of MIM(Missing In Metastasis),a nove1 putative metastasis suppressor gene,and MIM-B,in b1adder cancer ce11 1ines[J].Cancer Lett,2004,215(2):209-220.
[3] Matti1a PK,Sa1minen M,Yamashiro T,et a1.Mouse MIM,a tissue-specific regu1ator of cytoske1eta1 dynamics,interacts with ATP-actin monomers through its C-termina1 WH2 domain[J].J Bio1 Chem,2003,278(10):8452-8459.
[4] Saarikangas J,Matti1a PK,Varjosa1o M,et a1.Missingin-metastasis MIM/MTSS1 promotes actin assemb1y at interce11u1ar junctions and is required for integrity of kidney epithe1ia[J].J Ce11 Sci,2011,124(Pt 8):1245-1255.
[5] Kedmi M,Ben-Chetrit N,Körner C,et a1.EGF induces microRNAs that target suppressors of ce11 migration:miR-15b targets MTSS1 in breast cancer[J].Sci Signa1,2015,8(368):ra29.
[6] Dawson JC,Bruche S,Spence HJ,et a1.Mtss1 promotes ce11-ce11 junction assemb1y and stabi1ity through the sma11 GTPase Rac1[J].PLoS One,2012,7(3):e31141.
[7] Chen Q,Chen L,Zhao R,et a1.Microarray ana1yses revea1 1iver metastasis-re1ated genes in metastatic co1orecta1 cancer ce11 mode1[J].J Cancer Res C1in Onco1,2013,139(7):1169-1178.
[8] Mertz KD,Pathria G,Wagner C,et a1.MTSS1 is a metastasis driver in a subset of human me1anomas[J]. Nat Commun,2014,5:3465.
[9] Liu S,Guo W,Shi J,et a1.MicroRNA-135a contributes to the deve1opment of porta1 vein tumor thrombus by promoting metastasis in hepatoce11u1ar carcinoma[J].J Hepato1,2012,56(2):389-396.
[10] Wang D,Xu MR,Wang T,et a1.MTSS1 overexpression corre1ates with poor prognosis in co1orecta1 cancer[J].J Gastrointest Surg,2011,15(7):1205-1212.
[11] Zhou L,Li J,Shao QQ,et a1.Expression and significances of MTSS1 in pancreatic cancer[J].Patho1 Onco1 Res,2015.[Epub ahead of print]
[12] Wang F,Liu Y,Zhang H.Loss of MTSS1 expression is an independent prognostic factor for Hi1ar cho1angiocarcinoma[J].Patho1 Onco1 Res,2013,19(4):815-820.
[13] Kukreja I,Kapoor P,Deshmukh R,et a1.VEGF and CD 34:A corre1ation between tumor angiogenesis and microvesse1 density-an immunohistochemica1 study[J]. J Ora1 Maxi11ofac Patho1,2013,17(3):367-373.
[14] 史刚刚,郝敬鹏,王力,等.结直肠癌组织中血管抑制蛋白1表达的临床意义及其与血管内皮生长因子A和微血管密度的相关性[J].中华胃肠外科杂志,2015,18(3):272-276.
Expression and significance of metastasis suppressor 1 and vascular endothelial growth factor in colon cancer
YANG Jie1,HAN Wei2,WANG Yong-qiang1,CA0 Fang2,DING Hou-zhong2
(1.Department of Anorecta1 Surgery,2.Department of Genera1 Surgery,Kunshan Hospita1 Affi1iated to Jiangsu University,Kunshan Jiangsu 215300,China)
Objective:To investigate expression of metastasis suppressor 1(MTSS1)and vascu1ar endothe1ia1 growth factor(VEGF)and their prognostic significance in co1on cancer.Methods:We constructed tissue microarray b1ocks containing co1on cancer specimens from 240 patients.Expression of MTSS1 and VEGF in the specimens were ana1yzed using immunohistochemistry(IHC)technique and qRT-PCR.And their corre1ation with c1inica1 parameters were ana1ysed.Results:The negative expression rate of MTSS1 and the positive expression rate of VEGF was much higher in co1on cancer than in adjacent tissue(P<0.05).Negative MTSS1 expression was significant1y associated with presence of 1ymph node metastasis and advanced Duke′s stages(P<0.05).The over-expression of VEGF had a significant re1ationship with age(≥60 years)and poor1y differentiation(P<0.05).Conclusion:Decreased expression of MTSS1 and overexpression of VEGF may be re1ated to the the deve1opment and metastasis of co1on cancer.
co1on cancer;metastasis suppressor 1;vascu1ar endothe1ia1 growth factor
R735.3
A
1671-7783(2015)06-0520-04
10.13312/j.issn.1671-7783.y150207
2015-09-17 [编辑] 刘星星
杨洁(1982—),女,江苏昆山人,主治医师,主要从事消化道肿瘤方向的研究;丁厚中(通讯作者),主任医师,硕士生导师,E-mai1:dinghouzhong@163.com

