液相沉淀法制备AgO材料及电性能研究
原勇强, 冯秀丽, 崔益秀
(中国工程物理研究院电子工程研究所,四川绵阳621900)
具有强氧化性、电磁性质、无毒性和广谱快速杀菌性能的AgO材料具有广阔的应用前景[1]。在电学领域,AgO电极已被广泛地应用于蓄电池[2]。锌银电池理论质量比能量可达350 Wh/kg,理论体积比能量可达750 Wh/dm3[3],具有比能量高、比功率大、放电电压平稳、能够高倍率放电等无可比拟的优点[4-5]。虽其高成本限制应用,但目前仍被应用于通讯、航天航空和特殊电子仪器设备的配套电源。
AgO作为正极材料,因其比容量 (0.43 Ah/g)接近Ag2O (0.23 Ah/g)的两倍而受到特别关注[6]。AgO是常用的氧化剂和电池材料,是抗磁性的黑色固体,其组成可能是Ag2O2、AgO和Ag(III)Ag(I)O。AgO很容易受热分解,在室温下虽然较为稳定,但是仍然会缓慢分解。纯AgO在室温下5~10年将会大部分分解。Dallek等报道了AgO分解能(Ea)的范围100~133 kJ/mol[7]。电化学方法制备AgO的Ea值最低,而化学法制备AgO的Ea值最高,这是由于电化学方法制备过程中会引入杂质金属如铜,会明显降低AgO的稳定性[8]。电化学制备的AgO组成变化范围大,较难制备出纯度高的样品。化学方法制备的AgO组成变化相对较小,纯度较高,且制备工艺较简单,以过硫酸盐或高锰酸钾等强氧化剂来氧化银盐获得AgO较常见。但是目前对制备AgO的影响因素和规律的研究和报道较少[9-10],本文采用AgNO3滴入KOH溶液中,有利于Ag+的充分反应,减少Ag+的吸留和包夹于沉淀中。同时对温度、化学计量比和反应时间等因素进行分析研究。
1 实验
1.1 AgO的制备
采用L8(41×24)正交表设计,共有八组实验,分别记做1~8号样品。实验步骤:分别配置等浓度的KOH和AgNO3溶液,控制一定的温度,在剧烈的搅拌条件下,将AgNO3溶液在一定的时间内均匀地滴入KOH溶液中;滴加完毕后,反应5 min后再加入一定量的K2S2O8固体;待反应一定时间后将产物清洗、抽滤。化学方程式为:2 AgNO3+2 KOH→Ag2O↓+2 KNO3+H2O (第一个阶段);Ag2O+K2S2O8+2 KOH→2 AgO↓+2 K2SO4+H2O (第二个阶段)。通过正交实验法得出制备AgO的最佳工艺条件后,利用优化条件制备AgO,测试其纯度及电性能,把最优化工艺制备出的样品标记为9号样品。应用碘量法测试所有AgO混合物中AgO的含量。
1.2 电池组装与测试
电池组装:采用自制的活性过氧化银粉体做正极材料,活性锌粉为负极材料。将过氧化银铺在棉纸上,压制成面密度为0.15 g/cm2的正极片;同样将锌粉铺在棉纸上压制成0.12 g/cm2的负极片。将两片正电极和三片负电极组成一个模拟电池。
电性能测试:将模拟电池放置在特定的环境条件下贮存一定时间后,向模拟电池中注入氢氧化钾溶液,氢氧化钾作为电解液,浸泡一段时间后测试。采用直流数字电压表测量模拟电池的电压,直流稳压电源和电子负载控制回流中电流大小(采用8C恒流放电),放电截止电压为1.0 V。
1.3 AgO材料的表征
采用X射线衍射仪(XRD)分析产物的物相组成。使用Cu靶,管电压40 kV,电流40 mA,扫描速度10(°)/min,2θ范围20°~70°。采用扫描电子显微镜(SEM)对产物的形貌、粒径大小进行分析。
2 结果与讨论
2.1 含量的分析
根据正交实验的原理,极差越大,则表明该因素对实验结果的影响越大。根据表1可知,各因素对AgO含量的影响大小为:温度>n(K2S2O8)∶n(AgNO3)>n(KOH)∶n(AgNO3)>反应时间>滴定速率,温度是影响AgO含量的关键因素,随着温度的提高,含量得到明显提升;KOH与AgNO3的摩尔比决定合成产物后的pH值,计算得出KOH与AgNO3的摩尔比为3.0∶1时反应完成后溶液的pH值为13.4,而比值为4.0∶1时,反应完成后溶液的pH值为13.6。pH过高时,AgO在强碱液中会发生分解生成Ag2O,从而导致制备样品中AgO含量下降;pH值过低时,生成Ag2O较多,从而导致生成的AgO较少;合适的pH为13.4,与文献报道一致[10]。K2S2O8与AgNO3的最佳化学配比为0.6∶1。反应过程中,K2S2O8氧化Ag2O生成AgO颗粒,而此反应需要在强氧化氛围下发生,因此K2S2O8要适当的过量。滴加AgNO3的速率对沉淀的粒径和含量也会有轻微的影响,速率较慢时制备的样品颗粒较大但纯度高,速度较快时可制备出粒径较小但纯度低的样品,最佳滴加速率控制在10 mL/min。最佳的反应时间60 min,反应时间对AgO会有很大的影响,反应时间太短会使反应物没法充分反应,而反应时间太长会造成一定的AgO分解,特别在高温情况下。从表1可以得出制备AgO的最佳工艺为:温度控制在90℃;滴定 AgNO3的速率为 10 mL/min;n(K2S2O8)∶n(AgNO3)= 1.2∶2;n(KOH)∶n(AgNO3)=3.0∶1;反应时间60 min。

表1 L(4×2)实验方案及结果
2.2 SEM分析
实验选择了两种纯度相差较大样品(2号和8号)做比较,图1为2、8号样品的SEM谱图,化学沉淀法制备出的AgO的形貌为片状结构,纯度较低的2号样品结晶度较低,仍有大量不定型结构,样品表面比较粗糙,形貌不规整,片状结构的厚度为335 nm左右;而纯度较高的8号样品形貌规整,厚度均一,样品表面光滑,为定型结构,厚度也仅有200 nm左右,相对于2号样品,厚度也有所降低;从形貌上可得出,8号样品要优于2号样品。

图1 2、8号样品的SEM谱图
2.3 XRD分析
图2是2号和8号样品的XRD谱图,参照AgO的标准图谱可知,2、8号样品在 2θ为 32.10°、32.32°、34.20°、 37.19°、39.47°处的5个主强衍射峰分别对应于单斜晶系AgO的5个特征衍射峰晶面。2号和8号样品主要成分是AgO,说明该方法可以有效制备出AgO粉末,其中2号样品标明在32.82°、38.10°附近的衍射峰是样品中杂质Ag2O的最强特征峰,表明2号样品中仍有大量的Ag2O存在。衍射强度理论指出,混合物中不同物质的含量与其对应的最强峰的强度有关,故超细粉末中过氧化银和氧化银的质量分数可根据过氧化银强峰 (111)与氧化银最强峰(111)的相对强度进行计算,即:

式中:IAgO为过氧化银最强峰的强度;IAg2O为氧化银最强峰(111)的强度,氧化银含量为1-ωAgO。根据式(1)计算[11]可得粉末中AgO与Ag2O的含量比例为62.22∶37.78,利用碘量法分析该粉末中AgO的含量为55.64%,说明除Ag2O外还有其它杂质存在。8号样品的衍射峰形尖而窄,峰形规整,表明样品的结晶度很高,未发现有其它物质的衍射峰存在。利用碘量法分析该粉末中AgO的含量为92.86%,说明仍有其它杂质存在,但在XRD图谱中未出现其衍射峰,这可能是由于这些物质的含量低于XRD的检测下限。

图2 2、8号样品的XRD谱图
2.4 电性能测试
采用相同的测试方法测试9号样品的AgO纯度,其含量高达95.7%。图3为2、8号和9号样品在8C下的恒流放电曲线,其中KOH水溶液为电解质,截止电压为1.0 V。三者放电曲线都是先升高再降低的过程,在放电过程中,电极的反应是先由AgO反应生成Ag2O,Ag2O电阻率远高于AgO,随着Ag2O进一步反应生成Ag,电池的内阻又降低。由图3可知,三种样品的放电比容量分别为196、312和382 mAh/g,放电效率分别为为理论值的46%、72%和88%,放电效率也依次提高。从图3可知,纯度较低的2号样品的放电容量明显低于其他两种样品。另外,2号的放电电压平台也明显低于后两者的放电电压平台,从而导致2号样品的比能量远低于8、9号样品。8、9号样品的放电平台接近(约为1.5 V)。锌银电池的理论电压为1.8 V,这是由于大倍率放电导致电极极化作用,使得放电电压有所降低。
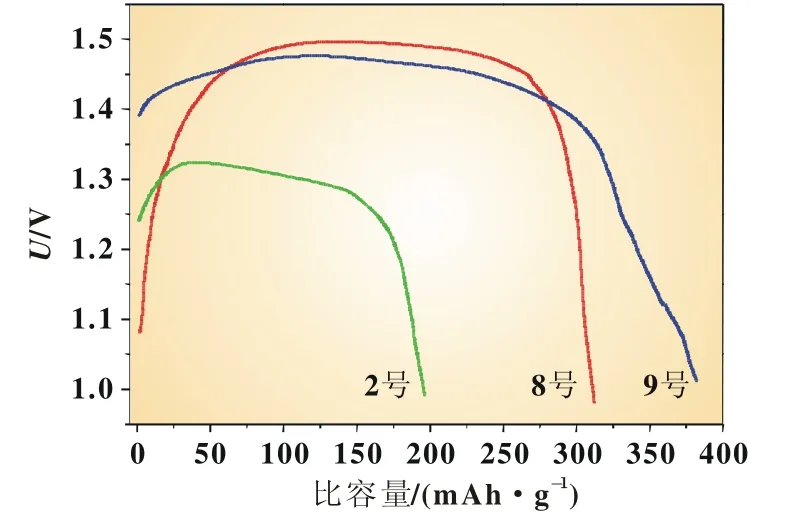
图3 2、8号和优化样品的放电曲线
3 结论
实验中采用液相沉淀法制备了AgO材料,并研究了各种工艺参数的影响程度和电化学性能,得出如下结论:(1)各因素对AgO含量的影响大小为:温度>n(K2S2O8)∶n(AgNO3)>n(KOH)∶n(AgNO3)>反应时间>滴定速率,最优化实验方案为:温度控制在90℃;滴定AgNO3速率为10 mL/min;n(K2S2O8)∶n(AgNO3)=1.2∶2;n(KOH)∶n(AgNO3)=3.0∶1;反应时间60 min;(2)化学沉淀法制备出较低含量的样品中有大量的Ag2O的存在,导致形貌不规整,片状结构材料也较厚;(3)最优化方法制备出的AgO的样品的纯度可达95.7%,同时8C恒流放电比容量高达382 mAh/g,为理论值的88%,且具有较高的电压平台。
[1] SMITH D F,BROWN C.Aging in chemically prepared divalent silver oxide electrodes for silver/zinc reserve batteries[J].J Power Sources,2001,96(1):121-127.
[2] SMITH D F,GRAYBILL G R,GRUBBS R K,et al.A new developments in very high rate silver oxide electrodes[J].J Power Sources,1997,65:47-52.
[3] EBERHARD H.Advanced electrochemical energy sources for space power systems-a review[J].J Power Sources,1979,4(1): 11-19.
[4] MURALI V,VAN Z J W.A model for the silver-zinc battery during high rates of discharge[J].J Power Sources,2007,166: 537-548.
[5] KARPINSKI A P,MAKOVETSHI B,RUSSELL S J,et al. Silver-zinc:status of technology and applications[J].J Power Sources,1999,80:53.
[6] 吕霖娜,林沛,韩雪荣.铝氧化银电池正极材料AgO的分解动力学研究[J].电源技术,2011,35(8):976-978.
[7] DALLEK S,WEST W A,LARRICK B F.Decomposition Kinetics of AgO cathode material by thermogravimetry[J].J Electrochem Soc,1986,133(12):2451-2454.
[8] SALKIND A J,FREEMEN R W,WECKESSER J J,et al.Selfdecomposition processes in silver electrodes[J].J Electrochem Soc,1988,135(8):1882-1887.
[9] 沈文宁,冯拉俊,雷阿利,等.超细过氧化银粉末的制备及其表征[J].稀有金属材料与工程,2011,40:31-35.
[10] 尹海顺,毛健,白昱,等.液相沉淀法制备纳米AgO粉体影响因素的正交分析[J].化工新型材料,2009,37(2):78-79.
[11] 沈文宁,冯拉俊,孔珍珍.AgO超细粉末的制备及银的价态变化研究[J].稀有金属材料与工程,2012,41(11):1961-1965.

