血清化血小板裂解液替代胎牛血清对牙周膜细胞膜片形成的影响
殷 园, 祝金浩, 吴瑞鑫, 陈发明, 张曦予
(1. 军事口腔医学重点实验室, 陕西省口腔医学重点实验室, 第四军医大学口腔医院牙周科, 陕西 西安 710032; 2. 解放军77626部队医院, 西藏 拉萨 851400)
·基础研究·
血清化血小板裂解液替代胎牛血清对牙周膜细胞膜片形成的影响
殷 园1, 祝金浩2, 吴瑞鑫1, 陈发明1, 张曦予1
(1. 军事口腔医学重点实验室, 陕西省口腔医学重点实验室, 第四军医大学口腔医院牙周科, 陕西 西安 710032; 2. 解放军77626部队医院, 西藏 拉萨 851400)
目的: 观察血清化血小板裂解液(PLS)替代胎牛血清(FBS)对牙周膜细胞(PDLCs)体外扩增和膜片形成的影响。方法:首先从人全血白膜中分离出血小板富集物,利用冻融法与钙离子激活法联合制备PLS;然后分别用含100 g/L的 PLS(实验组)和100 g/L FBS(对照组)培养液对PDLCs进行体外培养和成膜诱导,分别采用MTT、RT-PCR和HE染色法检测两组细胞的增殖、成膜以及膜片中成膜相关基因/蛋白的表达水平。结果:MTT检测结果显示,与对照组相比,实验组可支持PDLCs的体外扩增,二者的生长曲线无差异(P>0.05);成膜诱导培养10 d后, RT-PCR检测显示, 实验组的膜片中除Collagen I的表达水平显著低于对照组(P>0.05)外,另两种成膜相关基因(Integrin β1、Fibronectin)的表达水平与对照组相比均无显著差异(P>0.05);组织学观察显示,两组细胞膜片的形态和厚度亦无显著性差异(P>0.05)。结论:PLS可以替代FBS用于牙周膜细胞的体外培养和膜片诱导。
牙周膜细胞(PDLCs); 血小板裂解液; 胎牛血清; 细胞膜片; 转化医学
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.12.001
[Chinese Journal of Conservative Dentistry,2015,25(12): 703]
胎牛血清(fetal bovine serum,FBS)因富含各种生长因子和维持细胞生长的某些生物活性物质,一直以来都是细胞体外培养中不可缺少的营养补充物质[1]。但由于其异种属来源的属性,具有携带动物疫源性疾病的病原体(如朊蛋白)和引起人体免疫排斥的风险;目前,虽然某些临床实验也在使用FBS培养出的细胞进行疾病治疗和组织再生,但其潜在的安全问题仍然令人担忧,因而也阻碍了相关实验室成果的进一步临床转化[2-3]。人血小板裂解液(platelet lysate, PL)作为一种人血来源的物质,富含多种生长因子和生物活性物质,已在多种细胞的体外培养中成功替代FBS。但是PL的一个重要缺陷在于含有纤粘蛋白和其他凝血因子,用来作为培养基补充物时需添加肝素以防止凝胶形成[4]。而商品化的肝素通常是从猪体内提取,虽然已被批准可用于人体,但是仍有对肝素过敏的报道[5-6]。有文献报道,在PL中加入钙离子使其先通过形成凝胶以去除凝血物质后,再取其上清液,即可得到血清化血小板裂解液(serum-converted platelet lysate,PLS);由于PLS中仍保留有大多数的生长因子,其不仅可以支持骨髓间充质干细胞的体外扩增,同时还可避免当PL作为培养基补充物时对肝素的使用[7]。但是,有关PLS对牙周膜细胞(PDLCs)的作用目前尚未见相关研究报道。
细胞膜片作为近年来组织工程技术的研究热点,其不仅可以通过保护细胞外基质、细胞间连接等结构,以维持细胞分化、分泌等生理功能,同时还可提高种子细胞的移植效率、减少细胞的流失率[8]。目前,已有动物实验乃至临床试验尝试将牙周膜细胞膜片用于临床治疗,并取得了较为理想的结果[9-11]。但是相关研究在细胞培养营养时所用的营养补充物都是FBS,从而使其在下一步的临床转化中必然要充分考虑安全性问题,因而探索牙周膜细胞膜片培养中合适的营养补充物是十分必要的。本实验旨在探索LPS替代FBS用于PDLCs体外培养的可能性,并观察其对PDLCs形成的影响,以期为临床转化提供参考。
1 材料和方法
1.1 主要试剂和仪器
α- MEM培养基、磷酸盐缓冲液(PBS)(Hyclone,美国);FBS(杭州四季青);青、链霉素(北京索莱宝);Ⅰ型胶原酶 、牛血清白蛋白(BSA)(Sigma- Aldrich,美国);胰蛋白酶(Amresco,美国);RNAiso、PrimeSeriptTM反转录试剂盒、SYBR®Premix Ex TaqTMⅡ试剂盒(Takara,日本);Western及IP细胞裂解液、Bradford蛋白浓度测定试剂盒(上海碧云天);PVDF膜(Millipore,美国);Anti-Collagen I antibody (EPR7785)、 Anti- Fibronectin antibody (F14)、Anti- Integrin beta 1 antibody (EPR16895)(Abcam,美国);HRP标记的山羊抗兔二抗、β- tublin一抗(北京康为世纪);6孔培养板、平底96孔板(NEST,香港耐思生物科技);二氧化碳恒温孵箱(Heraeus,德国);YJ- 875 型超净工作台(苏州净化设备厂);离心机(Kub- ota 2100,日本);倒置相差显微镜及照相系统(Olympus,日本);超声震荡仪(上海生源);酶联免疫检测仪(BIO- TEK,美国);CFX ConnectTMReal- Time PCR检测系统、蛋白电泳仪(Bio- Rad,美国);Tanon 5200 全自动化学发光图像分析系统(上海天能)。
1.2 PDLCs的分离、培养
收集我院颌面外科因阻生而拔除的第三磨牙(无龋、无牙周炎),患者知情同意。拔除后立刻放入预冷的α- MEM培养液中运回实验室,并用含青霉素100 U/mL、链霉素100 μg/mL的PBS溶液冲洗至液体清亮、牙体表面无明显血污为止。用无菌11号刀片刮取根中1/3的牙周膜组织并剪碎后,离心(800 r/min,5 min)弃上清;然后收集沉淀部分,并加入3 mg/mL的Ⅰ型胶原酶消化60 min(37 ℃、50 mL/L CO2)。消化完成后离心弃去胶原酶,加入10 mL PBS重悬、洗涤并离心,弃上清;收集细胞并用2 mL α- MEM(含100 mL/L 胎牛血清)重悬后,接种于35 mm的塑料培养皿中,转移至孵箱中静置培养(37 ℃、50 mL/L CO2)。每3 d换液,并用倒置显微镜观察细胞的生长情况,待细胞生长汇合至80%时,用2.5 g/L胰酶消化并传代。取P4代细胞用于后述实验。
1.3 PLS的制备
首先从西京医院血库收集检疫合格的科研用人全血白膜(全血离心去除大部分红细胞和血浆后的部分),1 000 r/min离心15 min后弃去底层的红细胞和中层的白细胞,吸取上层富含血小板的血浆部分并经计数后-80 ℃保存备用。为了避免个体差异,共收集了20份人全血白膜并将其混合在一起,所有献血者的年龄均在35岁以下,所分离出的血小板富集物浓度均在1×109/mL以上。然后参考文献[7]报道的方法制备PLS:取上述收集的血小板富集物分别经-80/37 ℃反复冻融3次后,按照100 ∶1的比例添加0.2 g/mL的CaCl2溶液,并置于4 ℃下静置过夜使之形成凝胶;次日取出凝胶,以4 000 g、4 ℃的条件离心30 min,收集上清并经0.22 μm无菌滤器过滤后分装,-80 ℃保存备用。
1.4 PLS与FBS支持PDLCs增殖的比较观察
取第4代PDLCs以500/孔的密度接种到96孔板,每孔加入200 μL含100 g/L FBS的α- MEM常规条件下培养24 h后,弃去原培养液并将细胞随机分为两组;其中实验组加入含100 g/L PLS的α-MEM,对照组加入含100 g/L FBS的α-MEM继续培养,每2 d换液1次。分别于培养后第1、2、3、4、5、6、7天各时间点取各组细胞(每组每个时间点各5孔)进行检测。具体方法如下:待测孔每孔各加入5 mg/mL的MTT溶液20 μL,避光孵育4 h(37 ℃、50 mL/L CO2)后小心吸净培养液,再于每孔各加入150 μL DMSO并震荡10 min;然后用酶标仪检测各孔590 nm波长处的吸光度值(OD)。所得OD值减去空白对照孔(即不接种细胞,仅有培养液,其余操作一致)的本底OD值即为该孔的实际测量值。
1.5 PLS与FBS对PDLCs膜片形成影响的比较
1.5.1 实验分组和成膜诱导培养
取P4代PDLCs以5×105/孔的密度接种于6孔板,常规条件下培养至细胞生长达80%汇合时,弃原培养液,并将细胞随机分为两组;其中实验组加入含100 g/L PLS的成膜诱导液(即含有50 μg/mL 维生素C的α-MEM),对照组加入含100 g/L FBS的成膜诱导液进行成膜诱导培养。每2 d换液1次,连续诱导培养10 d后进行以下相关指标检测。
1.5.2 成膜相关基因的检测
取成膜诱导10 d的各组细胞膜片,用PBS洗涤3遍后,使用RNAiso提取细胞总RNA,并采用PrimeSeriptTM反转录试剂盒合成cDNA(1 000 ng、20 μL体系)。然后以cDNA为模板,以GAPDH作为内参照,用CFX ConnectTMRT-PCR检测系统和SYBR®Premix Ex TaqTMⅡ试剂盒以及相应的引物分别检测两组细胞中I型胶原(Collagen I)、整合素β1(Integrin β1)和纤连蛋白(Fibronectin)的mRNA表达水平。PCR反应体系、反应条件均按照相应试剂盒说明严格执行。所用引物由上海生物工程公司合成,具体序列见表1。

表1 real-time PCR引物序列
1.5.3 成膜相关蛋白的检测
取成膜诱导10 d的各组细胞膜片,用PBS洗涤3遍后,使用添加有蛋白酶抑制剂的Western及IP细胞裂解液提取细胞总蛋白(冰上超声裂解后12 000 r/min、4 ℃离心15 min取上清),并用Bradford蛋白浓度测定试剂盒检测总蛋白浓度。然后分别从每组中各取30 μg总蛋白,用80 g/L SDS聚丙烯酰胺凝胶进行电泳后,再以湿转法(200 mA、3 h)将蛋白转移至PVDF膜上,并将其置于50 g/L的BSA溶液中室温下摇床封闭2 h;根据分子量分别滴加TBST稀释的Anti-Collagen I antibody(EPR7785)、Anti-Fibronectin antibody(F14)、Anti-Integrin beta 1 antibody(EPR16895)一抗,并4 ℃ 孵育过夜;次日TBST洗膜5 min×3次,滴加HRP标记的山羊抗兔二抗室温下摇床孵育2 h;再次用TBST洗膜5 min×3次,并用增强型化学发光显影试剂盒进行显影后,采用Image J进行条带灰度分析,取目的条带与内参β-tublin条带灰度值的比值作为该样本中蛋白的相对含量。
1.5.4 细胞膜片的形态学观察
取成膜诱导10 d的各组细胞膜片,分别经PBS洗涤3次、40 g/L多聚甲醛固定2 h后,常规石蜡包埋、切片。所得切片经二甲苯脱蜡、梯度乙醇逐级脱水、HE染色后,镜下观察并拍照;然后使用Image J软件对各组膜片的厚度进行定量分析。
1.6 统计学分析
2 结果
2.1 两种培养条件下 PDLCs的生长曲线比较
MTT结果显示:使用100 g/L PLS进行细胞培养时(实验组),PDLCs仍可以正常增殖,其生长曲线与在含100 g/L FBS的培养液中培养的PDLCs(对照组)基本一致;各时间点内两组细胞的生长情况(OD值)相比,除在培养后第2、3天时实验组的OD值明显低于对照组(P<0.05)外,其他各时间点内两组细胞的OD值均无统计学差异(P>0.05)(图1)。

图1 PDLCs在两种培养条件下的生长曲线比较(* P<0.05)
2.2 两种培养条件对PDLCs中成膜相关基因、蛋白表达的影响
两种培养条件下对PDLCs进行成膜诱导10 d后,分别采用RT- PCR、Western blot对两组膜片中Collagen I、Integrin β1、Fibronectin的基因和蛋白进行检测显示, 实验组膜片中的Collagen I mRNA和蛋白的表达水平均明显低于对照组(P<0.05);而两组在Integrin β1和Fibronectin的表达水平方面,无论是基因水平还是蛋白水平,差异均无统计学意义(P>0.05)(图2~3)。

图2 两种培养条件下PDLCs中各成膜相关基因的mRNA表达水平比较
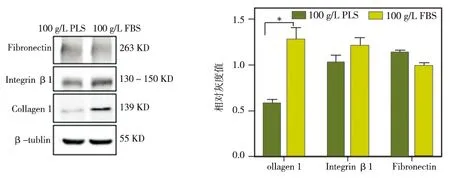
图3 两种培养条件下PDLCs中各成膜相关蛋白的表达水平比较
2.3 两种培养条件下PDLCs膜片的形态学比较
在成膜诱导液中添加100 g/L PLS或100 g/L FBS时,均可成功诱导PDLCs形成膜片,肉眼观察显示,两组膜片均呈乳白色、半透明状,且可以从边缘完整揭起(图4);组织切片后,H&E染色观察显示,使用100 g/L PLS培养的细胞膜片的平均厚度虽略低于100 g/L FBS培养的膜片,但二者无统计学差异(图5~6)。
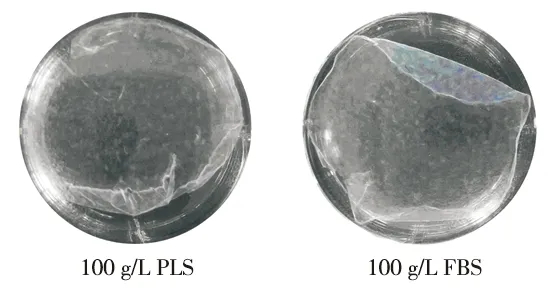
图4 两组细胞膜片的大体观察
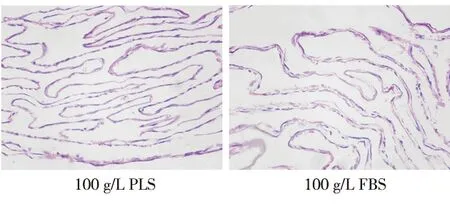
图5 两组细胞膜片的组织学观察(HE染色,×400)
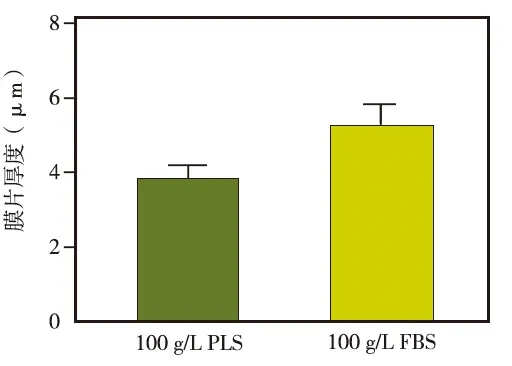
图6 两组细胞膜片的厚度比较±s)
3 讨论
近年来随着组织工程技术的飞速发展,越来越多的实验成果将有待于临床转化,组织工程细胞体外扩增是进行实验成果向临床应用转化不可缺少的步骤。目前在组织工程细胞体外扩增的过程中,多数研究均常规使用FBS作为营养补充物。但作为异种来源物质,FBS本身具有不可避免的生物安全隐患:可能携带动物疫源性疾病的病原体,如朊蛋白和支原体,这是目前使用过滤除菌方法无法清除的;此外在细胞培养的过程中,部分细胞会内吞FBS中的蛋白成分,这样很可能在应用于人体时造成异源性免疫排斥反应[12]。因此,研究者尝试了各种方案以替代FBS用于细胞的大规模体外扩增的营养补充物。其中血小板裂解液(PL)富含多种生长因子,且制备简单、价格低廉,似乎是目前替代FBS最为理想的选择。有报道提出,使用PL代替FBS进行细胞体外扩增是安全有效的,并且在培养过程中不会改变培养细胞的多向分化潜能或表面标记[12-13]。但是,传统的血小板裂解液需要添加从猪的小肠黏膜中提取加工而来的药用肝素,以防止其中的凝血物质凝聚。药用肝素在临床上偶有过敏的报道,过敏原因可能是由于种属差异或者制备过程中可能的污染或成分不纯所致[6,14];另有报道指出,肝素的使用可能会影响某些细胞功能,如干扰骨髓来源的单个核细胞在心血管修复中的迁移和归巢[15]。作为不向血小板裂解液中添加肝素的血清化血小板裂解液(PLS),可以完全杜绝异种物质—肝素的使用,因此,其越来越受到研究者的关注。
牙周病作为一种慢性疾病,可导致牙松动甚至脱落,影响着人类的口腔健康。PDLCs是牙周膜韧带中的细胞,其形成的细胞膜片在牙周再生的临床应用中受到广泛关注。牙周膜细胞膜片通过将牙周韧带正常细胞体外扩增培养,从而形成多层细胞膜片,可应用于撕脱牙再植、牙周组织缺损等疾病,帮助形成正常的牙周韧带纤维、牙骨质和牙槽骨等牙周组织,对其再生发挥了巨大的作用[16-17]。目前,针对PLS的研究主要集中于诱导干细胞成骨方向,还没有对PLS作为PDLCs体外培养营养补充物进行的具体研究。本实验使用PLS替代FBS,成功实现了PDLCs的体外培养和膜片诱导。在PDLCs的体外扩增中,100 g/L 的PLS可以达到与100 g/L FBS相近的促进细胞增殖效果。在接下来的研究中我们将考虑设置PLS的浓度梯度,以寻找是否存在优于100 g/L的FBS方案。虽然在成膜诱导过程中,使用100 g/L PLS作为营养补充物时,其细胞外基质中的Collagen I基因和蛋白的表达水平较使用100 g/L FBS时有所下降,且膜片的厚度也有下降的趋势(无统计学差异),但依然成功诱导并形成了膜片,而且另外两种重要的成膜相关基因Integrin β1和Fibronectin的表达水平均与100 g/L FBS相比无显著性差异。以上结果提示,PLS可以替代FBS用于膜片诱导。当然如何选择合适的浓度以及是否需要适当调整成膜诱导液的成分等尚需要进一步的探索。
[1]Lennon DP, Caplan AI. Isolation of human marrow- derived mesenchymal stem cells[J].ExpHematol, 2006, 34(11):1604-1605.
[2]Shahdadfar A, Frφnsdal K, Haug T,etal. In vitro expansion of human mesenchymal stem cells: choice of serum is a determinant of cell proliferation, differentiation, gene expression, and transcriptome stability[J].StemCells, 2005, 23(9):1357-1366.
[3]Spees JL, Gregory CA, Singh H,etal. Internalized antigens must be removed to prepare hypoimmunogenic mesenchymal stem cells for cell and gene therapy[J].MolTher, 2004, 9(5):747-756.
[4]Kocaoemer A, Kern S, Klüter H,etal. Human AB serum and thrombin- activated platelet- rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue[J].StemCells, 2007, 25(5):1270-1278.
[5]Huang Q, Xu T, Wang GY,etal. Species- specific identification of ruminant components contaminating industrial crude porcine heparin using real- time fluorescent qualitative and quantitative PCR[J].AnalBioanalChem, 2012, 402(4):1625-1634.
[6]Bottio T, Pittarello G, Bonato R,etal. Life- threatening anaphylactic shock caused by porcine heparin intravenous infusion during mitral valve repair[J].JThoracCardiovascSurg, 2003, 126(4):1194-1195.
[7]Mojica- Henshaw MP, Jacobson P, Morris J,etal. Serum- converted platelet lysate can substitute for fetal bovine serum in human mesenchymal stromal cell cultures[J].Cytotherapy, 2013, 15(12):1458-1468.
[8]Li G, Wang X, Cao J,etal. Coculture of peripheral blood CD34+ cell and mesenchymal stem cell sheets increase the formation of bone in calvarial critical- size defects in rabbits[J].BrJOralMaxillofacSurg, 2014, 52(2):134-139.
[9]Liu Y, Zheng Y, Ding G,etal. Periodontal ligament stem cell- mediated treatment for periodontitis in miniature swine[J].StemCells, 2008, 26(4):1065-1073.
[10]Feng F, Akiyama K, Liu Y,etal. Utility of PDL progenitors for in vivo tissue regeneration: a report of 3 cases[J].OralDis, 2010, 16(1):20-28.
[11]Zhao YH, Zhang M, Liu NX,etal. The combined use of cell sheet fragments of periodontal ligament stem cells and platelet-rich fibrin granules for avulsed tooth reimplantation[J].Biomaterials, 2013, 34(22):5506-5520.
[12]Schallmoser K, Bartmann C, Rohde E ,etal. Human platelet lysate can replace fetal bovine serum for clinical- scale expansion of functional mesenchymal stromal cells[J].Transfusion, 2007,47:1436-1446.
[13]Ben Azouna N, Jenhani F, Regaya Z,etal. Phenotypical and functional characteristics of mesenchymal stem cells from bone marrow: comparison of culture using different media supplemented with human platelet lysate or fetal bovine serum[J].StemCellResTher, 2012, 3(6):1-14.
[14]Liu H, Zhang Z, Linhardt RJ. Lessons learned from the contamination of heparin[J].NatProdRep, 2009, 26(3):313- 321.
[15]Seeger FH, Rasper T, Fischer A,etal. Heparin disrupts the CXCR4/SDF- 1 axis and impairs the functional capacity of bone marrow- derived mononuclear cells used for cardiovascular repair[J].CircRes, 2012, 111(7):854-862.
[16]Zhou Y, Li Y, Mao L,etal. Periodontal healing by periodontal ligament cell sheets in a teeth replantation model [J].ArchOralBiol, 2012, 57(2):169-176.
[17]Tsumanuma Y, Iwata T, Washio K,etal. Comparison of different tissue- derived stem cell sheets for periodontal regeneration in a canine 1- wall defect model[J].Biomaterials, 2011, 32(25):5819-5825.
Replacement of fetal bovine serum with serum-converted platelet lysate in the preparation of periodontal ligament cell sheet
YIN Yuan*, ZHU Jin- hao, WU Rui- xin, CHEN Fa- ming, ZHANG Xi- yu
(*StateKeyLaboratoryofMilitaryStomotology,DepartmentofPeriodontology,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi′an710032,China)
AIM: To evaluate the possibility of replacing fetal bovine serum (FBS) with serum-converted platelet lysate (PLS) in the ex-vivo expansion of periodontal ligament cells (PDLCs) and the cell sheet formation. METHODS: PLS was prepared from buffy-coat platelet concentrate using a combination of freezing-thawing method and calcium-activating method. 100 g/L PLS(PLS group) and 100 g/L FBS(FBS group) were respectively used during the culture and sheet-induction of PDLCs. The growth curve, sheet formation, and the expression level of genes and proteins associated with sheet-formation were examined by MTT assay, RT-PCR and HE staining respectively. RESULTS: Cell proliferation in the 2 groups showed no difference (P>0.05). After 10 days of cell sheet formation culture, RT-PCR showed that the expression of collagen I was reduced in PLS group (P>0.05) . The expression of integrin β1 and fibronectin, genes related to cell sheet formation showed no difference between the 2 groups (P>0.05). No significant difference was noticed in the shape and thickness of cell sheets between the 2 groups (P>0.05). CONCLUSION: PLS can substitute FBS in supporting the expansion and sheet formation of PDLCs.
periodontal ligament cells(PDLCs); platelet lysate; fetal bovine serum; cell sheet; translational medicine
2015-09-02
国家自然科学基金(81500853)
殷 园(1992-),女,汉族,江苏盐城人。硕士生(导师:陈发明)
张曦予,E-mail:39298025@qq.com
R780.2
A
1005-2593(2015)12-0703-06

