低氧预处理对人牙髓干细胞增殖和表达血管生成因子的影响
刘庆娜, 吴补领, 陈 婷 , 陈秋月, 赖玲芝
(广东 广州 510515: 1. 南方医科大学南方医院; 2. 南方医科大学口腔医学院)
低氧预处理对人牙髓干细胞增殖和表达血管生成因子的影响
刘庆娜1,2, 吴补领1,2, 陈 婷1,2, 陈秋月1,2, 赖玲芝1,2
(广东 广州 510515: 1. 南方医科大学南方医院; 2. 南方医科大学口腔医学院)
目的: 研究低氧预处理对人牙髓干细胞(hDPSCs)增殖及表达血管内皮生长因子(VEGF)的影响。方法: 体外分离hDPSCs,按常氧组(210 mL/L O2)和低氧组(30 mL/L O2)分别培养,流式细胞术检测细胞表面标志物;MTT检测细胞增殖;Live/Dead 染色检测细胞活性;qRT- PCR和ELISA检测VEGF的表达量。结果: hDPSCs间充质干细胞表面标志物 CD29、CD44、CD90表达为强阳性,而造血干细胞表面标志物CD34、CD45及内皮细胞表面标志物CD31表达均为阴性;低氧组与常氧组均未发生细胞坏死现象;低氧组hDPSCs增殖能力和hDPSCs的VEGFmRNA表达量均显著高于常氧组(P<0.05); 同时低氧组hDPSCs 培养上清中VEGF的浓度也显著高于常氧组(P<0.05);两组hDPSCs的基质细胞衍生因子(SDF- 1) mRNA表达量均随时间的延长而增加,但低氧预处理对SDF- 1 mRNA的表达无显著影响(P>0.05)。结论:低氧预处理对hDPSCs的细胞活性无明显影响,并且可显著促进hDPSCs的增殖及VEGF的表达。
人牙髓干细胞; 低氧预处理; 血管内皮生长因子; 基质细胞衍生因子
[DOI] 10.15956/j.cnki.chin.j.conserv.dent.2015.02.002
[Chinese Journal of Conservative Dentistry,2015,25(2):68]
人牙髓干细胞(human dental pulp stem cells, hDPSCs)是存在于人牙髓组织中的一种间充质干细胞,具备自我更新和多向分化潜能[1]。hDPSCs可从患者拔除的第三磨牙或正畸牙中分离培养获得,由于其来源于自体细胞,可避免免疫排斥反应[2],因而成为牙髓再生研究最适合的种子细胞。
目前对hDPSCs的体外培养多采用常氧210 mL/L O2的氧体积分数,然而牙髓干细胞在体内的微环境为低氧环境[3]。同时大量研究发现干细胞移植到体内缺血缺氧组织后,多数细胞发生死亡,而低氧预处理可提高间充质干细胞移植后的存活率,促进血管生成并显著改善治疗效果[4-7]。本实验拟采用30 mL/L O2的低氧预处理hDPSCs,研究低氧预处理对hDPSCs增殖、细胞活性及表达血管生成相关因子VEGF、SDF- 1的影响,旨在为hDPSCs的体内研究提供实验依据。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清、DMEM高糖培养基(Gibco,美国);I型胶原酶、胰蛋白酶、青链霉素混合液 (Sigma,美国);CD44、CD29、CD90、CD34、CD45、CD31荧光素标记鼠抗人抗体(Biolegend,美国); 二氧化碳细胞培养箱(Thermo,美国);厌氧微需氧细胞培养系统(ANOXOMAT MARK Ⅱ,荷兰);倒置光学显微镜(Olympus,日本);流式细胞仪(BD,美国); LightCycler 480 (Roche,瑞士);PCR试剂盒(TaKaRa,大连宝生物工程有限公司);ELISA试剂盒(欣博盛生物科技有限公司)。
1.2 方法
1.2.1 hDPSCs的分离培养
收集临床16~25岁因正畸或阻生需要拔除的健康完整恒牙,组织块酶消化法[8]培养hDPSCs。待原代细胞长满瓶底约80%时,常规传代并扩大培养。
1.2.2 流式细胞仪检测hDPSCs表面标记物
取第3代生长状态良好的hDPSCs,2.5 g/L胰蛋白酶消化,离心收集细胞,调节细胞浓度为1×106/mL,重悬于含有1 mg/mL BSA预冷的PBS,CD29、CD44、CD90、CD34、CD45、CD31抗体冰上避光孵育1 h,1 mg/mL BSA预冷的PBS清洗,上流式细胞仪检测。
1.2.3 低氧培养hDPSCs
取第3~5代生长状态良好的hDPSCs,接种于60 mm细胞培养皿中,随机分别放入低氧培养系统(30 mL/L O2)和普通二氧化碳细胞培养箱(210 mL/L O2)中培养。低氧培养系统氧体积分数从210 mL/L O2降至30 mL/L O2,用时约2 min,当氧体积分数稳定至30 mL/L O2后分别培养24、48、72 h。
1.2.4 MTT法检测低氧对hDPSCs增殖的影响
取第3~5代人牙髓干细胞接种于96孔细胞培养板(3×103/孔),分常氧组和低氧组进行培养,分别培养1、2、3、4 d(每个时间点设6个复孔)后,每孔加入20 μL MTT( 5 mg/mL),37 ℃继续孵育4 h,吸去上清,每孔加入150 μL DMSO,振荡10 min,使颗粒充分溶解,用酶标仪于490 nm 波长下测OD值。
1.2.5 细胞活性检测(Live/Dead染色)
低氧和常氧分别培养hDPSCs 24、48、72 h后,去原培养液,加入PI/Calcein- AM混合荧光染色液,PI的终浓度为4 μmol/L,Calcein- AM的终浓度为2 μmol/L,37 ℃孵育15~30 min后,去除染色液,PBS洗涤细胞1~2次,倒置显微镜观察(死细胞可被PI染为红色,活细胞可被Calcein- AM染为黄绿色)。
1.2.6 qRT- PCR检测低氧对hDPSCs表达血管生成相关因子的影响
采用Trizol法提取细胞总RNA,检测总RNA纯度和浓度。使用逆转录试剂盒将提取的总RNA逆转录为cDNA。PCR 反应条件为, 预变性:95 ℃ 30 s;PCR反应: 95 ℃ 5 s, 60 ℃ 30 s,循环40次;溶解曲线分析: 95 ℃ 5 s,60 ℃ 1 min,95 ℃ 0 s;降温:40 ℃ 30 s。所用引物由生工生物工程(上海)股份有限公司合成,各引物序列见表1。

表1 qRT- PCR各引物序列
1.2.7 ELISA检测低氧对hDPSCs表达VEGF的影响
取常氧及低氧分别培养24、48、72 h后hDPSCs的上清液,用ELISA试剂盒检测培养上清液中VEGF的浓度(每个时间点设3个复孔)。ELISA检测方法严格按照试剂盒说明书的操作步骤进行。
1.3 统计学方法
采用SPSS 13.0 软件,对数据(均数±标准差)进行统计学分析,两两比较采用t检验,多组比较采用析因设计的方差分析,检验水准α= 0.05。
2 结果
2.1 hDPSCs的原代培养
倒置显微镜下观察,原代培养约3~5 d后牙髓组织块边缘有细胞游出,多数细胞呈长梭形。约2~3 周可长满瓶底80%,2.5 g/L胰蛋白酶消化传代,待细胞完全贴壁后,每3 d换液1次。平均3 d传代1次,每次按1 ∶3传代。随着细胞生长密度的不断增加,细胞呈放射状或漩涡状排列(图1)。
2.2 hDPSCs表面标志物鉴定结果
流式细胞仪检测所培养的细胞表面标志物,其中CD29、CD44、CD90(间充质干细胞表面标志物)阳性表达率分别为99.97%、100%、99.92%;CD34、
CD45(造血干细胞表面标志物)阳性表达率分别为0.01%、0.47%;CD31(内皮细胞表面标志物)阳性表达率为0.13%(图2)。细胞间充质干细胞表面标志物为阳性,造血干细胞表面标志物及内皮细胞表面标志物为阴性,表明培养的细胞为间充质来源干细胞。

a. hDPSCs原代培养第5天 b. 第3代hDPSCs
图1 倒置显微镜观察(×10)

图2 流式细胞仪检测细胞表面标记物
2.3 低氧预处理对hDPSCs增殖的影响
低氧培养2 d和3 d时hDPSCs的增殖活性明显高于常氧组 (P<0.05);4 d时,hDPSCs的增殖活性也高于常氧组,但无统计学差异(P=0.061)(图3)。说明低氧培养一定时间可显著促进hDPSCs的增殖。
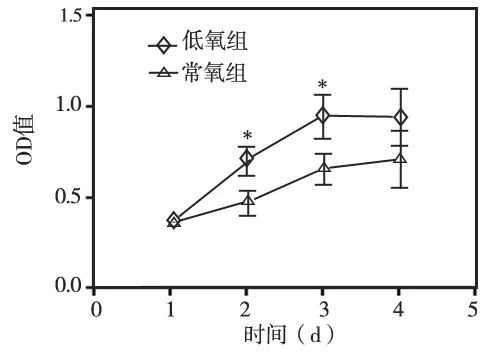
图3 低氧对hDPSCs增殖的影响(*P<0.05)
2.4 细胞活性检测(Live/Dead染色)
Live/Dead染色结果可见,hDPSCs分别培养24、48、72 h后,低氧组细胞形态仍呈长梭形,与常氧组的细胞形态无差异,两组细胞活性良好,均未发现细胞坏死的现象(图4)。
2.5 低氧预处理对hDPSCs中VEGF、SDF- 1 mRNA表达的影响
qRT-PCR检测结果显示:hDPSCs分别培养24、48、72 h后,各时间点低氧组hDPSCs中VEGF mRNA的表达量均明显高于常氧组(P<0.05), 且48 h时VEGF mRNA的表达量增加最为显著。两组SDF- 1 mRNA表达量均随时间延长而增加,但3个时间点低氧组与常氧组SDF- 1 mRNA的表达量无显著差异(P>0.05)(图5)。
2.6 低氧预处理对hDPSCs中VEGF蛋白表达水平的影响
ELISA检测结果显示:hDPSCs分别培养24、48、72 h后。各时间点低氧组细胞培养上清中VEGF浓度均高于常氧组。低氧组细胞培养上清中VEGF浓度在48 h时略高于常氧组,但无统计学差异(P>0.05);24、72 h时,低氧组细胞培养上清中VEGF的浓度显著高于常氧组(P<0.05)(图6)。提示低氧预处理可显著促进hDPSCs分泌合成VEGF。
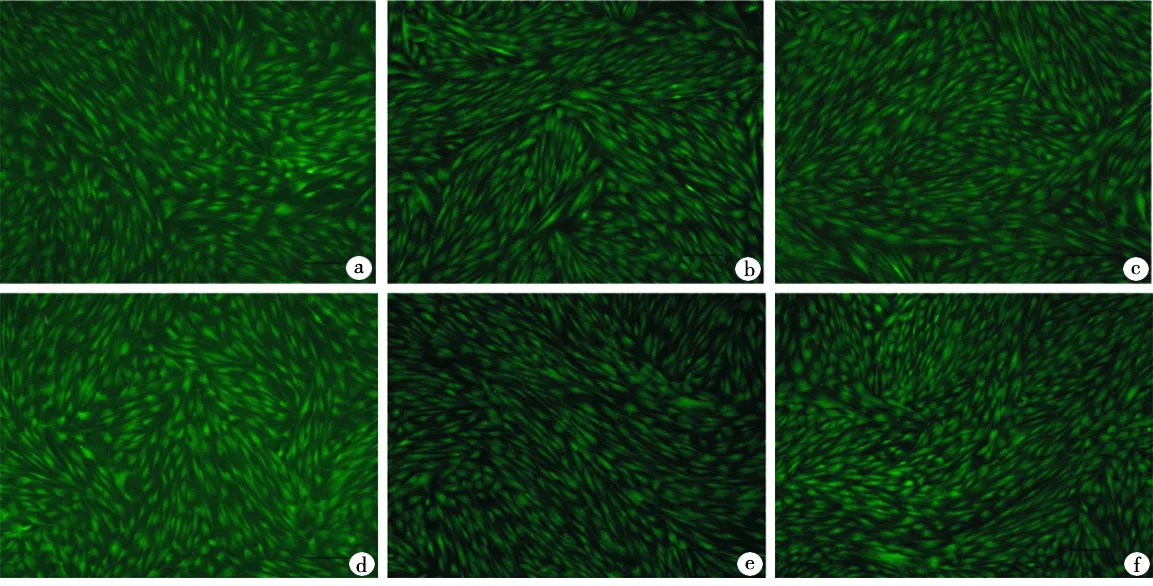
a、b、c分别为低氧培养24、48、72 h; d、e、f分别为常氧培养24、48、72 h

图5 低氧预处理对hDPSCs表达血管生成相关因子的影响(*与常氧组相比P<0.05)
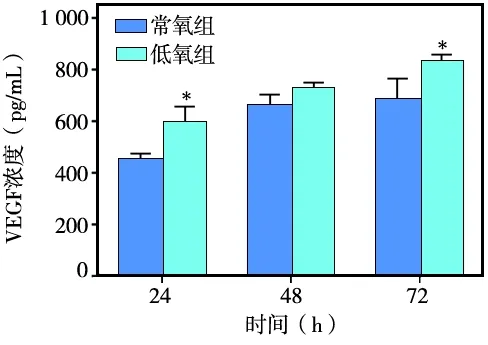
*与常氧组相比P<0.05
3 讨论
低氧是体内普遍存在的一种生理病理现象,参与胚胎发育和多种病变的发展[9]。间充质干细胞在体内存在的微环境为低氧环境[10-11],牙髓干细胞作为间充质干细胞,其在体内的壁龛同样是低氧环境[3]。但目前对牙髓干细胞的培养多采用常氧环境培养,这与其在体内的存在环境有着较大的差异,因此采用低氧培养牙髓干细胞可更加真实模拟其体内的生长环境,同时大量研究表明低氧预处理可提高间充质干细胞移植后的存活率,因此研究低氧环境下牙髓干细胞的生物学特性具有重要的临床意义。
本实验采用30 mL/L O2对hDPSCs进行体外低氧预处理后,发现细胞形态仍为长梭形,与常氧培养的细胞形态一致,未发生细胞死亡的现象,并且增殖能力显著提高,与Iida等[12-14]的研究结果一致,说明短时间低氧预处理可促进hDPSCs的增殖。血管再生是牙髓再生的一个重要组成部分,而且血供的及时建立对于细胞移植后的存活有极为重要的意义。有研究[15-16]发现hDPSCs可表达VEGF等血管生成相关因子,而VEGF在血管发生和形成过程中起着中枢性的调控作用,可诱导内皮细胞增殖、迁移、存活和分化为血管,是针对内皮细胞特异性最高,促血管生长作用最强的有丝分裂原[17]; 本实验与上述研究结果一致。此外,实验还对常氧及低氧培养的hDPSCs表达SDF- 1进行了检测,发现hDPSCs同样可表达SDF- 1。SDF- 1是小分子的细胞因子,属于趋化因子蛋白家族,其在促进内皮细胞及内皮祖细胞的动员、归巢和新生血管形成等过程中有着重要的调节作用。
实验在进一步证实hDPSCs可表达血管生成相关因子VEGF及SDF- 1的基础上,比较了不同时间点低氧和常氧培养的hDPSCs表达血管生成相关因子的差异,发现低氧可显著促进其表达VEGF。低氧48 h时VEGF mRNA表达增加最为显著,低氧24、72 h时其表达与常氧培养较接近,ELISA结果也显示低氧培养的hDPSCs培养上清中VEGF的浓度显著高于常氧组,但不同时间点VEGF的表达在mRNA水平与蛋白水平存在一定差异,推测可能存在转录后调节。SDF- 1 mRNA的表达随时间延长不断增加,但低氧对其表达无明显影响,这与之前的研究结果有所不同,Gong等[14]采用10 mL/L O2培养牙髓细胞24 h后发现低氧可下调SDF- 1的表达,其原因可能是低氧培养的氧浓度不同及低氧培养的时间不一致引起的。
本结果显示低氧可显著促进VEGF的表达,而大量研究表明VEGF与间充质干细胞的体内外促血管生成潜能有着密切关系。Liu等[18]采用低氧预处理脂肪干细胞后,血管生长因子VEGF和bFGF表达增加,将细胞上清液培养脐静脉内皮细胞后,其在基质胶上形成的毛细血管样结构显著多于常氧组;Yu等[4]将低氧预处理的骨髓间充质干细胞移植到肝切除术的动物模型上后,发现可促进肝再生,其机制可能是低氧预处理促进了骨髓干细胞表达VEGF。以上结果均表明低氧预处理可通过促进间充质干细胞表达VEGF来增强其成血管潜能。因此推测低氧预处理同样可通过促进hDPSCs表达 VEGF增强其促血管生成潜能,但对这一推测的验证,还需要进一步的体外共培养实验及体内移植实验等。
综上所述,体外低氧培养hDPSCs可显著促进细胞增殖及VEGF的表达,虽然其机制的阐明还需进一步的研究,但提示低氧预处理对hDPSCs的体内移植可能是有利的。
[1]Gronthos S, Mankani M, Brahim J,etal. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo [J].ProcNatlAcadSciUSA, 2000, 97(25): 13625-13630.
[2]Mitsiadis TA, Feki A, Papaccio G,etal. Dental pulp stem cells, niches, and notch signaling in tooth injury [J].AdvDentRes, 2011, 23(3): 275-279.
[3]Yu CY, Boyd NM, Cringle SJ,etal. Oxygen distribution and consumption in rat lower incisor pulp [J].ArchOralBiol, 2002, 47(7): 529-536.
[4]Yu J, Yin S, Zhang W,etal. Hypoxia preconditioned bone marrow mesenchymal stem cells promote liver regeneration in a rat massive hepatectomy model [J].StemCellResTher, 2013, 4(4): 83.
[5]Leroux L, Descamps B, Tojais NF,etal. Hypoxia preconditioned mesenchymal stem cells improve vascular and skeletal muscle fiber regeneration after ischemia through a Wnt4-dependent pathway [J].MolTher, 2010, 18(8): 1545-1552.
[6]Yue Y, Zhang P, Liu D,etal. Hypoxia preconditioning enhances the viability of ADSCs to increase the survival rate of ischemic skin flaps in rats [J].AestheticPlastSurg, 2013, 37(1): 159-170.
[7]Yu X, Lu C, Liu H,etal. Hypoxic preconditioning with cobalt of bone marrow mesenchymal stem cells improves cell migration and enhances therapy for treatment of ischemic acute kidney injury [J].PLoSOne, 2013, 8(5): e62703.
[8]卢婧,唐荣银,李彦. 人牙髓细胞原代培养方法的比较研究[J]. 牙体牙髓牙周病学杂志, 2006, 16(6): 311-313.
[9]龚启梅. 低氧对成体干细胞增殖和分化的影响[J]. 国际口腔医学杂志, 2011, 38(6): 696-699.
[10]Mohyeldin A, Garzon- Muvdi T, Quinones- Hinojosa A. Oxygen in stem cell biology: a critical component of the stem cell niche [J].CellStemCell, 2010, 7(2): 150-161.
[11]Jing D, Wobus M, Poitz DM,etal. Oxygen tension plays a critical role in the hematopoietic microenvironment in vitro [J].Haematologica, 2012, 97(3): 331-339.
[12]Iida K, Takeda- Kawaguchi T, Tezuka Y,etal. Hypoxia enhances colony formation and proliferation but inhibits differentiation of human dental pulp cells [J].ArchOralBiol, 2010, 55(9): 648-654.
[13]Sakdee JB, White RR, Pagonis TC,etal. Hypoxia- amplified proliferation of human dental pulp cells [J].JEndod, 2009, 35(6): 818-823.
[14]Gong QM, Quan JJ, Jiang HW,etal. Regulation of the stromal cell- derived factor- 1alpha- CXCR4 axis in human dental pulp cells [J].JEndod, 2010, 36(9): 1499-1503.
[15]Bronckaers A, Hilkens P, Fanton Y,etal. Angiogenic properties of human dental pulp stem cells [J].PlosOne, 2013, 8(8): e71104.
[16]冯毅,马静,黄贞. 牙髓干细胞促进牙髓血管生成的相关分子机制研究[J]. 牙体牙髓牙周病学杂志, 2013, 23(12): 768-772.
[17]Ribatti D. The crucial role of vascular permeability factor/vascular endothelial growth factor in angiogenesis: a historical review [J].BrJHaematol, 2005,128(3):303-309.
[18]Liu L, Gao J, Yuan Y,etal. Hypoxia preconditioned human adipose derived mesenchymal stem cells enhance angiogenic potential via secretion of increased VEGF and bFGF [J].CellBiolInt, 2013, 37(6): 551-560.
Effect of hypoxia preconditioning on the proliferation and angiogenic factor expression of human dental pulp stem cells
LIU Qing- na*, WU Bu- ling, CHEN Ting, CHEN Qiu- yue, LAI Ling- zhi
(*NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
AIM: To investigate the effects of hypoxia preconditioning on the proliferation and VEGF expression of human dental pulp stem cells (hDPSCs). METHODS: hDPSCs were cultured under normoxia (210 mL/L O2) and hypoxia (30 mL/L O2) respectively for 72 h. Cell surface molecules were examined by flow cytometry. MTT method was used to observe cell proliferation and Live/Dead assay was used to observe the cell viability, qRT- PCR and ELISA were performed to measure the expression of VEGF and SDF- 1. RESULTS: Strong positive expression of CD29, CD44 and CD90 was found in hDPSCs. CD34, CD45 and CD31 were negative in the cells. Dead cell was not found in both groups. hDPSCs in hypoxia group showed higher proliferation ability than that in normoxia group(P<0.05). Hypoxia significantly increased VEGF mRNA and protein expression (P<0.05), but showed no significant effect on SDF- 1 mRNA expression. CONCLUSION: Hypoxia preconditioning has no influence on hDPSCs viability, but can promote the proliferation and VEGF expression of hDPSCs.
human dental pulp stem cells(hDPSCs); hypoxia preconditioning; VEGF; SDF- 1
2014-09-22;
2015-01-20
国家自然科学基金资助项目(81371137)
刘庆娜(1987-),女,汉族,河南安阳人。硕士生(导师:吴补领)
吴补领,E-mail: bulingwu@smu.edu.com
R780.2
A
1005-2593(2015)02-0068-05

