南美白对虾主要过敏原原肌球蛋白的低过敏性处理方法研究
高永艳,陈钦再,郭桂萍,卢瑛*,孙佳益,潘迎捷
(1.上海海洋大学食品学院/农业部水产品贮藏保鲜质量安全风险评估实验室/上海水产品加工及贮藏工程技术研究中心,上海 201306;2.南通出入境检验检疫局,江苏南通 226006)
南美白对虾主要过敏原原肌球蛋白的低过敏性处理方法研究
高永艳1,陈钦再1,郭桂萍2,卢瑛*1,孙佳益1,潘迎捷1
(1.上海海洋大学食品学院/农业部水产品贮藏保鲜质量安全风险评估实验室/上海水产品加工及贮藏工程技术研究中心,上海 201306;2.南通出入境检验检疫局,江苏南通 226006)
以南美白对虾原肌球蛋白(Tropomyosin,Tm)为研究对象,采用酶解法、超声结合酶解法消减3种虾制品中的Tm。首先,以菠萝蛋白酶水解富集的Tm样品通过优化酶活与底物质量比、反应时间和反应温度,建立了能有效消减Tm的酶解方法;同时对比了酶解、超声结合酶解法分别对虾仁、蝴蝶虾仁和虾糜3种制品中的Tm过敏原性变化情况。Tm致敏动物模型的抗血清ELISA结果显示,单纯酶解和超声结合酶解处理的虾仁其过敏原性无显著性差异(P>0.05);经超声结合菠萝蛋白酶酶解处理后的蝴蝶虾仁样品其过敏原性降低了21.05%;而虾糜样品中,单纯的酶解或超声结合酶解法与对照相比均有显著性差异,其过敏原性分别减少了30.70%和33.33%。综上所述,作者建立的酶解法可有效消减Tm的过敏原性,该酶解法以及超声结合酶解法在低过敏原性蝴蝶虾仁和虾糜制品的生产领域具有较高的应用可行性。
低过敏性;原肌球蛋白;消减;菠萝蛋白酶
随着生活水平的提高,食物引起的过敏性疾病已成为严重的食物安全问题,相关调查显示,约有3%~4%的成人和6%的儿童发生食物过敏反应[1]。根据联合国粮农组织公布的8大类主要过敏食品,有两类属于水产品,其中一类就是虾蟹等甲壳类动物及其制品[2]。近年来,食物过敏发生率呈持续上升趋势,但其发病机制尚不明确[3],临床上尚无有效的治疗方法,易过敏患者仅能依靠避免或者减少致敏性食物的摄入,从而达到预防过敏的目的。
南美白对虾在我国的分布较为广泛,养殖规模较大,是我国常见的虾类,因其含有较高的营养成分,氨基酸种类齐全,蛋白质含量丰富,具有较高的营养价值[4],而被消费者青睐。目前,我国对其消费较高,主要产品有冷冻虾仁、即食虾仁[5]、虾丸[6]等,废弃物[7-8]头壳也有较高的利用价值。
食品领域中的低过敏性处理方法主要有物理法,生物法等,例如有学者用微波结合酶解[9],超高压[10]等方法处理乳制品来降低其过敏性,用超高压结合酶解[11]的方法处理大豆蛋白。原肌球蛋白Tm是甲壳类水产品的主要过敏原物质,其相对分子质量约为36 000,具有较高的热稳定性和一定的耐消化性。目前较为常见的降低虾类致敏性的处理方法有酶解法[12-13]、美拉德反应[14]、高压处理等。也有学者采用辐照[15]、超声[16]等方法降低虾的过敏原性。超声波具有高速、强烈振动和空化效应作用,是一种弹性机械振动波。其传播时产生的热效应、机械效应和空化效应,能够降解生物大分子[10],引起介质的某些变化[17]。蛋白酶的酶解作用主要是使抗原决定簇的三维结构改变,或使化学键断裂导致抗原失去活性从而达到降低其致敏性的作用,也有通过断裂酰胺键,破坏其一级结构而降低其致敏性。有报道用菠萝蛋白酶酶解蛋清样品,其蛋清致敏性有较大程度的降低[18]。
作者以南美白对虾主要过敏原Tm为研究对象,首先优化菠萝蛋白酶对Tm富集样本的最优消减条件[19],建立了Tm的低过敏性处理方法;进而采用酶解、超声结合酶解法分别处理虾仁、蝴蝶虾仁和虾糜样品对比分析其过敏原性变化情况,最终探讨了低过敏原性虾制品的有效处理方法。
1 材料与方法
1.1 材料与仪器
鲜活南美白对虾:购于浦东新区果园农贸市场;层析滤纸(3030-861):德国Whatman公司产品;硝酸纤维素膜(NC):德国赛多利斯公司产品。菠萝蛋白酶(B4882-10G),TEMED(0761),DAB显色液(D0426-50SET):美国Sigma公司产品;蛋白标准相对分子质量Marker(BM523),双色预染宽相对分子质量Marker,牛血清蛋白组分V(BSA),HRP标记的兔抗小鼠抗体IgG(BS392-A):上海生工生物工程技术服务有限公司产品;其他试剂如无特殊说明均为国产分析纯。
匀浆机(JYL-C020):九阳股份有限公司产品;蛋白质电泳仪(mini protean 4):美国BIO-RAD产品;半干式转膜仪(AE-8135):日本ATTO公司产品;凝胶扫描仪(powerlook 2100XL-USB):UMAX公司产品;高速冷冻离心机(Avanti J-26XP):美国Beckman Coulter产品;超声波清洗器(SK5200HP):上海科导超声仪器有限公司产品;酶标仪:Biotek公司产品。
1.2 实验方法
1.2.1 Tm富集样品的制备虾类Tm的富集纯化参照蔡秋凤[20]等的方法,并略作修改。首先将虾肉制成丙酮粉,再将其分别经质量分数35%和55%硫铵浓缩得到Tm富集样品。Bradford法[21]测定蛋白浓度后,保存于-20℃冰箱中。采用SDS-PAGE和免疫印迹法鉴定Tm的纯度,免疫印记一抗为单克隆抗体2A7H6,其对虾蟹等甲壳类和部分软体动物的主要过敏原Tm具有特异性反应[22]。
1.2.2 SDS-PAGE和免疫印记SDS-PAGE:参考陈小文等[23]建立的不连续电泳体系,配制质量浓度为12 g/dL的分离胶和5 g/dL的浓缩胶。样品与上样缓冲液1:1混匀后,点样,电泳结束后,考马斯亮蓝R-250染色,再经凝胶成像系统拍照成像。免疫印迹:电泳结束后,采用半干式电转印法将蛋白转印到硝酸纤维膜上,将膜封闭反应1 h,再分别加入一抗2A7H6和二抗(兔抗鼠HRP-IgG,1:5 000)各室温反应1 h,最后加入DAB显色液显色并拍照。
1.2.3 菠萝蛋白酶酶解条件优化将富集的Tm样品中加入菠萝蛋白酶酶解液(酶活6 u/mg)中,探讨酶解时间、最适酶解温度以及酶活与底物质量比(u/g)3个因素对酶解作用的影响。首先探讨不同酶活与Tm质量比,分别对比酶活与Tm质量比为32.57、21.71、14.47、9.65、6.43、4.29 u/g,在60℃水浴30 min时酶对Tm过敏原活性的酶解作用。再采用温度60℃、酶活与底物质量比为32.57 u/g的条件下分别酶解5、10、15、20、25、30 min,优化酶解时间。最后在酶活与底物质量比为32.57 u/g的条件下,分别采用酶解温度为25、30、35、40、45、50、55℃酶解30 min,优化酶解温度。对酶解后的样品,采用SDS-PAGE及免疫印迹法分析评价酶对过敏原物质的影响,以确定最佳的酶处理条件。
1.2.4 虾制品的低过敏性处理工艺探讨去南美白对虾10~11 g,去除虾头,虾壳,虾线,用蒸馏水冲洗干净,置于吸水纸上去除表面水分,称重(5± 0.03)g,即为虾仁样品;将虾仁沿虾线剖开呈蝴蝶状,作者将其命名为蝴蝶虾仁;用匀浆机将虾仁绞碎后的虾样定义为虾糜样品。首先配制优化后的酶解液,再将其置于水浴锅中预热5 min,再将虾制品加入其中,60℃水浴,酶解30 min后,取出虾制品蒸制15 min灭酶活。此外,作者还采用了超声结合酶解的方法探讨虾的低过敏性。即先将虾仁、蝴蝶虾仁和虾糜样品放入有水的烧杯中,超声3 min,再加酶解液酶解30 min,其余步骤如前所述。对照样品:先将酶解液煮沸10 min灭酶活,再酶解虾仁、蝴蝶虾仁和虾糜样品,其余步骤如前所述。
1.2.5 虾制品的过敏原性分析抽提Tm的方法参照Shi liang[24],并略做修改。经低过敏处理的虾肉与20 mmol/L PBST(pH 7.0,含质量分数0.1% Tween20)体积比1:5混合,匀浆40 s。4℃条件下10 000 g离心20 min,取上清,将其煮沸15 min,立即置于冰上冷却。4℃条件下10 000 g离心20 min,得上清。一部分上清液进行Tricine-SDS-PAGE电泳,参照Hermann Schägger[25]的方法,其中分离胶质量浓度为16 g/dL,堆积胶质量浓度为4 g/dL。另一部分上清液用碳酸盐缓冲液以一定比例稀释后(50 mmolL-1,pH 9.6)100 μL/孔包被,37℃孵育1.5 h,洗涤3次。每孔加200 μL封闭液(PBS+2%BSA)于37℃孵育1 h;洗涤。依次加入抗血清和二抗,抗血清按照1:8 000稀释(PBS+0.5%BSA),二抗(羊抗鼠HRP-IgG,羊抗鼠HRP-IgE)根据产品推荐稀释度稀释,100 μL/孔,37℃孵育1 h;洗涤。OPD显色,硫酸终止,测定吸光度值。
2 结果与讨论
2.1 菠萝蛋白酶对Tm酶解条件的优化
2.1.1 菠萝蛋白酶与底物质量比的优化虾的主要过敏原原肌球蛋白Tm是相对分子质量约为3.6×104的蛋白,不同酶活与底物质量比条件下处理Tm后SDS-PAGE和免疫印迹结果如图1。由图可知,随着酶活与底物质量比的增加,在相对分子质量约为3.4×104和3.6×104处电泳条带逐渐模糊(图1(a))。样本1~5其过敏条带消减较少,而样本6的过敏原Tm条带基本上消失其消减效果较明显,表明当菠萝蛋白酶与底物质量比为32.57 u/g时对过敏原Tm的消减效果最好。免疫印迹结果(图1(b))表明样本3~6在3.4×104和3.6×104处蛋白对2A7H6抗体具有特异性反应,说明3.4×104和3.6×104处为过敏原蛋白Tm;并且样本1在3.4×104和3.6×104处无特异性条带,说明此处没有免疫反应,该结果与电泳结果一致。因此,最优的酶活与底物质量比为32.57 u/g。在后续的优化实验中选择该条件较好。
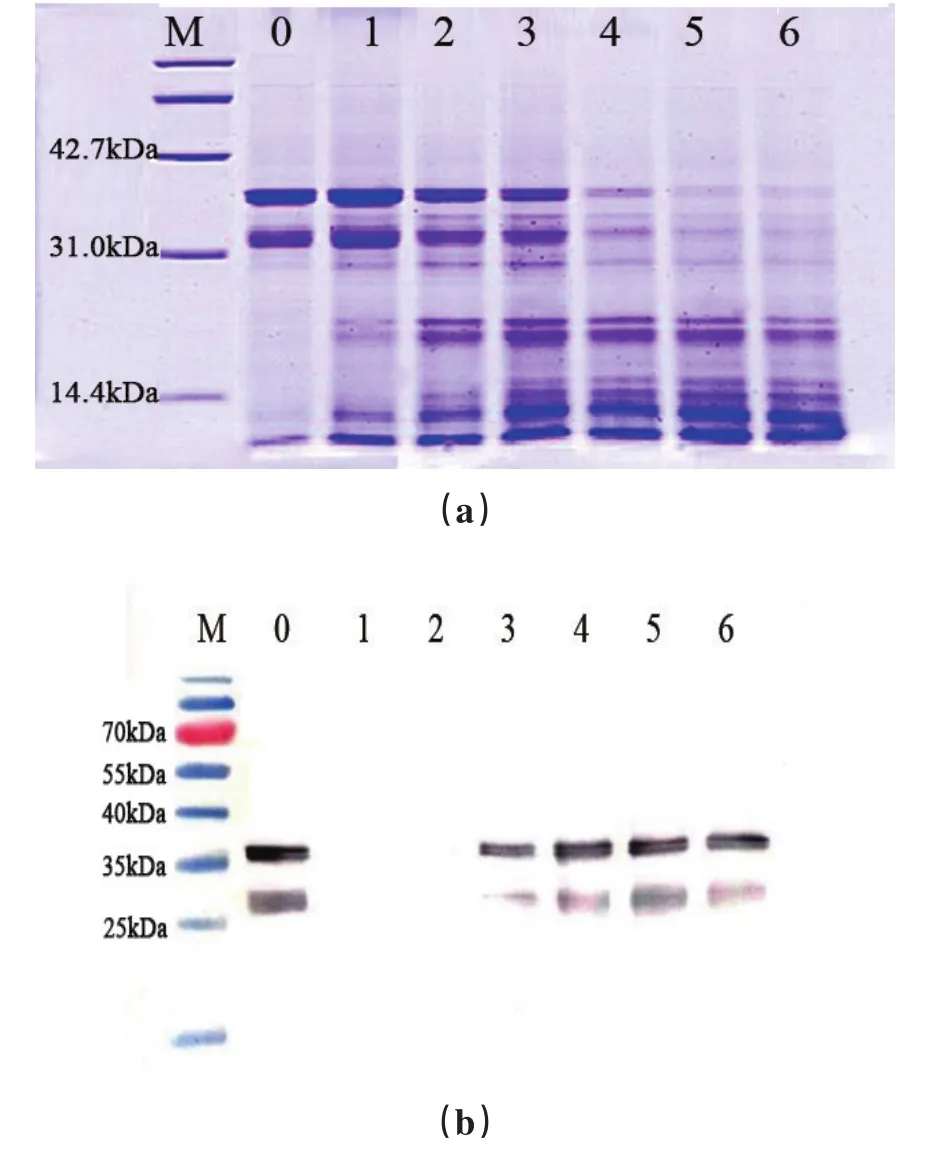
图1 不同酶与底物质量比对Tm的影响Fig.1The effect of mass ratio between bromelain and substrate on Tm
2.1.2 酶解时间的优化在酶解温度为60℃时,不同酶解时间条件下处理Tm的SDS-PAGE和免疫印迹结果如图2所示。从图中可看出,随着酶解时间由1 min到30 min的增加,在相对分子质量约为34× 103和36×103处电泳条带逐渐模糊,条带颜色逐渐变浅(图2(a)),图中样本6过敏原Tm条带最为模糊,几乎看不清楚,说明相比之下,该时间点的酶解效果较好。免疫印迹结果表明(图2(b)),样本6在34×103和36×103处无特异性条带,说明无特异性免疫反应,进而表明Tm消减效果较明显没有特异性反应,免疫印迹检测不出Tm条带。该结果与电泳结果一致。说明菠萝蛋白酶最佳的酶解时间为30 min,酶解30 min的效果较好,在后续的实验中,采用菠萝蛋白酶酶解30 min较好。

图2 不同酶解时间对Tm的影响Fig.2The effect of hydrolysis time of bromelain on Tm
2.1.3 酶解温度的优化不同酶解温度处理Tm的SDS-PAGE和免疫印迹结果如图3所示。随着酶解温度由25℃到55℃的增加,在相对分子质量约为34×103和36×103处电泳条带与对照组相比基本无变化(图3),表明酶解温度在25℃到55℃条件下,菠萝蛋白酶的酶解作用很微弱,对Tm的消减基本没有作用,而根据2.1.2可知,在60℃的条件下处理30 min时的样品过敏原条带消减较为显著,大部分Tm被酶解(图2(a)),免疫印迹反应也证实了这一条件。由此说明,在相同条件下,当菠萝蛋白酶酶解温度设置为60℃时能较明显的消减过敏原Tm。因此,在后续的优化实验中选择菠萝蛋白酶酶解温度为60℃,较为合理。
2.2 超声与酶解结合处理的不同虾制品的Tricine-SDS-PAGE结果
图4所示,经优化条件后的菠萝蛋白酶酶解处理的不同虾制品的Tricine-SDS-PAGE结果,由图可知,样本2的Tm条带与对照相比,没有显著性变化,说明菠萝蛋白酶对虾仁样品的过敏原消减作用较低。样本3的Tm条带与对照相比明显减弱,条带颜色较浅,有小分子蛋白条带产生,表明菠萝蛋白酶对蝴蝶虾仁样品的过敏原消减有一定的作用。样本4的Tm条带减弱的最为明显,并且产生小分子蛋白条带较多,与样本2和3相比,表明菠萝蛋白酶对虾糜样品的过敏原消减作用较强。样本5和6的Tm条带与对照样本几乎无显著差异,表明超声结合酶解处理后的虾仁和蝴蝶虾仁其Tm基本无消减,而样本7的Tm条带最为模糊,并且产生了更多的小分子蛋白条带,表明超声结合酶解处理虾糜样品后Tm条带有较大程度的减弱,超声结合酶解处理虾糜样本的对其过敏原的消减有较好的作用。

图3 不同酶解温度对Tm的影响Fig.3The effect of hydrolysis temperature of bromelain on Tm

图4 菠萝蛋白酶处理虾仁、蝴蝶虾仁和虾糜后的电泳图Fig.4SDS-PAGE of shrimp meat and butterfly shrimp and minced shrimp hydrolyzed by bromelain
2.3 虾制品的过敏原性评价
作者构建的ELISA检测方法,利用前期研究的Tm致敏动物模型获得的针对过敏原Tm的含高浓度的IgE鼠源抗血清和含高浓度IgG的抗血清,利用该抗血清,评价了经菠萝蛋白酶处理后的虾仁、蝴蝶虾仁和虾糜样品的过敏原性变化情况,其结果如表1所示。由表可知,对于虾仁样品,采用羊抗鼠IgE-HRP为二抗进行ELISA检测,对于虾仁样本,单纯的酶解法、超声结合酶解法与对照组相比其OD值都无显著性差异(P>0.05)。

表1 虾仁、蝴蝶虾仁和虾糜经处理后的ELISA检测结果(OD值,X±S.D.,n=9)Table 1OD values of tackled shrimp meat and butterfly shrimp and minced shrimp by ELISA(X±S.D.,n=9)
对于蝴蝶虾仁,单纯酶解法与对照组相比没有明显差异,而超声结合酶解法与对照组相比有极显著的差异(P<0.01),其过敏原性降低了21.05%,表明超声结合酶解法的处理效果要明显好于单纯酶解法。对于虾糜样品,单纯的酶解法或超声结合酶解法与对照组相比均有显著性差异,其OD值比对照组分别减少了30.70%和33.33%,说明这两种处理方法能够明显降低虾糜样品的过敏原性。比较蝴蝶虾仁和虾糜发现,在相同的处理方式下,单纯酶解法处理的虾糜样品效果要好于蝴蝶虾仁,呈极显著性差异;超声结合酶解法处理的蝴蝶虾仁和虾糜其过敏原性的降低程度无显著性差异。综上所述,作者所建立的超声结合酶解法较适用于低过敏性蝴蝶虾仁和虾糜的制备。
3 结语
作者首先以富集的Tm样本为模式蛋白,探讨并建立了有效的消减Tm的酶解处理方法,在此基础上进一步探讨了经该方法处理后的虾仁、蝴蝶虾仁和虾糜制品中的Tm的过敏原性变化情况。结果表明菠萝蛋白酶能够有效消减虾制品的过敏原性,不同的虾制品有其不同程度的消减变化,进一步的研究结果表明酶解法及超声结合酶解法对于蝴蝶虾仁和虾糜的低过敏性有较强的消减作用,相比于虾仁样品消减效果较为显著,具有较好的应用可行性。作者研究结果不仅对虾制品的低过敏性处理方法具有理论指导意义,更为虾制品的低过敏性工艺提供了实际参考,也为开发低过敏性虾产品提供了方法,具有较好的应用性与实际指导意义。
[1]Moreno F J.Gastrointestinal digestion of food allergens:Effectontheirallergenicity[J].Biomed&Pharmacotherapy,2007,61(1): 50-60.
[2]吴海明,胡志和.凡纳滨对虾过敏原酶法消减技术的研究[J].食品科学,2010,31(19):38-41.
WU Haiming,HU Zhihe,WANG Lijuan.Identification and enzymatic elimination of major allergens in Litopenaeus vannamei[J]. Food Science,2010,31(19):38-41.(in Chinese)
[3]王念蓉,黎海芪.食物过敏婴儿和健康儿肠道菌群分析[J].中国微生态学杂志,2006,18(2):110-111.
WANG Nianrong,LI Haiqi.The analysis of intestinalm icroflora of infantswith food allergy and healthy infants[J].Chinese Journal of Microecolog,2006,18(2):110-111.(in Chinese)
[4]潘英,王如才,罗永巨,等.海水和淡水养殖南美白对虾肌肉营养成分的分析比较[J].青岛海洋大学学报:自然科学版,2001,31(6):828-834.
Pan Ying,Wang Rucai,Luo Yongju,et al.Analysis of the nutritive composition in muscle of marine cultured and fresh-water cultured penaeus vannamei[J].Journal of Oceanuiversity of Qingdao(Natural Science),2001,31(6):828-834.(in Chinese)
[5]胡雪琼,张曾奇,夏杏洲,等.一种即食熏制虾仁的生产工艺研究[J].农产品加工·学刊,2009(12):30-34.
Hu Xueqiong,Zhang Zengqi,Xia Xingzhou,et al.The processing technology of instant fumigated shrimp meat[J].Academic Periodical of Farm Products Processing,2009(12):30-34.(in Chinese)
[6]王益群,陈直.虾丸的工艺优化研究[J].食品工业,2011(12):15-18.
Wang Yiqun,Chen zhi.Technology standard and process optimization research of shrimp balls[J].Food Industry,2011(12):15-18.(in Chinese)
[7]罗梦良,钱名全.虾仁加工废弃的头、壳的综合利用[J].淡水渔业,2003.33(6):59-60.
Luo Mengliang,Qian Mingquan.Utilization of the discarded heads and shells in shrimp product processing[J].Freshwater Fisheries,2003,33(6):59-60.(in Chinese)
[8]薛惠琴,孙国荣,杭怡琼.浅谈虾仁生产废弃物的开发利用[J].上海畜牧兽医通讯,2009,(2):105-105.
Xue Huiqin,Sun Guorong,Su HangQiong.Introduction to the development and utilization of shrimp production waste[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,2009,(2):105-105.(in Chinese)
[9]Izquierdo F.J,Peñas E,Baeza M.L,et al.Effects of combined microwave and enzymatic treatments on the hydrolysis and immunoreactivity of dairy whey proteins[J].International Dairy Journal,2008,18(9):918-922.
[10]Zeece M,Huppertz T,Kelly A.Effect of high-pressure treatment on in-vitro digestibility of[β]-lactoglobulin[J].Innovative Food Science and Emerging Technologies,2008,9(1):62-69.
[11]Peñas E,Préstamo G,Polo F,et al.Enzymatic proteolysis,under high pressure of soybean whey:Analysis of peptides and the allergen Gly m 1 in the hydrolysates[J].Food Chemistry,2006,99(3):569-573.
[12]王丽娟,胡志和,周汛,等.南美白对虾蛋白质酶解产物过敏原消减效果研究[J].食品科学,2010,31(17):263-266.
WANG Lijuan,HU Zhihe,ZHOU Xun,et al.Elimination of allergens in South American shrimp by protease hydrolysis[J].Food Science,2010,31(17):263-266.(in Chinese)
[13]吴海明,胡志和,王丽娟.凡纳滨对虾主要过敏原鉴定及酶法消减技术的研究[J].食品科学,2010,31(17):272-276.
WU Haiming,HU Zhihe,WANG Lijuan.Identification and enzymatic elimination of major allergens in Litopenaeus vannamei[J]. Food Science,2010,31(17):272-276.(in Chinese)
[14]李庆丽,李振兴,林洪,等.美拉德反应中麦芽糖、葡萄糖对虾过敏原活性影响的研究[J].食品工业科技,2009,213(1):79-81.
Li Qingli,Li Zhenxing,LIN Hong,et al.Study on the influence of maltose and glucose in Maillard reaction on the activity of the shrimp allergen[J].Science and Technology of Food Industry,2009,213(1):79-81.(in Chinese)
[15]Li Z X,Lin H,Cao L M,et al.The Influence of gamma irradiation on the allergenicity of shrimp(Penaeus vannamei)[J].Journal of Food Engineering,2007,79(3):945-949.
[16]Li Z X,Lin H,Cao L M,et al.Reduction of allergenic properties of shrimp(Penaeus Vannamei)allergens by high intensity ultrasound[J].European Food Research and Technology,2006,223(5):639-644.
[17]Li Z X,Lin H,Cao L M.Influence of ultrasonic treatment on the allergenic properties of shrimp(Penaeus vannamei)allergen[J]. Journal of Ocean University of China,2006,5(2):115-118.
[18]聂君,杨哪,金征宇,等.不同加工处理方式对蛋清致敏的影响[J].食品与生物技术学报,2011,30(4):528-534. NIE Jun,YANG Na,JIN Zengyu,et al.Influence of different processings on egg white’s antigenicity[J].Journal of Food Science and Biotechnology,2011,30(4):528-534.(in Chinese)
[19]张玮玮,武彦文,欧阳杰.酶解水提法从胡萝卜中提取水溶性β-胡萝卜素[J].食品与生物技术学报,201332(8):854-860.
ZHANG Weiwei,WU Yanwen,OU Yanjie.Extraction of water-soluble β-carotene from carrots by enzymation hydrolysis[J]. Journal of Food Science and Biotechnology,2013,32(8):854-860.(in Chinese)
[20]蔡秋凤,王锡昌,刘光明,等.口虾蛄主要过敏原原肌球蛋白的免疫活性[J].水产学报,2010,34(3):415-421.
CAI Qiufeng,WANG Xichang,LIU Guangming,et al.Studies on the Immunoreactivity of the major allergen tropomyosin in mantis shrimp[J].Journal of Fisheries of China,2010,34(3):415-421.(in Chinese)
[21]杨文鹏,王明春,杨留启,等.玉米总蛋白质提取技术和蛋白质样品浓度测定方法的比较[J].种子,2010,29(12):18-23.
YANG Wenpeng,WANG Mingchun,YANG Liuqi,et al.Comparison of methods for the extraction and concentration determination of total protein in maize[J].Seed,2010,29(12):18-23.(in Chinese)
[22]Lu Y,Ohshima T,Ushio H,et al.Immunological characteristics of monoclonal antibodies against shell fish major allergen tropomyosin[J].Food Chemistry,2007,100(3):1093-1099.(in Chinese)
[23]陈小文,尧荣凤,李建春,等.油菜花粉过敏原的分析、鉴定与纯化[J].免疫学杂志,2011,27(3):225-227.
CHEN Xiaowen,YAO Rongfeng,LI Jianchun,et al.Analysis,Characterization and purification of allergen in oilseed rape pollen[J]. Immunological Journal,2011,27(3):225-227.(in Chinese)
[24]Shi L,Wang X C,Liu Y,et al.Rapid detection of shellfish major allergen tropomyosin using Superparamagnetic nanoparticlebased lateral flow immunoassay[J].Advanced Materials Research,2011,(311-313):436-445.
[25]Hermann Schägger.Tricine-SDS-PAGE[J].Nature Protocols,2006,1(1):16-22.
Studies on the Reduction of the Major Allergen Tropomyosin in Pacific White Shrimp
GAO Yongyan1,CHEN Qinzai1,GUO Guiping2,LU Ying*1,SUN Jiayi1,PAN Yingjie1
(1.College of Food Science and Technology,Shanghai Ocean University,Shanghai Engineering Research Center of Aquatic-Product Processing&Preservation,Laboratory of Quality&Safety Risk Assessment for AquaticProducts on Storage andPreservation(Shanghai),Ministry of Agriculture,Shanghai 201306,China;2.Nantong Entery-Exit Inspection and Quarantine Bureau,Nantong 226006,China)
The reduction of tropomyosin(Tm),the major allergen in Pacific white shrimp(PenaeusVannamei),wasstudiedusingenzymolysisandthecombinationofultrasound andenzymolysis,respectively.First,the enzymatic hydrolysis of shrimp Tm with bromelain wasoptimized by measuring the effects of changes in enzyme activity/substrate mass ratio,incubation time and temperature of hydrolysis.The changes of Tm allergenicity in peeled prawns,butterfly shrimp and minced shrimp was comparatively studied by three methods of hydrolysis.The antiserum of sensitization animal model for shrimp allergen Tm was detected using enzyme-linkedimmunosorbent assay(ELISA).The results showed the allergenicity was not significant(P>0.05)when treated with enzymolysis or combining with ultrasound.The allergenicity of the butterfly shrimp treated by ultrasound and bromelain was reduced to 21.05%,while the allergens of the minced shrimp hydrolyzed using enzymolysis or the combination of ultrasound andenzymolysiswere reduced to 30.70%and 33.33%,respectively.In conclusion,the developed enzymolysis methods,ie.,the enzymolysis and the combination of ultrasound andenzymolysis,can effectively reduce shrimp Tm allergenicity.They have potential applications in producing hypoallergenic shrimp,such as hypoallergenic butterfly shrimp or hypoallergenic minced shrimp.
allergenicity,tropomyosin,reduce,bromelain
Q511
A
1673—1689(2015)04—0413—07
2014-07-14
上海市科技兴农重点攻关项目(沪农科攻字(2009)第6-1号);江苏出入境检验检疫局科研项目(2013kj34);上海海洋大学大学生创新活动计划项目(B1-5106-12-0049);上海水产品加工及贮藏工程技术研究中心资助项目(11DZ2280300);上海高校一流学科建设资助项目。
*通讯作者:卢瑛(1971-),女,上海人,副教授,主要从事食物过敏原、食品安全检测技术研究。E-mail:y-lu@shou.edu.cn

