依达拉奉对老年大鼠心肌缺血再灌注后线粒体功能的保护作用
韦艳红 刘 艳 康晓新 赵 宇 尹 璐 (齐齐哈尔医学院附属三院老年科,黑龙江 齐齐哈尔 161000)
心肌梗死缺血再灌注(I/R)后心肌细胞线粒体产生大量的反应性活性氧(ROS),导致线粒体膜通透性转换孔(mPTP)不可逆性开放,使氧自由基释放并通过级联放大作用启动细胞凋亡程序,造成心肌I/R损伤。依达拉奉(MCI-186)是主要用于脑梗死后的神经保护剂,其作用机制是通过清除线粒体的ROS而阻止mPTP的开放。近年来,国内外研究学者发现MCI-186同样具有清除心肌线粒体ROS的能力〔1〕,并且在改善大鼠心肌I/R损伤方面具有显著疗效〔2〕。然而,目前研究对象均为青壮年大鼠,对于已出现线粒体呼吸功能减退老年大鼠的研究尚存在空白。本研究通过观察线粒体超微结构,检测抗凋亡蛋白Bcl-2、促凋亡网蛋白Bax的表达水平以及mPTP开放程度等,评价MCI-186对老年大鼠I/R损伤后线粒体功能的作用。
1 材料与方法
1.1动物及试剂 36只雄性18个月龄Wistar大鼠,清洁级,体重(500±20)g,由中国农科院哈尔滨兽医研究所提供,许可证号:SYXK(黑)2006-032。随机分为假手术组,I/R组及治疗组,每组12只。MCI-186注射液(10 mg∶5 ml)购自南京先声药业;兔抗鼠Bcl-2、Bax、细胞色素(cyt)C一抗及羊抗兔IgG-AP二抗购自北京中杉金桥公司;线粒体分离试剂盒及TUNEL试剂盒购自碧云天生物科技公司;其余试剂为国产分析纯。
1.2实验分组及I/R模型建立 大鼠腹腔注射2%戊巴比妥钠(1.5 ml/kg)麻醉后,仰卧位固定于操作台,颈胸部备皮消毒后,切开颈部气管进行机械通气后在胸骨左缘2~4肋间开胸,分离暴露左心耳及肺动脉圆锥,于左心耳下方应用5-0手术缝线结扎冠状动脉左前降支。缺血30 min后,剪断缝线再灌注180 min,建立I/R模型。其中,假手术组开胸分离左心耳后不进行结扎;治疗组在再灌注开始时尾静脉滴注 MCI-186(10 mg/kg溶于30 ml生理盐水),30 min内滴完。3组均在180 min再灌注结束后,断髓处死大鼠,提取心肌组织检测。
1.3透射电镜观察心肌线粒体的形态变化 取大鼠左心室心肌组织置于2%戊二醛磷酸固定液中固定24 h后常规脱水、包埋,制成超薄切片,在JEM-100透射电镜下观察心肌细胞线粒体的形态变化。
1.4Western印迹检测Bcl-2、Bax及cyt C蛋白表达 取左室前壁心肌组织,加入蛋白裂解液后,12 000 r/min离心30 min,取上清测定总蛋白含量。聚丙烯酰胺凝胶电泳后转膜,37℃封闭1 h,加入兔抗鼠 Bcl-2(1∶400)、Bax(1∶400)、cyt C(1∶200)一抗,4℃过夜。第2天洗膜后加入羊抗兔IgG-AP(1∶1 000)二抗室温孵育30 min,洗膜后显色。采用Image-Pro Plus 4.0软件分析条带积分值,以GAPDH作为内参,计算蛋白相对表达量。蛋白相对表达量=靶蛋白积分值/GAPDH积分值。
1.5TUNEL法检测心肌细胞凋亡 根据试剂盒操作说明,取大鼠心尖部心肌组织,石蜡包埋后切片染色。在光镜下观察,凋亡心肌细胞核被染成棕褐色,为阳性细胞。每张切片随机取5个不相邻的高倍视野,计数视野内细胞总数及阳性细胞数,心肌细胞凋亡指数(AI)=阳性细胞数/细胞总数×100%。
1.6分光光度法检测mPTP的开放水平 根据线粒体分离试剂盒的说明,取大鼠左室前壁心肌组织,剪碎后加入蛋白裂解液,于冰上研磨为组织匀浆,采用差速离心法分离线粒体。蛋白定量后加入线粒体反应缓冲液,使每组线粒体蛋白含量为500 μg。反应初始时,分光光度计记录样本540 nm处吸光值(A540)后加入 mPTP开放诱导剂 CaCl2(200 μmol/L),观察20 min,每隔2 min记录A540 nm值,计算各时间点A540 nm与初始A540 nm的比值,从而比较mPTP的开放水平。从提取心肌组织至测定结束,均在1 h内完成。
1.7统计学方法 采用SPSS18.0统计软件进行单因素方差分析,两两比较采用SNK-q检验。
2结果
2.1心肌线粒体的形态变化 假手术组线粒体体积大小正常,偶见不规则形态,线粒体间可见脂褐素沉积,为正常衰老心肌线粒体表现。I/R组线粒体不规则形态较多,体积明显增大,嵴排列紊乱,可能是由于mPTP开放导致离子内流,进而内膜肿胀所致。治疗组线粒体形态基本规则,肿胀程度较I/R组明显减轻,嵴排列整齐,总体形态接近假手术。见图1。
2.2Bcl-2、Bax及cyt C的表达水平 与假手术组比较,I/R组蛋白表达均有明显差异(P<0.01),说明再灌注后细胞出现凋亡表现。而经MCI-186治疗后,3种蛋白较I/R组有明显改善(P<0.05),说明MCI-186具有一定的抗凋亡作用。见表1。
2.3心肌细胞凋亡指数 与假手术组(3.85±0.59)比较,I/R组AI(16.25±0.98)明显增高(P<0.01);与I/R组比较,治疗组AI(8.46±1.01)明显降低(P<0.01);治疗组与假手术AI有明显差异(P<0.01)。说明MCI-186只能在一定程度上减轻心肌细胞I/R后的凋亡,并不能达到完全抑制凋亡的水平。见图2。
2.4mPTP的开放程度 线粒体在540 nm处的吸光值与mPTP的开放程度呈反比。随着开放诱导剂作用时间的延长,I/R组mPTP开放程度较假手术组增高(P<0.05),而治疗组开放程度低于I/R组(P<0.05),说明MCI-186可降低mPTP的开放程度,进而防止线粒体肿胀,从而减轻细胞凋亡。见表2。
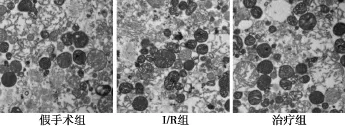
图1 各组缺血再灌注后心肌线粒体形态变化(10 000×)

表1 各组凋亡相关蛋白的表达水平(x ± s,n=12)
表2 各组不同时间点mPTP开放程度(s,%,n=12)

表2 各组不同时间点mPTP开放程度(s,%,n=12)
与假手术组相比:1)P<0.05;与I/R组相比:2)P<0.05
in 20 min假手术组 98.63 ±3.03 97.94 ±3.97 96.87 ±3.25 96.23 ±3.87 95.67 ±4.06 95.16 ±4.33 94.69 ±4.06 94.03 ±3.分组 2 min 4 min 6 min 8 min 10 min 12 min 14 min 16 min 18 m 93 93.73 ±4.01 93.25 ±3.26 I/R 组 94.62 ±4.14 90.43 ±3.671)88.26 ±3.451)85.87 ±4.561)83.02 ±4.381)80.04 ±4.261)76.51 ±3.941)74.46 ±4.151)71.25 ±3.861)69.93 ±4.171)治疗组 97.34 ±4.58 95.61 ±4.632)94.01 ±4.522)93.41 ±3.972)92.32 ±3.842)91.03 ±4.352)90.45 ±4.212)89.05 ±4.562)87.67 ±3.892)85.15 ±4.112)

图2 各组心肌细胞TUNEL染色结果(×40)
3讨论
线粒体是提供心肌细胞能量的主要场所,同时也是ROS产生的主要场所。心肌梗死后,心肌细胞由于缺血缺氧出现变性坏死,同时当闭塞血管再开通后,I/R过程使得线粒体内产生大量自由基,通过mPTP释放入胞质,进而导致细胞凋亡。细胞凋亡裂解所释放的自由基又引起邻近细胞的连锁式凋亡反应,即级联放大反应,因而在I/R后会出现较梗死时更大面积的心肌坏死。因此,抑制I/R后ROS的产生是治疗I/R的主要方法之一。MCI-186是一种新型自由基清除剂,首先被应用于治疗中枢神经系统缺血性疾病并取得良好的临床效果〔3〕,近年来动物实验证明应用MCI-186预处理心肌缺血大鼠可以减少心肌缺血面积〔4,5〕。本文提示心肌纤维的I/R损伤可能不仅是线粒体自由基释放的损伤,还可能存在其他损伤机制。Bcl-2和Bax是细胞内一对抗凋亡蛋白和促凋亡蛋白,均属于Bcl-2蛋白家族〔6〕,Bcl-2原癌基因激活后,其产生的Bcl-2蛋白可以抑制细胞凋亡途径的启动,而Bax的高表达则会启动凋亡程序。MCI-186具有抗心肌细胞凋亡的作用。cyt C是线粒体氧化呼吸链中将电子由复合体Ⅲ传递至复合体Ⅳ的蛋白,其主要存在于线粒体内膜表面。当线粒体膜完整性破坏或mPTP开放时,其可流入胞质,作为凋亡相关蛋白启动凋亡程序〔7〕。本研究说明I/R能够导致线粒体内膜完整性破坏,而MCI-186能够维持线粒体膜稳定性。
凋亡是细胞程序性死亡,需要线粒体产生的ATP提供能量,如果mPTP大量开放破坏线粒体内膜完整性,则会出现ATP合成障碍,导致细胞直接发生水肿坏死〔8〕,使TUNEL染色出现假阴性结果。因此,本研究将缺血时间设定为30 min,避免心肌细胞发生大量坏死,并对mPTP开放程度进行检测,避免假阳性结果的出现。本文说明I/R线粒体内膜稳定性较差,其机制可能是由于基质Ca2+超载、ROS损伤、cyt C破坏等等,目前尚存在争论,但就国内外研究分析〔9,10〕,是多种因素综合所造成的结果。I/R后,心肌通过以ROS为主的多种途径发生损伤,最终导致细胞凋亡,出现心脏泵血功能障碍,而MCI-186通过有效清除ROS而保护线粒体稳定性,改善呼吸作用,进而减轻I/R后的心肌损伤。本研究未能检测线粒体呼吸链中各复合体的功能变化,尚需深入研究。
1 尤 莉,刘志宁.依达拉奉对一氧化碳中毒后心肌损害的保护作用〔J〕.中国老年学杂志,2014;34(18):5086-7.
2 Kikuchi K,Tancharoen S,Takeshige N,et al.The efficacy of edaravone(radicut),a free radical scavenger for cardiovascular disease〔J〕.Int J Mol Sci,2013;14(7):13909-30.
3 Rajesh KG,Sasaguri S,Suzuki R,et al.Antioxidant MCI-186 inhibits mitochondrial permeability transition pore and upregulates Bcl-2 expression〔J〕.Am J Physiol Heart Circ Physiol,2003;285(5):H2171-8.
4 闫学政.依达拉奉对心肌缺血再灌注损伤保护作用〔J〕.中国伤残医学,2014;22(23):95-6.
5 周 明,谢 建,高 振,等.依达拉奉治疗急性心肌梗死再灌注损伤疗效的Meta分析〔J〕.中国循证心血管医学杂志,2014;6(1):10-4.
6 Grossini E,Pollesello P,Bellofatto K,et al.Protective effects elicited by levosimendan against liver ischemia/reperfusion injury in anesthetized rats〔J〕.Liver Transpl,2014;20(3):361-75.
7 Peart JN,Pepe S,Reichelt ME,et al.Dysfunctional survival-signaling and stress-intolerance in aged murine and human myocardium〔J〕.Exp Gerontol,2014;50:72-81.
8 Chen Y,Liu M,Zhao T,et al.Danhong injection inhibits the development of atherosclerosis in both Apoe-/-and Ldlr-/-mice〔J〕.J Cardiovasc Pharmacol,2014;63(5):441-52.
9 李恒昌,许立新,李知平,等.依达拉奉后处理联合远隔缺血后处理对大鼠心肌缺血再灌注损伤的影响〔J〕.中华麻醉学杂志,2013;33(1):99-102.
10 Matsushima S,Tsutsui H,Sadoshima J.Physiological and pathological functions of NADPH oxidases during myocardial ischemia-reperfusion〔J〕.Trends Cardiovasc Med,2014;24(5):202-5.

