腺病毒介导的KDR-HSV-tk系统对血管内皮细胞的杀伤作用及旁观者效应
朱欠元 曾友根 张愈延 李宝金(井冈山大学临床医学院耳鼻喉科,江西 吉安 343000)
HSV-TK丙氧乌苷(GCV)是目前应用最广泛的自杀基因系统,虽在哺乳动物内具有高效的转录活性,但不具有肿瘤特异性,存在着对正常组织的毒副作用。因此,如何提高TK基因的杀伤效率及增强其肿瘤杀伤的靶向性,是当前肿瘤基因疗法中亟待解决的问题。本实验采用KDR启动子构建重组腺病毒载体,探讨该系统对血管内皮细胞杀伤作用及旁杀效应,为开展基因靶向肿瘤血管治疗奠定实验基础。
1 材料与方法
1.1材料 T4 DNA连接酶、限制性内切酶来自TaKaRa公司;6孔板、96孔板为Corning公司产品;腺病毒系统穿梭质粒ptrack由John Hopkins肿瘤中心提供;DMEM、胎牛血清、巨细胞病毒(GCV)、琼脂糖、Lipofectamine 2000转染试剂盒来自Gibco公司。人鼻咽癌细胞株CNE-2来自中山大学附属肿瘤医院;含KDR-tk基因的质粒 pBluescriptⅡKDR-tk、细菌 BJ5183-AD-1、293细胞,人脐静脉血管内皮细胞(HUVEC)由广州市第八人民医院李宝金博士提供。
1.2方法
1.2.1重组腺病毒质粒的构建 扩增pBluescriptⅡKDR-tk、ptrack与ptrack CMV质粒,并酶切鉴定。凝胶电泳回收KDR-tk,将该基因片段与穿梭载体ptrack KDR-tk和ptrack CMV-tk进行转化反应连接并鉴定。通过PmeⅠ酶切线性化穿梭载体ptrack KDR-tk或 ptrack CMV-tk。用 PmeⅠ酶切使穿梭载体ptrack KDR-tk、ptrack CMV-tk线性化,通过BJ5183-AD-1大肠杆菌与腺病毒骨架载体pAdeasy-1进行重源重组成pAdKDR-tk和pAdCMV-tk,扩增备用。
1.2.2重组腺病毒载体AdKDR-tk和AdCMV-tk的包装与扩增 293细胞在含15%胎牛血清DMEM,5%CO2,37℃孵箱中培养后,按Lipofectamine 2000产品说明,分别用重组腺病毒AdKDR-tk和AdCMV-tk载体进行转染,转染后收集细胞冻融,取病毒上清再感染293细胞大量扩增。
1.2.3病毒滴度测定 24孔板中接种293细胞,将10倍倍比稀释的待检病毒悬液依次加入。感染1 h后吸去上清液,培养液中继续培养,2 d后通过观察GFP阳性细胞数计算病毒滴度。
1.2.4HUVEC和CNE-2转染与筛选 取病毒上清液分别感染HUVEC和CNE-2,置于含20%FCS和10 U/ml bFGF、1%明胶铺底的培养基培养方瓶内,培养在含5%CO2、37℃孵箱中进行传代,分别命名为HUVEC/tk、CNE-2/tk细胞。
1.2.5体外GCV敏感实验 在96孔板中分别接种HUVEC和CNE-2,次日分别加入不同感染复数(MOI)的AdKDR-tk及AdCMV-tk病毒系列稀释溶液培养16 h后,实验孔更换不同浓度GCV的新鲜培养液,而对照孔予不含GCV的培养液,检测细胞杀伤效应;将HUVEC及HUVEC/tk、CNE-2及CNE-2/tk按不同比例混合。接种于24孔培养板中培养12 h后,加入不同浓度GCV,以不加GCV作为空白对照。采用MTT计算细胞存活率,存活率=(GCV组平均吸光度/空白对照组平均吸光度)×100%,检测旁杀效应。
1.3统计学处理 采用SPSS10.0软件,多组间比较行单因素方差分析,两两比较行LSD-t检验。
2结果
2.1PCR检测HSV-tk基因片段 以转染tk基因的293细胞进行DNA扩增,显示一条300 bp片段,而正常293细胞为阴性,证明293细胞经转染后存在HSV-tk基因片段,见图1。
2.2HUVEC/tk和CNE-2/tk测定 重组腺病毒质粒转染HUVEC和CNE-2后荧光显微镜下可见绿色荧光蛋白基因GFP的表达,见图2。
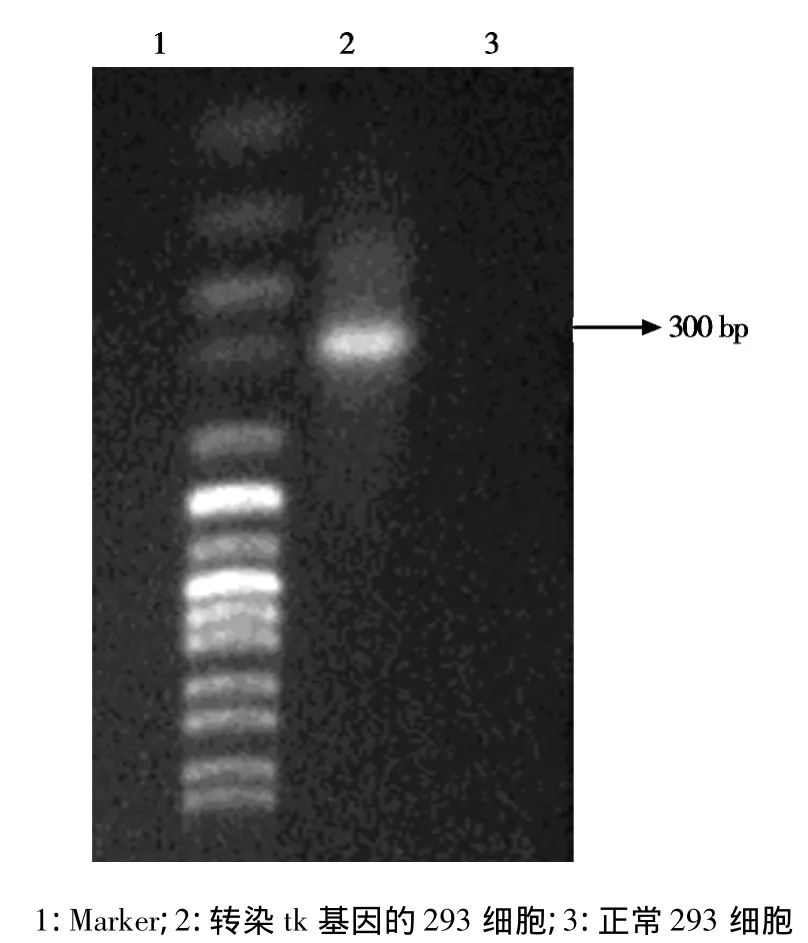
图1 PCR电泳图谱
2.3GCV对细胞的杀伤效应 不同MOI的AdKDR-tk转染HUVEC和CNE-2后,对GCV有不同的敏感性。在MOI为100的条件下,GCV浓度由0增至50 mg/L时含AdKDR-HSV-tk的HUVEC和CNE-2细胞存活率从100%分别降至(23.1±3.9)%和(69.8±3.1)%(P<0.01);感染 AdCMV-HSV-tk的HUVEC和CNE-2细胞存活率从100%分别降至(13.9±2.9)%和(15.7±5.2)%(P>0.05),见图3。

图2 AdKDR-tk感染后绿色荧光蛋白基因GFP的表达
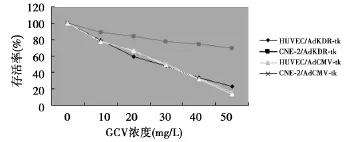
图3 转基因细胞体外杀伤曲线
2.4GCV对细胞的旁观者效应 未转染基因的HUVEC和转染了KDR基因的HUVEC按不同的比例混合,各组细胞随GCV浓度增加均受不同程度的抑制,并与剂量相关。75%HUVEC/tk+25%HUVEC组,其存活率已接近100%HUVEC/tk组,说明GCV不仅杀伤HUVEC/tk,也杀伤了混合培养中未转染tk基因的细胞,存在明显的旁杀效应,见图4。
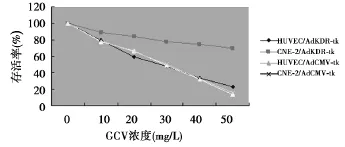
图4 GCV对HUVEC的旁观者效应
3讨论
肿瘤血管生成包括血管内皮细胞的增殖、出芽和迁移等,是肿瘤复杂的生物学过程之一,也是肿瘤侵袭生长、复发转移的先决条件〔1〕。基于肿瘤的生长转移与肿瘤血管密切相关,如何抑制肿瘤血管生成成为目前研究热点。在众多调控血管生成的内源性因子中,血管内皮生长因子(VEGF)是目前研究最多的一个。VEGF主要通过受体KDR发挥作用,改变血管外基质成分,激活血管内皮细胞的增殖和迁移,保持细胞的完整和存活。有研究表明〔2,3〕,KDR在肿瘤新生血管内皮细胞中特异性高表达,而正常血管内皮细胞KDR表达很低,使KDR可成为一个靶向肿瘤血管基因治疗的启动子,具有高度特异性,通过阻止KDR达到抗肿瘤血管生成具有广泛的应用前景,并且已被证明是非常有效的〔4,5〕。
本研究构建以KDR为启动子驱动自杀基因系统,将高度肿瘤特异性KDR与HSV-tk基因结合起来,提高了自杀基因系统靶向肿瘤血管和组织的准确性,对正常组织影响较小。实验结果表明,AdKDR-HSV-tk自杀基因系统在GCV的作用下,对具有KDR表达的血管内皮细胞杀伤明显,具有高度的特异性,其旁杀效应也效果显著,而对不表达KDR的鼻咽癌细胞CNE-2无明显杀伤作用。提示该系统可在肿瘤血管为靶点的肿瘤自杀基因治疗中发挥作用,为进一步开展靶向肿瘤血管基因疗法奠定实验基础。
1 Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation〔J〕.Cell,2011;144(5):646-74.
2 Liu L,Wu N,Li J.Novel targeted agents for gastric cancer〔J〕.Hematol Oncol,2012;5(31):1186.
3 Chekhonin VP,Shein SA,Korchagina AA,et al.VEGF in neoplastic angiogenesis〔J〕.Vestn Ross Akad Med Nauk,2012;(2):23-33.
4 Teng LS,Jin KT,He KF,et a.Advances in combination of antiangiogenic agents targeting VEGF-binding and conventional chemotherapy and radiation for cancer treatment〔J〕.J Chin Med Assoc,2010;73(6):281-8.
5 Teng LS,Jin KT,He KF,et al.Clinical applications of VEGF-trap(aflibercept)in cancer treatment〔J〕.J Chin Med Assoc,2010;73(9):449-56.

