上海市动物源性食品中单增李斯特菌的流行病学及生物被膜形成能力研究
王少辉,刘萍萍,魏建超,邵东华,史子学,李蓓蓓,马志永
(中国农业科学院上海兽医研究所,上海200241)
上海市动物源性食品中单增李斯特菌的流行病学及生物被膜形成能力研究
王少辉,刘萍萍,魏建超,邵东华,史子学,李蓓蓓,马志永
(中国农业科学院上海兽医研究所,上海200241)
为了解上海市动物源性食品中单增李斯特菌的污染状况,在上海市不同超市和农贸市场采集479份动物源性食品样品,依据国标方法进行菌株分离,并对分离菌株的耐药性、血清型及生物被膜形成能力进行测定。结果共分离鉴定34株单增李斯特菌,分离率为7.1%(34/479)。药敏试验结果显示单增李斯特菌分离株的耐药率虽然不高,但日趋严重,对氨苄青霉素和万古霉素均敏感,对头孢曲松的耐药性最高(55.88%),林可霉素次之(41.18%)。血清型鉴定表明单增李斯特菌分离株以血清型1/2a(3a)型为主(76.47%),血清型1/2c(3c)次之(17.65%),而致病性强的血清型4b(4d、4e)仅占2.94%。生物被膜形成能力实验表明,所有的菌株均能形成生物被膜,其中76.47%(26/34)分离株生物被膜形成能力微弱。上海市动物源性食品中单增李斯特菌污染情况较为严重,主要流行1/2a(3a)血清型,耐药率日趋严重,均可形成生物被膜。因此,应加强对动物源性食品中单增李斯特菌的监控。
单增李斯特菌;耐药性;血清型;生物被膜
单核细胞增生李斯特菌(Listeria monocytogenes,LM)又称单增李斯特菌,是一种胞内寄生的革兰阳性杆菌。LM是重要的人兽共患病原菌,是危害严重的食源性疾病致病菌之一。近年来,由LM引起的食物中毒的情况日趋严重,在欧美等地由此菌造成的食物污染程度和病例已大大超过沙门菌[1-3]。李斯特菌病虽发病率不高,但其致死率(20%~30%)远高于其他常见食源性病原菌[4,5]。因此,应加强对食品中LM的检测及监控,为该病的防控提供理论依据。
本研究依据国家标准对上海市的超市和农贸市场的动物源性食品进行了抽样调查,并对分离得到的LM菌株进行血清型及生物被膜形成能力分析,更深入了解动物源性食品中LM的流行情况,为预防人感染 LM 提供参考。
1 材料与方法
1.1 样品收集和标准菌株 2011年6月~2012年6月分别在上海市大型超市、农贸市场、菜市场采集生肉类、散装熟肉制品、生奶等各类食品共479份样品,用于菌株分离鉴定。LM菌株10403s、EGDe、英诺克李斯特菌(L.innocua)(ATCC33090)由浙江大学方维焕教授惠赠[6];单增李斯特菌CVCC 53004购自中国兽医药品监察所菌种保藏中心。
1.2 试剂和仪器 脑心浸液培养基(Brain Heart Infusion,BHI)、PALCAM选择性培养基均购自青岛海博生物技术公司;细菌基因组提取试剂盒、2×PCR MasterMix及DNA Marker均购自天根(北京)生物科技有限公司;药敏纸片购自杭州天和微生物试剂有限公司;PCR仪购自Applied Biosystems公司;核酸电泳仪购自北京市六一仪器厂;凝胶成像分析仪购自Bio-Rad公司;多功能酶标仪购自BioTek公司。
1.3 LM的分离鉴定 参照国标(GB/T4789.30-2008)方法略加修改后进行LM的分离及鉴定。将样品进行预增菌,取增菌液划线接种于PALCAM选择性琼脂平板,培养24~48 h,挑选黑色或者灰绿色疑似单菌落,37℃培养。然后采用PCR方法扩增LM溶血素基因hly,引物见表1。

表 1 本研究使用的引物Table 1 Primers used in this study
1.4 细菌基因组的提取 根据DNA提取试剂盒根生化科技有限公司)说明书提取LM的基因组,-40℃保存备用。
1.5 药敏试验 采用纸片扩散法进行药敏试验。将LM分离株以1:100比例接种于5 mL BHI培养基中,37℃过夜培养,取菌液致密划线于BHI琼脂平板表面,将药敏片贴于培养基表面,37℃培养24 h后测量抑菌圈直径。根据美国临床检验标准委员(CLSI)标准判定LM分离株的药物敏感性。
1.6 血清型分型 参照文献[7,8]中方法,根据lmo0737、lmo1118、ORF2819、ORF2110、prs五个基因序列设计并合成引物(表1),采用PCR方法对LM分离株进行血清型分型。
1.7 生物被膜形成能力分析 将LM在相同条件下培养,调节OD600=0.3,然后1:100稀释,加入96孔聚苯乙烯微孔板,每孔200 μL,每个样品6个重复,37℃静置培养24 h。弃去培养液,无菌PBS清洗3次除去浮游菌体,然后加入200 μL结晶紫染色1 h。PBS清洗3次,自然风干,加入200 μL 95%乙醇作用5~10 min,测定OD595,以无菌培养基作为阴性对照。
参照Stepanovic等[9]的方法,分析各个菌株生物被膜形成能力。以阴性对照的平均OD值加上3倍的标准差(s)即ODc为基准,OD<ODc为不形成生物被膜;1ODc<OD<2ODc为弱生物被膜形成能力;2ODc<OD<4ODc为形成生物被膜能力中等;OD>4ODc则为强生物被膜形成能力。
2 结果
2.1 LM 在动物源性食品中的分布 对上海市超市和农贸市场的479份动物源性食品样品进行分析,经预增菌、显色培养基培养、PCR鉴定(图1),最终分离得到34株LM,分离率为7.1%(34/479)。通过分析显示LM主要分布于鸡肉产品中,在牛肉产品中分离率较低(表2)。
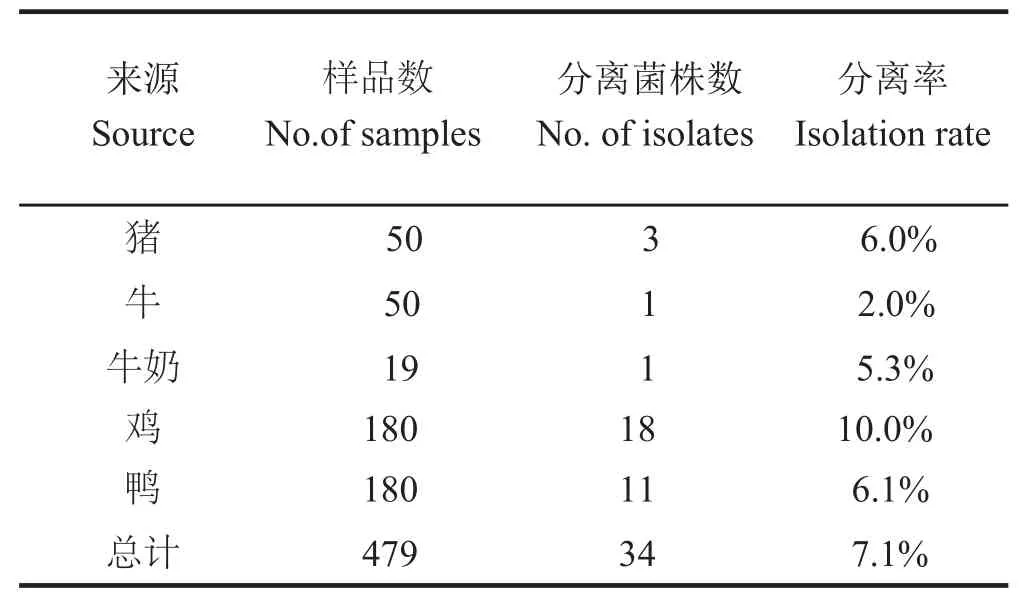
表 2 LM 在不同样品中的分布Table 2 Distribution of LM strains in the different samples

图 1 单增李斯特菌 hly 基因扩增结果Fig.1 The PCR amplification result of hly gene of Listeria monocytogenes
2.2 药敏试验结果 选用β-内酰胺类抗生素、氨基糖苷类抗生素、四环素类抗生素、氯霉素类抗生素、大环内酯类抗生素、喹诺酮类药物抗菌药物对分离得到的LM分离株进行药敏试验,结果见表3。结果表明LM分离株对氨苄青霉素和万古霉素均敏感;对头孢曲松的耐药性最高(55.88%),林可霉素次之(41.18%)。
2.3 LM的血清型分型 采用PCR方法对LM菌株进行血清型分型,结果显示血清型1/2a(3a),占76.47%(26/34);血清型1/2c(3c)占17.65%(6/34);血清型1/2b(3b、7)和血清型4b(4d、4e)各占2.94%(1/34)(表4)。结果表明,上海市动物源性食品中主要污染致病性较弱的1/2a(3a)血清型LM。
2.4 生物被膜形成能力分析 利用96孔微孔板法定量分析LM的生物被膜形成能力,结果显示所有的LM分离株能形成生物被膜,其中5.9%(2/34)LM分离株具有强生物被膜形成能力;17.6%(6/34)LM分离株具有中等生物被膜能力;76.47%(26/34)LM分离株具有微弱形成生物被膜能力(图2,表4)。
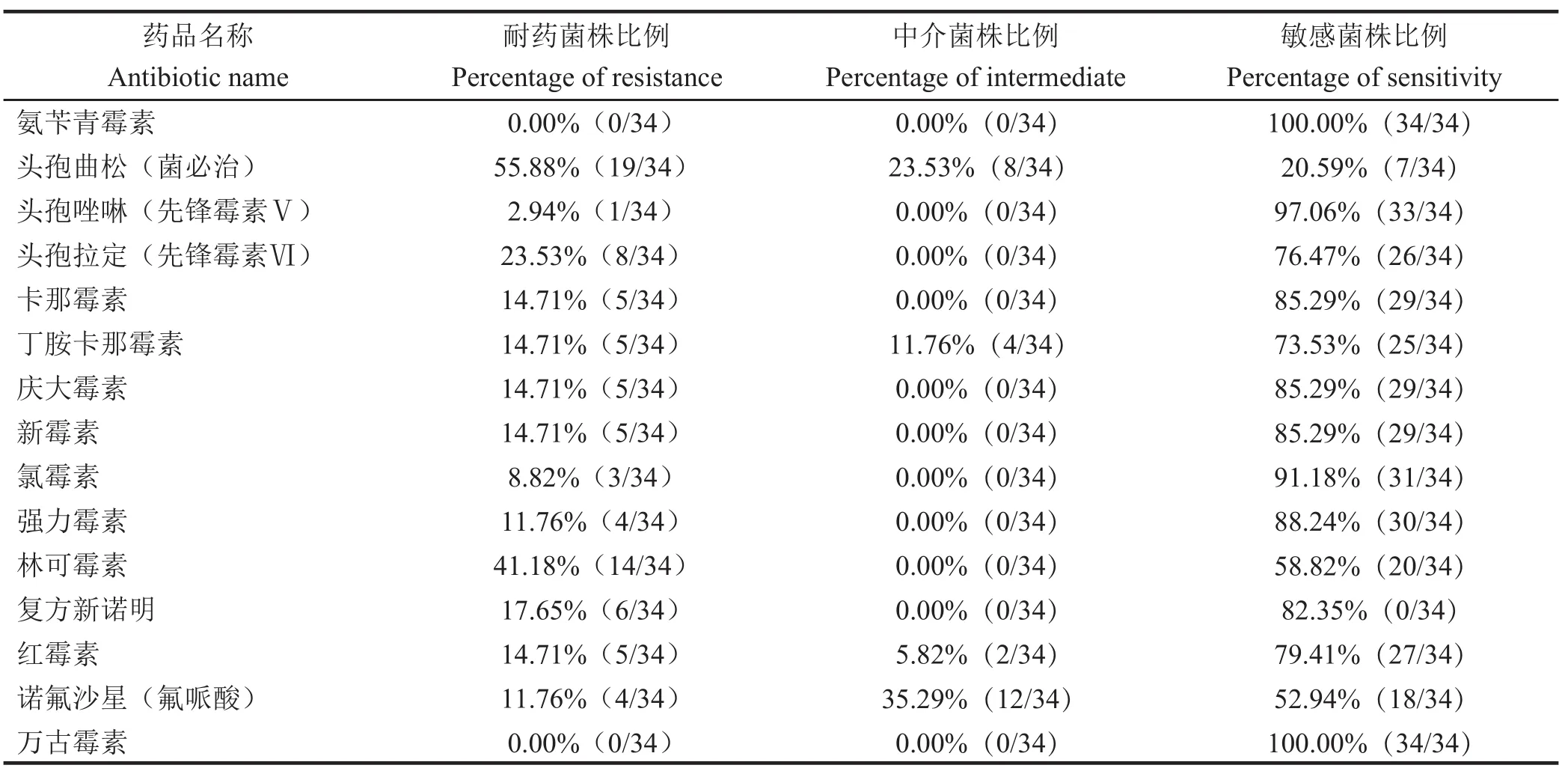
表 3 LM 药敏试验结果Table 3 Results of antibiotic sensitivity test of LM isolates

表 4 单增李斯特菌的血清型、生物被膜形成能力及来源分析Table 4 The serotype, biofilm-forming capacity and source of LM strains

图 2 单增李斯特菌的生物被膜形成能力Fig.2 The biofilm formation capacities of the LM strains
3 讨论
LM是四大食源性病原菌(其他三个为沙门氏菌、大肠杆菌O157:H7、空肠弯曲杆菌)之一,能引起人畜李斯特菌病,感染后主要表现为败血症、脑膜炎和单核细胞增多等症状[5]。近年来,由LM引起的食物中毒的情况日趋严重,在欧美等地由LM造成的食物污染程度和病例已大大超过沙门菌[1-3]。本研究对上海市动物源性食品中LM流行状况进行了分析,479份样品经预增菌、分离鉴定,最终分离得到34株LM,分离率为7.1%(34/479)。所采集的5类样品中均分离到了LM,其中鸡的副产品中分离率最高(表2)。国内不同研究人员对全国各地食品中LM污染情况进行了调查,结果表明LM分离率不尽相同,但在生肉中分离率都较高[10]。靳晓燕等[11]的研究结果显示保定地区生肉污染率高达32.4%。国外研究人员对不同样品中的LM污染情况进行了分析,显示不同地区的食品中均不同程度存在LM污染[3,12,13]。由此表明,LM在食品中污染较为严重,威胁着食品安全和人类健康。
近年来,由于抗生素的广泛过量使用导致细菌(包括各类食源性病原菌)的耐药性日益严重,给临床用药带来很大困难。本研究对LM分离株的耐药性进行了分析,结果表明LM分离株对多数抗生素耐药性不高,其中对氨苄青霉素和万古霉素菌完全敏感。与其他研究[14]相比,LM对抗生素的耐药性逐渐增加,可能是由为动物养殖过程中抗生素的不合理使用导致的。血清分型是一种传统的细菌分型方法,LM分为16个血清型,其中血清型4b毒力最强,引起绝大多数暴发病例,而血清型1/2a通常在食品中分离率最高[15,16]。本研究采用PCR方法对分离得到的LM进行分型,结果表明动物源性食品中LM主要是血清型1/2a(3a),占总分离株的76.47%,血清型1/2c(3c)次之,而致病力最强的4b较少,与国内外报道的结果基本一致[3,12,13]。生物被膜是细菌为适应外界环境变化而选择的一种与浮游形式不同的生长方式,主要由附着于惰性或活性实体表面的细菌细胞和包裹着细菌的水合性基质所组成的结构性细菌群落。生物被膜一旦形成将很难清除,不仅能增强LM对药物的抵抗力,还可以提高LM在食品的加工、消毒处理过程中的抵抗力,威胁食品安全等[17,20]。研究表明,血清型1/2a、1/2c的生物被膜形成能力较强,但是不同血清型之间的生物被膜形成能力之间没有太大区别[21]。本研究表明,LM分离株均能够形成生物被膜,有利于LM在食品加工、存储环境中长期定殖生存,从而不断地污染动物源性食品。
通过对上海市动物源性食品的检测,发现LM污染情况较为严重,主要流行1/2a(3a)血清型,且耐药性日趋严重,已经严重威胁食品安全。生物被膜实验表明所有的LM分离株能够形成生物被膜,从而导致食品不断被LM污染。因此,应加强对食品中LM的监控,为该病的防控提供理论依据。
[1]Soto Beltran M, Gerba C P, Porto Fett A, et al. Prevalence and characterization of Listeria monocytogenes, Salmonella and Shiga toxin-producing Escherichia coli isolated from small Mexican retail markets of queso fresco[J]. Int J Environ Health Res, 2014: 1-9.
[2]Osaili T M, Al-Nabulsi A A, Shaker R R, et al. Prevalence of Salmonella serovars, Listeria monocytogenes, and Escherichia coli O157:H7 in Mediterranean ready-to-eat meat products in Jordan[J]. J Food Prot, 2014, 77(1): 106-111.
[3]Awaisheh S S. Survey of Listeria monocytogenes and other Listeria sp. contamination in different common ready-to-eat food products in Jordan[J]. Pak J Biol Sci, 2009, 12(23): 1491-1497.
[4]Liu D. Identification, subtyping and virulence determination of Listeria monocytogenes, an important foodborne pathogen[J]. J Med Microbiol, 2006, 55(Pt 6): 645-659.
[5]Mammina C, Aleo A, Romani C, et al. Characterization of Listeria monocytogenes isolates from human listeriosis cases in Italy[J]. J Clin Microbiol, 2009, 47(9): 2925-2930.
[6]Becavin C, Bouchier C, Lechat P, et al. Comparison of widely used Listeria monocytogenes strains EGD, 10403S,and EGD-e highlights genomic variations underlying differences in pathogenicity[J]. MBio, 2014,5(2): e00969-14.
[7]Kerouanton A, Marault M, Petit L, et al. Evaluation of a multiplex PCR assay as an alternative method for Listeria monocytogenes serotyping[J]. J Microbiol Methods, 2010,80(2): 134-137.
[8]Doumith M, Buchrieser C, Glaser P, et al. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR[J]. J Clin Microbiol, 2004, 42(8): 3819-3822.
[9]Stepanovic S, Cirkovic I, Ranin L, et al. Biofilm formation by Salmonella spp. and Listeria monocytogenes on plastic surface[J]. Lett Appl Microbiol, 2004, 38(5): 428-432.
[10]Chen J, Zhang X, Mei L, et al. Prevalence of Listeria in Chinese food products from 13 provinces between 2000 and 2007 and virulence characterization of Listeria monocytogenes isolates[J]. Foodborne Pathog Dis, 2009, 6(1): 7-14.
[11]靳晓燕, 韩军, 于宏伟, 等. 食品中单核增生性李斯特菌污染状况研究[J].中国食品学报, 2009, 9(1): 226-231.
[12]Kotzekidou P. Survey of Listeria monocytogenes,Salmonella spp. and Escherichia coli O157:H7 in raw ingredients and ready-to-eat products by commercial real-time PCR kits[J]. Food Microbiol, 2013, 35(2): 86-91.
[13]Gombas D E, Chen Y, Clavero R S, et al. Survey of Listeria monocytogenes in ready-to-eat foods[J]. J Food Prot, 2003,66(4): 559-569.
[14]张丽萍, 张克俭, 高涛, 等. 食源性LM血清分型及耐药性的研究[J]. 实用预防医学, 2013, 20(5): 611-613.
[15]Benjelloum O, Sanchez Alvarez J E, Rodriguez Suarez C,et al. Listeria monocytogenes: an infrequent cause of peritonitis in peritoneal dialysis[J]. Nefrologia, 2011, 31(3): 362-365.
[16]Ward T J, Usgaard T, Evans P. A targeted multilocus genotyping assay for lineage, serogroup, and epidemic clone typing of Listeria monocytogenes[J]. Appl Environ Microbiol, 2010, 76(19): 6680-6684.
[17]Takahashi H, Miya S, Igarashi K, et al. Biofilm formation ability of Listeria monocytogenes isolates from raw ready-to-eat seafood[J]. J Food Prot, 2009, 72(7): 1476-1480.
[18]Rodriguez A, Autio W R, McLandsborough L A. Effect of biofilm dryness on the transfer of Listeria monocytogenes biofilms grown on stainless steel to bologna and hard salami[J]. J Food Prot, 2007, 70(11): 2480-2484.
[19]Wong A C. Biofilms in food processing environments[J]. J Dairy Sc, 1998, 81(10): 2765-2770.
[20]Schlegelova J, Karpiskova S. Microbial biofilms in the food industry[J]. Epidemiol Mikrobiol Imunol, 2007, 56(1): 14-19.
[21]Harvey J, Keenan K P, Gilmour A. Assessing biofilm formation by Listeria monocytogenes strains[J]. Food Microbiol, 2007, 24(4): 380-392.
EPIDEMIOLOGY AND BIOFILM-FORMATION CAPACITY OF LISTERIA MONOCYTOGENES FROM ANIMAL ORIGIN FOOD IN SHANGHAI
WANG Shao-hui, LIU Ping-ping, WEI Jian-chao, SHAO Dong-hua,SHI Zi-xue, LI Bei-bei, MA Zhi-yong
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
This study was performed to investigate the contamination of Listeria monocytogenes (LM) in animal origin food in Shanghai, which gained further insights on the public health risk caused by this food borne pathogen. A total of 479 animal origin food samples were screened for LM. Then, the antibiotic sensitivity, serotype and biofilm formation of each isolate were determined. The results showed that 34 LM strains were isolated from 479 samples, which accounted for 7.1%. The antibiotics resistance tests showed that resistant rate of LM isolates were not high. All LM isolates were sensitive to ampicillin and vancomycin. However, 55.88% isolates were resistant rate to ceftriaxone, followed by lincomycin (41.18%). Serotying results showed that 76.47% LM strains were belonged to serovar 1/2a(3a), followed by serovar 1/2c(3c). Whereas, only one isolate (2.94%) was the pathogenic serotype 4b(4d、4e). Bioilm formation assays showed that all the LM isolates could produce biofilm, in which 76.47%(26/34)were weak biofilm producers. These results indicated that animal origin food was contatiminated by LM, and the biofilm will increase the chances of LM contamination. Thus, it is necessary to inspect and survey the contamination by LM on farms and in abattoirs to reduce the incidence of foodborne infections in humans.
Listeria monocytogenes; resistance antibiotics; serotype; biofilm
S852.615
A
1674-6422 (2015)04-0031-06
2015-03-04
国家自然科学基金(81201266)
王少辉,男,副研究员,主要从事畜禽细菌性传染病研究
马志永,E-mail:zhiyongma@shvri.ac.cn

