6分钟步行试验及联合检测的生化标志物在AECOPD预后评价中的应用价值
张晓磊 许爱国
(1.郑州大学第一附属医院 呼吸与危重症医学科 河南 郑州 450000;2.禹州市第二人民医院 呼吸科 河南 许昌 461670)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)目前占世界死亡率第4位,预计在2020年将上升至第3位[1]。该病造成的死亡率、致残率逐渐上升,而本身并未引起足够的关注。慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)患者短时间内咳嗽、咳痰、喘息及胸闷等症状加重,不仅增加了患者的经济负担,还加速肺功能减退,大大降低了患者的生活质量,死亡率明显升高[2-3]。目前对AECODP严重性的评估多依赖于临床症状,尚缺乏评价AECOPD严重性、敏感性和特异性的生物学指标[4]。为此笔者收集郑州大学第一附属医院2012年12月至2014年12月收治的78例AECOPD患者资料,回顾性分析短期预后的相关因素,筛选最佳指标,并评估联合检测的价值,以便进行AECOPD危险分层及管理。
1 资料及方法
1.1 一般资料 本研究选取2012年12月至2014年12月郑州大学第一附属医院住院治疗的78例AECOPD患者。纳入标准:符合2013年由中华医学会呼吸病学会慢性阻塞性肺疾病学组《慢性阻塞性肺疾病诊治指南》[5]。排除标准:①合并近期手术、外伤、认知障碍的患者;②合并肺栓塞、哮喘、活动性肺结核的患者;③采集前已行抗感染、止咳及平喘等治疗;④未能取得足够的临床样本(血清样本、肺功能相关指标);⑤未能完成随访的患者。
1.2 6分钟步行试验(6 minute walk distance,6MWD)及血液生化标志物检查 6MWT是在特定的环境中,测量患者6 min之内步行的距离,以此来评价心肺功能。血液生化标志物为急诊检查或入院后次日清晨检查结果,如24 h内有>1次检查,则选用异常程度高者。动脉血气使用上海雅培公司的i-STAT1手持式血液血气分析仪;凝血实验则采用酶联免疫分析法,使用Bekman-Coulter公司ACL3000全自动凝血分析仪检测;CRP的测定采用免疫反应比浊法,而PCT及ESR则采用免疫发光法试剂,分别为德国BRAHMS公司的PCT全定量检测试剂盒、美国雅培公司的ESR全定量检测试剂盒;血常规利用日本东亚五分类血球分析仪。所有操作严格遵照操作手册进行。
1.3 终点事件 随访6个月,以死亡为随访终点。
1.4 统计学处理 采用SPSS 19.0统计软件分析,应用t检验、U检验及χ2检验,单变量分析中有差异的变量应用ROC曲线筛选出价值较高者,并计算出最佳分界值,Logistic进行终点事件的多变量回归。
2 结果
2.1 基本情况 本研究共收集AECOPD患者215例,依据排除标准剔除137例,最终入选78例患者。其中男43例,女35例,死亡患者31例。平均随访时间139 d。根据终点事件将患者分为好转组和死亡组。好转组及死亡组两组患者的年龄、性别差异无统计学意义(P>0.05),6MWT比较差异有统计学意义(P<0.05)。见表1。
表1 两组患的性别、年龄及6MWT比较(±s)

表1 两组患的性别、年龄及6MWT比较(±s)
注:与死亡组比较,a P<0.05。
组别 n 性别男 女年龄/岁6MWT/m好转组 47 32 15 67.10±9.80 310.00±21.70 a死亡组31 11 20 69.80±13.10 132.10±16.10
2.2 血液生化标志物评价 两组患者动脉血气中pH值、PaCO2比较,差异有统计学意义(P<0.05);死亡组血凝试验中INR、FIB、D-二聚体(D-D)较好转组明显升高,差异有统计学意义(P<0.05);死亡组PCT、CRP、ESR、WBC、RDW、NT-pro-BNP水平高于好转组,差异有统计学意义(P<0.05)。见表2。将两组有显著差异的变量进行Logistic多变量回归分析,只有6WMT、NT-pro-BNP是独立危险因素(P<0.05)。全部患者主要终点事件6WMT、NT-pro-BNP、D-D和RDW有较高的ROC曲线下面积[分别为0.895(95%CI:0.667,0.993)、0.815(95%CI:0.582,0.897)、0.725(95%CI:0.670,0.920)和0.798(95%CI:0.515,0.932)],表明对AECOPD严重程度的诊断价值较高。
表2 两组患者血液生化标志物水平比较(±s)
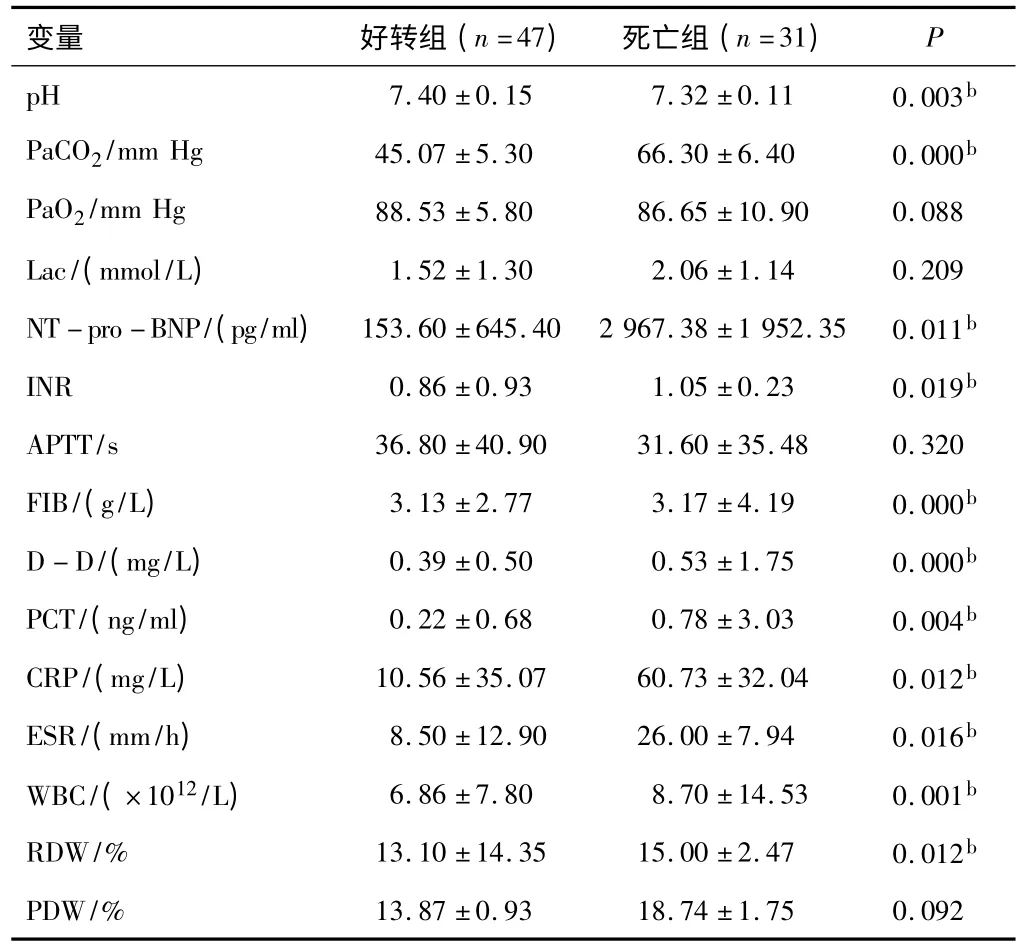
表2 两组患者血液生化标志物水平比较(±s)
注:与死亡组比较,b P<0.05。
变量 好转组(n=47) 死亡组(n=31)P pH 7.40±0.15 7.32±0.11 0.003 b PaCO2/mm Hg 45.07±5.30 66.30±6.40 0.000b PaO2/mm Hg 88.53±5.80 86.65±10.90 0.088 Lac/(mmol/L) 1.52±1.30 2.06±1.14 0.209 NT-pro-BNP/(pg/ml) 153.60±645.40 2 967.38±1 952.35 0.011b INR 0.86±0.93 1.05±0.23 0.019b APTT/s 36.80±40.90 31.60±35.48 0.320 FIB/(g/L) 3.13±2.77 3.17±4.19 0.000b D-D/(mg/L) 0.39±0.50 0.53±1.75 0.000b PCT/(ng/ml) 0.22±0.68 0.78±3.03 0.004b CRP/(mg/L) 10.56±35.07 60.73±32.04 0.012b ESR/(mm/h) 8.50±12.90 26.00±7.94 0.016b WBC/(×1012/L) 6.86±7.80 8.70±14.53 0.001b RDW/% 13.10±14.35 15.00±2.47 0.012b PDW/% 13.87±0.93 18.74±1.75 0.092
2.3 相关性分析 PCT分别与ESR、CRP亦有显著相关,r分别为0.547(P<0.001)、0.402(P=0.002),其他参数之间无显著相关性。
3 讨论
随着环境污染,人口老龄化,全世界范围内AECOPD的患病率和死亡率不断增高,该病已成为重要的公共卫生问题。早在2007年中华医学会呼吸病学慢性阻塞性肺疾病学组颁布的COPD指南表示AECOPD的预后与患者加重前病史、症状、体征、动脉血气及合并症有很大关系,但因其指标多,且操作不便,无规范化的量化标准,因此,无法快速、准确评价患者病情严重程度及预后。
6MWT是1968年由美国医学专家Cooper[6]提出应用12 min跑步评价肺功能演变而来的,然而12 min步行试验因患者易感疲劳等因素而被6WMT取代。直至2002、2005及2007年美国心脏协会颁布的《慢性心力衰竭诊断和治疗指南》中将其作为评定心功能的一项指标。6WMT受鼓励语言的方式、走廊长度、试验次数及年龄、身高、体质量和性别等因素影响,健康男性与健康女性的6MWD分别约为576 m和494 m。2010年武伟华等[7]汇总分析发现,6MWD分别与FEV1%pred呈正相关,与BMI和MMRC呈明显负相关。该研究表明6MWT可评价COPD患者病情,用于监测患者的日常病情变化。又因为其受多种因素影响,因此可作为肺功能分级的补充,暂不推荐单独应用病情评价。本研究中,6MWT是短期预后的独立危险因素,多变量分析中,仍独立于生化标志物而成为独立危险因素,且阳性预测值、阴性预测值均较高,与相关研究得出的6WMT可以很好预测危重患者预后的结论一致。说明6MWT能够反映危重患者的整体风险,在对短期预后评价中能够独立于生化标志物成为有效补充,同时也可以作为最有效的短期预后评价方法之一,能够被融合到AECOPD的危险分层中。然而6MWT涉及因素较多,不只单纯反应呼吸系统疾病严重性,因此只能作为一个辅助判断的指标。
低氧血症和高碳酸血症的程度是最直观的判断AECOPD严重性的指标,应用最广泛的是PaO2和PaCO2[8]。在本研究中,尽管死亡组与好转组之间PaO2和PaCO2差异有统计学意义,但在判断AECOPD预后的价值尚不肯定。COPD患者长期缺氧,可致使血管内皮损伤释放因子收缩血管,引起血流缓慢;其次红细胞代偿性增高,血液粘滞度增高,进一步引起血流缓慢,使机体处于高凝状态。内毒素诱使AECOPD患者出现强烈炎症反应和凝血功能异常,进一步促进机体血液高凝[12-14]。本研究结果显示,两组患者INR、FIB、D-D差异均有统计学意义,提示死亡组患者血液处于高凝状态,与既往研究具有一致性。两组患者PCT、CRP、ESR、WBC与RDW差异亦有统计学意义。相关报道提示,PCT联合CRP在判断细菌感染及指导抗生素合理利用方面具有重要参考价值[15]。任薇等[16]评价了AECOPD患者5种生化标志物,发现其中ESR对于评估病情具有较好的灵敏度。常春等[17]发现选取PCT>0.25 ng/ml为截断值,灵敏度较高(93.3%),特异性及阳性预测值较低。本研究中,发现PCT分别与ESR、CRP呈正相关,但在短期预后评价中无明显阳性意义。而Lacoma等[18]发现PCT及CRP与短期预后恶化事件相关联,可以用于AECOPD的管理。死亡组RDW较高,ROC曲线下面积0.778,且最佳分界值为77.8%,但对预后评价价值不高。NT-pro-BNP的ROC曲线下面积大,提示评价AECOPD严重程度准确性高,最佳分界值为2 375.00 pmol/L,与既往研究与共识有相似的分界值,具有很高的评估价值[9-11],且Logistic多变量分析结果指出NT-pro-BNP为AECOPD独立危险因素,提示NT-pro-BNP与短期死亡相关。因此,NT-pro-BNP在评估病情预后较其他生化指标优势明显。
综上所述,AECOPD的预后受到患者基础情况及肺部病情严重程度两方面的影响,短期风险与基础情况有显著关联。6MWT能够反映AECOPD的整体风险,短期预后能够独立于生化标志物而成为有效补充,长期预后还需要进一步探讨,可以考虑融入AECOPD的综合风险评价中。在AECOPD短期预后评价中,生化标志物NT-pro-BNP有较高评估价值,较其他生化标志物检查更好。因此,6MWT联合NT-pro-BNP可以作为评估预后评估的重要指标。
[1]Ni W,Shao X,Cai X,et al.PropHylactic use of macrolide antibiotics for the prevention of chronic obstructive pulmonary disease exacerbation:a meta-analysis[J].PLoSOne,2015,10(3):e121257.
[2]Seemungal T A,Wedzicha J A,Maccallum P K,et al.Chlamydia pneumoniae and COPD exacerbation[J].Thorax,2002,57(12):1087-1088,1088-1089.
[3]Donaldson G C,Wilkinson T M,Hurst J R,et al.Exacerbations and time spent outdoors in chronic obstructive pulmonary disease[J].Am JRespir Crit Care Med,2005,171(5):446-452.
[4]Seemungal T A,Harper-Owen R,Bhowmik A,et al.Detection of rhinovirus in induced sputum at exacerbation of chronic obstructive pulmonary disease[J].Eur Respir J,2000,16(4):677-683.
[5]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4):255-264.
[6]Cooper K H.A means of assessing maximal oxygen intake.Correlation between field and treadmill testing[J].JAMA,1968,203(3):201-204.
[7]武伟华,陈冉,孟玲,等.6分钟步行试验、BMI及MMRC对评价COPD病情严重程度的意义[J].泰山医学院学报,2013,34(10):15-18.
[8]Terzano C,Romani S,Gaudio C,et al.Right heart functional changes in the acute,hypercapnic exacerbations of COPD[J].Biomed Res Int,2014,2014:596051.
[9]Li X,Chen C,Gan F,et al.Plasma NT pro-BNP,hs-CRPand big-ET levels at admission as prognostic markers of survival in hospitalized patients with dilated cardiomyopathy:a single-center cohort study[J].BMC Cardiovasc Disord,2014,11(14):67.
[10]Braunwald E.Biomarkers in heart failure[J].N Engl J Med,2008,358(20):2148-2159.
[11]Park SY,Lee C Y,Kim C,et al.One-year prognosis and the role of brain natriuretic peptide levels in patients with chronic cor pulmonale.[J].J Korean Med Sci,2015,30(4):442-449.
[12]Polosa R,Malerba M,Cacciola R R,et al.Effect of acute exacerbations on circulating endothelial,clotting and fibrinolytic markers in COPD patients[J].Intern Emerg Med,2013,8(7):567-574.
[13]Sabit R,Thomas P,Shale D J,et al.The effects of hypoxia on markers of coagulation and systemic inflammation in patients with COPD[J].Chest,2010,138(1):47-51.
[14]Wiseman S,Marlborough F,Doubal F,et al.Blood markers of coagulation,fibrinolysis,endothelial dysfunction and inflammation in lacunar stroke versus non-lacunar stroke and non-stroke:systematic review and meta-analysis[J].Cerebrovasc Dis,2014,37(1):64-75.
[15]Stolz D,Christ-Crain M,Bingisser R,et al.Antibiotic treatment of exacerbations of COPD:a randomized,controlled trial comparing procalcitonin-guidance with standard therapy[J].Chest,2007,131(1):9-19.
[16]任薇,王胜,季红燕.超敏C反应蛋白、前白蛋白检测在AECOPD中的临床价值[J].临床肺科杂志,2014,(8):1419-1421.
[17]常春,姚婉贞,陈亚红,等.慢性阻塞性肺疾病患者急性加重期血清降钙素原水平的变化及临床意义[J].中华结核和呼吸杂志,2006,29(7):444-447.
[18]Lacoma A,Prat C,Andreo F,et al.Value of procalcitonin,C-reactive protein,and neopterin in exacerbations of chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis,2011,(6):157-169.

