不育紫薇‘湘韵’扦插过程中内源激素含量变化
乔中全, 王晓明, 曾慧杰, 李永欣, 蔡 能, 王湘莹
(1.湖南省林业科学院, 湖南 长沙 410004; 2.中南林业科技大学 生命科学与技术学院, 湖南 长沙 410004)
不育紫薇‘湘韵’扦插过程中内源激素含量变化
乔中全1, 王晓明1, 曾慧杰1, 李永欣1, 蔡 能1, 王湘莹2
(1.湖南省林业科学院, 湖南 长沙 410004; 2.中南林业科技大学 生命科学与技术学院, 湖南 长沙 410004)
以不育紫薇‘湘韵’半木质化枝条为试材,使用植物生长激素KIBA对插穗进行处理,采用酶联免疫吸附测定法测定不同生根时期内源激素IAA、ABA、GA3、ZR含量,研究‘湘韵’紫薇扦插生根过程中内源激素含量的变化。结果表明:不育紫薇扦插生根过程中插穗内源激素含量与不定根的分化与形成密切相关,高浓度的内源IAA有利于插穗根原基分化形成及生长发育;低浓度的内源ABA有助于不育紫薇的扦插生根;高浓度的内源GA3抑制了不育紫薇插条不定根的形成;内源ZR在根原基分化形成与根的伸长两个时期的作用不同,低浓度的内源ZR促进根原基分化形成,而较高浓度的内源ZR有利于根的伸长;高的IAA/ABA值有利于扦插过程中根原基的分化与形成,低的IAA/ABA值促进扦插过程中不定根的伸长;高水平的IAA/ZR值有助于根原基分化形成,较低的IAA/ZR值有利于不定根的伸长;低水平的GA3/ABA值有利于根原基的分化形成,较高的GA3/ABA值促进不定根的伸长。
不育紫薇‘湘韵’; 扦插; 内源激素
不育紫薇‘湘韵’(Lagerstroemiaindica‘Xiang Yun’)是湖南省林业科学院选育出来的紫薇新品种,花期长达120多天,花色为粉红色,不育。‘湘韵’具有不育的特性,减少了营养物质的消耗,因此增加了后期开花量与生长量,具有很高的观赏价值与应用前景。
目前国内关于紫薇扦插技术的研究已有很多报道,例如宋满坡等[1]以‘玫红’紫薇、‘矮化紫薇’为材料,研究了不同质量浓度的生根剂在紫薇扦插生根过程中的影响;朱志祥等[2]以‘Lagerstroemiafauriei’为研究材料,研究了不同因子在紫薇扦插过程中对生根及生长的影响;王晓明等[3]研究了美国红叶紫薇扦插繁殖技术,关于不育紫薇扦插过程中内源激素变化的研究尚未见报道。本研究以不育紫薇‘湘韵’半木质化枝条为试材,使用植物生长激素KIBA对插穗进行处理,应用酶联免疫吸附测定法对紫薇扦插生根过程中不同生根时期的内源激素IAA、ABA、GA3、ZR的含量进行测定,研究‘湘韵’紫薇扦插生根过程中内源激素含量变化及其相互平衡关系,旨在探明不育紫薇扦插生根的生化机理,为不育紫薇扦插繁殖技术的建立奠定基础。
1 材料与方法
1.1 试验材料
插穗采自湖南省林业科学院试验林场紫薇园内生长健壮的不育紫薇‘湘韵’的半木质化枝条,扦插试验在全光照自动间歇喷雾大棚中进行。植物生长激素是吲哚丁酸钾盐(KIBA)。
1.2 试验方法
选择母株上无病虫害、生长健壮的枝条,并将枝条及时剪成5~10 cm插条,每个插条上保留2个叶片,为减少水分的蒸腾,将保留的叶片剪去1/2。扦插基质为泥炭土+珍珠岩(8∶2),先将装满基质的营养钵浇透消毒水,然后将KIBA 2 000 mg/L处理过的插条插入营养钵中,最后将营养钵放在大棚的苗床上,以未处理过的插条作为对照。
扦插当日取样1次,扦插后根据其生长情况,每隔1天取样1次,液氮保存,共取样6次。采用酶联免疫吸附测定法(ELISA)测定不同的内源激素含量,根据其显色值的logit值从图上查出其所含激素质量浓度(ng/mL)的自然对数,再经过反对数即可知其激素的质量浓度(ng/mL)。根据质量浓度再计算样品中激素的含量(ng/g)。
2 结果与分析
2.1 内源IAA在扦插生根过程中的变化
不定根的形成一般分为两个时期,即根原基分化形成期和根原基生长发育期[4]。在不育紫薇‘湘韵’扦插生根过程中,插穗扦插后0~3天为根原基分化形成的前期,3~5天为根原基分化形成期,6~11天为根原基的生长发育期。
大量研究认为内源IAA是促进不定根形成的主要激素[5],内源IAA与根原基的发生密切相关,与新的形成层位点诱导和第1次细胞分裂的启动有关[6-7]。由图1可见,不育紫薇‘湘韵’扦插后第1~5天,在外源激素KIBA的诱导下,内源IAA的质量浓度急剧增长,第5天达到峰值,从最初插穗中的4 205.67 ng/g,增加到6 589.57 ng/g,增长了56.68 %。而对照在扦插初期(1~5天)的内源IAA含量则呈缓慢增加的趋势。扦插后第1~5天,处理的内源IAA平均质量浓度为5 476.07 ng/g,对照的内源IAA平均质量浓度为4 410.09 ng/g,处理比对照高19.5%,说明不育紫薇‘湘韵’在扦插生根过程中较高浓度的内源IAA有利于根原基分化形成。在不定根的伸长时期,处理的内源IAA含量下降,扦插第9天降到最低点,质量浓度为4 234.2 ng/g,随后回升,而对照的内源IAA含量变化不大,有小幅回升,反映了根原基的分化形成和不定根的伸长两个时期对内源IAA的需求量不同,较高浓度内源IAA有利于扦插过程中根原基的分化与形成,这跟Lavel PH等人报道的欧州甜樱桃(Prunusavium)外植体根原基生长发育期的内源IAA含量变化一致[8]。
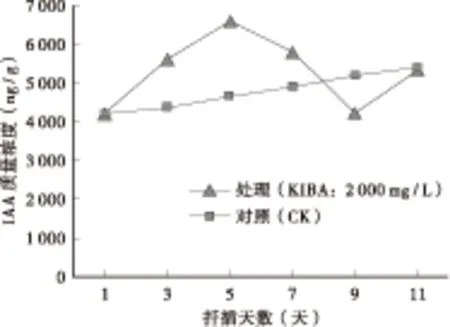
图1 扦插生根过程中内源IAA的变化Fig.1 Change of endogenous hormones IAA in rooting
2.2 内源GA3在扦插生根过程中的变化
大量实验数据表明,赤霉素(GA3)在植物扦插生根过程中抑制不定根的形成,即使是低质量浓度(10-8mo1/L)的GA3也抑制不定根形成[9-10]。GA3抑制不定根形成可能有多条途径,一是GA3抑制形成根原基细胞的分裂[11];二是GA3阻碍生长素诱导的根原基进一步生长发育[12]。由图2可见,在不育紫薇‘湘韵’扦插生根过程中,GA3含量的变化大体呈现出“升高-降低-升高”的趋势。扦插后第0~3天(根原基分化形成之前),处理和对照的内源GA3含量都增加,处理的内源GA3质量浓度增长比较快,由起初的1 541.71 ng/g,增长到3 414.66 ng/g,增长了121.5%;而对照的内源GA3则增长缓慢,由起初的1 541.71 ng/g,增长到1 829.85 ng/g,增长了18.7%。在根原基分化形成期(扦插后第3~5天),处理与对照的内源GA3质量浓度变化趋势完全相反,处理组快速下降,由起初的3 414.66 ng/g,下降到2 645.77 ng/g,下降了22.5%;对照组则快速增长,由起初的1 829.85 ng/g,增长到2 901.33 ng/g,增长了58.6%。在不定根的伸长时期,对照和处理都持续下降;下降趋势在第7天后开始变缓,第9天后,随着不定根快速伸长,两者的内源GA3含量均开始回升,但处理比对照的内源GA3增长的多些。这说明低含量的内源GA3在扦插生根过程中有利于根原基的分化形成。
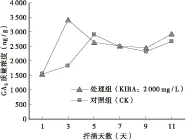
图2 扦插生根过程中内源GA3的变化Fig.2 Change of endogenous hormones GA3 in rooting
2.3 内源ABA在扦插生根过程中的变化
ABA对植物生根起着重要作用,是植物体内的天然抑制性激素,它能抑制顶芽生长,有利于植物体内营养物质的积累和运输[5]。由图3可以看出,处理的不育紫薇内源ABA含量明显低于对照,扦插后第0~7天对照的内源ABA质量浓度逐步增加,在第7天达到最高值3 743.41 ng/g,并维持在高位,随后开始下降。处理的内源ABA含量在扦插后第0~5天也逐步增长,但明显低于对照组,最高质量浓度为2 437.87 ng/g,与对照相比减少了34.9%;处理的内源ABA在不定根的伸长时期有明显下降,这说明低质量浓度的内源ABA有利于不育紫薇‘湘韵’插穗生根。
2.4 内源ZR在扦插生根过程中的变化
实验研究表明,细胞分裂素(ZR)主要作用是抑制植物根原基的分化与形成[13-14]。由图4可以看出,扦插后第0~3天(根原基分化形成之前),处理与对照比最初插穗的内源ZR含量略微增加,两者的ZR含量差别不大;进入到根原基分化形成期,处理的内源ZR质量浓度由528.87 ng/g下降到326.25 ng/g,下降了38.3%;对照内源ZR含量却持续增长,在不定根伸长初期(扦插后第6-7天),处理的内源ZR含量没有什么变化,保持低水平,而对照却大幅下滑至低谷,随后先升后降,两者差距不大。以上说明,根原基分化形成期受内源ZR的影响比不定根伸长的时期大,较低质量浓度的内源ZR有利于不育紫薇‘湘韵’扦插根原基的分化形成,跟唐玉林等人的实验结果一致[15]。

图3 扦插生根过程中ABA的变化Fig.3 Change of endogenous hormones ABA in rooting
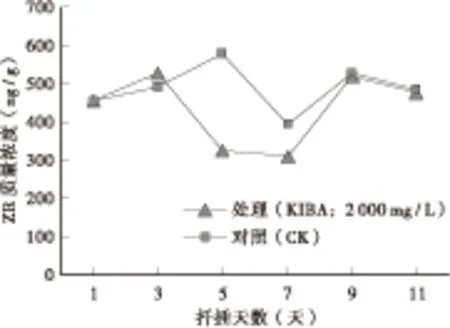
图4 扦插生根过程中ZR的变化Fig.4 Change of endogenous hormones ZR in rooting
2.5 IAA/ABA值在扦插生根过程中的变化
普遍认为不定根的形成与植物激素间相互平衡及含量密切相关。由图5可以看出,不育紫薇‘湘韵’扦插过程中,在扦插后第1~5天,处理的IAA/ABA值增加,在扦插后第5天达到峰值,而对照的IAA/ABA值则缓慢降低,说明不育紫薇‘湘韵’扦插过程中根原基的分化形成阶段需要有较高的IAA/ABA值。在不定根的伸长时期,对照的内源IAA/ABA值变化不大,小幅回升,而处理IAA/ABA值降低,扦插后第9天达到最低点,随后小幅回升,说明了在不育紫薇‘湘韵’扦插生根过程中根原基的分化形成和不定根的伸长两个时期对IAA/ABA值不同,较高的IAA/ABA值有利于扦插过程中根原基的分化与形成,低水平的IAA/ABA值促进扦插过程中不定根的伸长。
2.6 IAA/ZR值在扦插生根过程中的变化
大量实验证实,植物扦插生根过程不仅与内源IAA和内源ZR含量有关,而且与两者的比值变化关系更密切,IAA/ZR值对植物不定根的形成有一定的调节作用。从图6可见,在不育紫薇‘湘韵’扦插过程中,扦插后第1~5天,处理的IAA/ZR值急剧上升,扦插后第5天出现峰值;而对照的IAA/ZR值则缓慢降低,说明外源激素KIBA刺激插穗中IAA/ZR值升高,根原基的分化形成阶段需要较高IAA/ZR值。在不定根伸长期,处理的IAA/ZR值下降,扦插后第9天达到最低点,随后回升,对照的IAA/ZR值变化不大,小幅回升,这表明,高的IAA/ZR值促进根原基分化形成,低的IAA/ZR值有助于不定根的伸长。

图5 扦插生根过程中IAA/ABA的变化Fig.5 Change of IAA/ABA in rooting

图6 扦插生根过程中IAA/ZR的变化Fig.6 Change of IAA/ZR in rooting
2.7 GA3/ABA值在扦插生根过程中的变化
大量研究证明,ABA能增加不定根的发根率及根长,GA3则抑制扦插过程中不定根的形成,内源ABA为内源GA3的天然拮抗剂,并且GA3/ABA值跟不定根的形成密切相关。由图7可见,不育紫薇‘湘韵’扦插生根过程中,对照与处理的GA3/ABA值变化不同。在进入根原基分化形成之前(扦插后第0~3天),处理的GA3/ABA值急剧上升,对照的GA3/ABA值下降;在根原基分化形成期(扦插后第3~5天),处理的GA3/ABA值下降,对照的GA3/ABA值上升;在不定根伸长阶段(扦插后第6~11天),处理的GA3/ABA值呈缓慢增长趋势,对照的GA3/ABA值先下降后缓慢上升。此结果说明低水平的GA3/ABA值有利于不育紫薇‘湘韵’扦插生根过程中根原基的分化形成,较高的GA3/ABA值促进不定根的伸长。

图7 扦插生根过程中GA3/ABA的变化Fig.7 Change of GA3/ABA in rooting
3 结论与讨论
本文通过研究不育紫薇扦插生根过程中内源激素含量的变化,探究了不育紫薇‘湘韵’扦插生根的生理生化机理。研究结果表明,不育紫薇在扦插生根过程中,插条的内源IAA、GA3、ZR和ABA含量及其相互间的平衡关系与不定根形成与生长密切相关。低浓度的内源ABA及较高浓度的内源IAA有利于根原基分化和生根;高浓度的GA3抑制插条不定根的形成。外源生长调节剂KIBA可促进内源IAA的合成,抑制内源ABA合成及降低GA3的含量。因此,使用KIBA速蘸插条基部,可促进其生根。在扦插生根过程中,内源ZR在不同时期的作用不同,李永欣等[16]认为在根原基生长发育期需要较高浓度的ZR,而在根原基分化形成期则需要较低浓度的ZR。较高的IAA/ABA值有利于扦插过程中根原基的分化与形成,低水平的IAA/ABA值促进扦插过程中不定根的伸长;高的IAA/ZR值促进根原基分化形成,低的IAA/ZR值有助于不定根的伸长;低水平的GA3/ABA值有利于不育紫薇‘湘韵’扦插生根过程中根原基的分化形成,较高的GA3/ABA值促进不定根的伸长。
本研究利用不育紫薇‘湘韵’的半木质化枝条进行扦插生根机理研究,获得一定数据,为不育紫薇扦插繁殖技术的建立奠定一定基础。研究植物扦插生根的机理是一项复杂的工程,影响生根的生理生化因素是多方面的,其它的生理生化指标有待进一步研究。
[1] 宋满坡.不同浓度的ABT·GGR和NNA对矮化紫薇扦插生根的影响[J].安徽农业科学,2009,37(27):13045-13046.
[2] 朱志祥,蒋伟,刘燕.福利埃氏紫薇扦插繁殖技术试验[J].江苏林业科技,2005,32(4):28-29.
[3] 王晓明,李永欣,余格非,等.紫薇新品种及繁殖技术[J].中国城市林业,2008,6(1):79-80.
[4] 王乔春.植物激素与插条不定根的形成[J].四川农业大学学报,1992,10(1):33-29.
[5] Li H H,Pan R C.Hormone control of adventitious rooting in mung bean stem cu Rings[C].XV International Botanical Congress,Japan Pacifico Yokohama,1993:6183.
[6] 潘瑞炽,李玲.植物生长发育的化学调控[M].(2版).广州:广东高等教育出版社,l998.
[7] Blakesley D,Chaldecott M A.The role of endogeneous auxin in root initiation.II. Sensetivity and evidence from studies on transgenic plant tissues[J].Plant Growth Regul,1993,13:77-84.
[8] Label P H ,Sotta B,Minginiac E.Endogenous levels of ABA and IAA during in vitro rooting of wild cherry explants produced by micropropagation[J].Plant Growth Regul,1989(8):325-333.
[9] 王金祥,严小龙,潘瑞炽.不定根形成与植物激素的关系[J].植物生理学通讯,2005,41(2):133-142.
[10] Li HH,Pan RC.Hormone control of adventitious rooting in mung bean stem curing[C].XV International Botanical Congress,Japan Pacifico Yokohama,1993:618-623.
[11] Brran,P.W.,Hemming,H.,G.and Lowe,D.Inhibition of rooting of cuttings by gibberellic acid [J].Ann.Bot,1960,24:407-419.
[12] Haissig,B.E.Meristematic activity during adventitious root primordial development:Influences of endogenous auxin and applied gibberellic acid[J].Plant Prop,1972,32:625-638.
[13] 周燕,高述民,李凤兰.胡杨不定根原基发生的分生细胞结构特征及内源激素变化分析[J].西北植物学报,2009,29(7):1342-1350.
[14] 齐永顺,张志华,王同坤,等.同源四倍体玫瑰香葡萄嫩枝扦插不定根发生过程中内源激素的变化[J].园艺学报,2009,36(4):565-570.
[15] 唐玉林,陈婉芳,周燮.烟草叶块分化根和芽过程中内源激素水平的变化[J].南京农业大学学报,1996,19(2):12-16.
[16] 李永欣,曾慧杰,王晓明,等.光皮树扦插过程中内源激素变化[J].中国农学通报,2009,22(1):91-97.
(文字编校:张 珉)
ChangesofendogenoushormonesduringLagerstroemiaindica‘XiangYun’cutting
QIAO Zhongquan1, WANG Xiaoming1, ZENG Huijie1, LI Yongxin1, CAI Neng1, WANG Xiangying2
(1.Hunan Academy of Forestry, Changsha 410004, China;2.School of Biological Science & Technology, Central South University of Forestry and Technology, Changsha 410004, China)
The semi-hardwood branch ofLagerstroemiaindica‘Xiang Yun’ were collected and treated with KIBA.The contents of endogenous hormones IAA,ABA,GA3and ZR were measured with ELISA in different rooting periods.The results indicated that the contents of endogenous hormones in cuttings during rooting period inLagerstroemiaindica‘Xiang Yun’ was closely related with the differentiation and formation of adventitious roots.High concentrations of endogenous IAA and low concentrations of endogenous ABA was in favor of the formation of adventitious roots.High concentrations of endogenous GA3inhibited the formation of adventitious root.Low concentrations of endogenous ZR promoted the differentiation and formation of root primordial,while high concentrations of endogenous ZR promoted the root elongation.High IAA/ABA,IAA/ZR and low GA3/ABA promoted the differentiation and formation of root primordial.Low IAA/ABA,IAA/ZR and high GA3/ABA promoted the root elongation.
Lagerstroemiaindica‘Xiang Yun’; cuttings; endogenous hormones
2014-11-06
长沙市科技计划重点项目“南方珍贵木本花卉新品种繁育与产业化示范”(051003-22);湖南省林业科学院青年科研创新基金项目“不育紫薇不育机理的研究”(2013LQJ04)。
乔中全(1985-),男,山东省曹县人,实习研究员,主要从事林木遗传育种、栽培与生物技术研究。
S 685.99
A
1003 — 5710(2015)01 — 0049 — 05
10. 3969/j. issn. 1003 — 5710. 2015. 01. 012

