苯并[a]芘在两种海洋生物体内的富集动力学比较
李 磊,蒋 玫*,沈新强,王云龙,吴庆元,牛俊翔,许高鹏(.中国水产科学研究院东海水产研究所,上海 00090;.上海海洋大学海洋科学学院,上海 0306)
苯并[a]芘在两种海洋生物体内的富集动力学比较
李 磊1,蒋 玫1*,沈新强1,王云龙1,吴庆元2,牛俊翔2,许高鹏2(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学海洋科学学院,上海 201306)
应用半静态双箱动力学模型在室内模拟了脊尾白虾(Exopalaemon carinicauda)、三疣梭子蟹(Portunus trituberculatus)对苯并[a]芘(benzo[a]pyrene,BaP)的生物富集实验,通过对富集与释放过程中两种海洋生物体内BaP的非线性曲线拟合,获得两种海洋生物对BaP的吸收速率常数k1、释放速率常数k2、生物富集因子BCF、平衡状态下生物体内BaP含量CAmax、生物学半衰期B1/2等动力学参数.拟合结果显示:脊尾白虾k1的平均值为18.80,k2的平均值为0.08,BCF的平均值为228.02,CAmax的平均值为46.78ng/g,B1/2的平均值为8.95d;三疣梭子蟹k1的平均值为22.55,k2的平均值为0.14,BCF的平均值为158.11,CAmax的平均值为32.70ng/g,B1/2的平均值为5.43d.两种海洋生物对BaP的k1、k2、BCF均随BaP暴露浓度的增大而减少,CAmax、B1/2随BaP暴露浓度的增大而增大.表明BaP容易在两种海洋生物体内富集,脊尾白虾对BaP的最高富集量高于三疣梭子蟹,前期富集速率高于后期,对BaP的释放主要集中在前期,后期释放速率放缓.
脊尾白虾;三疣梭子蟹;苯并[a]芘;生物富集;动力学
多环芳烃(PAHs)是指是指2个或2个以上苯环以稠环的形式连接形成的一类典型持久性有机污染物(POPs),包括萘、蒽、菲、芘等及其衍生物达400多种[1].PAHs的来源广泛,化石燃料(煤、石油)的不完全燃烧等人类活动是其来源的主要途径[2].在世界范围内每年约有23万t进入海洋环境[3].大部分PAHs具有潜在的致癌性、致突变性和其他毒理效应,是环境中致癌化学物质中最大的一类,其中16种被美国环保署(EPA)确定为优先控制的有机污染物质,中国将其中7种列为优先控制的有机污染物质[4-5].这其中,苯并[a]芘(BaP)
是致癌性最强的PAHs,常被视为PAHs研究的指示物,通过研究它在环境中的产生、迁移、转化、降解及毒理作用来判断PAHs的污染情况,已成为国内外环境监测的重要指标之一[6-7].BaP在生物体内的富集动力学参数的获得则是研究BaP在海洋生物体内长期生物生物富集效应的前提,同时也是研究BaP污染对海洋生态系统的影响和建立多介质环境模型的基础,对研究BaP在海洋环境中的迁移、变化和归宿以及环境评价等也具有重要意义,目前国内外对与BaP关系密切的PAHs污染在海洋生物体内的富集规律研究[8-9]较多,而单独针对BaP仅见BaP在河口贝类(Rangia Cuneata)体内累积、释放规律研究[10],海洋贝类(Chlamys farreri)体内的毒代动力研究[11],而缺乏BaP在海洋甲壳类生物富集过程的动力学描述.因此本文以半静态双箱动力学模型[12]为基础,脊尾白虾(Exopalaemon carinicauda)、三疣梭子蟹(Portunus trituberculatus)为研究对象,通过对富集与释放过两种海洋生物体内BaP含量的动态检测以及对检测结果的非线性曲线拟合,结合对模型的拟合优度检验,量化BaP在两种海洋生物体内的生物富集系数,系统地认识其动力学参数特性,比较不同浓度BaP在两种海洋生物体内的生物富集特征,探讨BaP在两种海洋生物内的富集机理,为研究、预测生物体对BaP污染的响应,同时为BaP生态风险的预测提供基础数据.
1 材料与方法
1.1 实验材料
海水为自然海区海水,盐度为21,pH值为8.2,进行沉淀、砂滤,充分曝气(24h以上)后备用,受试脊尾白虾为自然海区捕获、三疣梭子蟹为土塘养殖,实验前将两种海洋生物驯养15d后挑选健康个体进行实验.脊尾白虾的个体体重平均为(2.71±0.43)g,三疣梭子蟹的个体体重平均为(10.89±2.20)g.实验使用150L的特制玻璃容器(经检测,空白组24h内BaP含量无显著性差异(P>0.05)).BaP购自Sigma公司(Sigma-Aldrich Corporation, USA),使用丙酮作为助溶剂配置母液.
1.2 富集、释放实验
实验分为富集和释放两个阶段,分别各进行15d,浓度梯度设为5组,其中3组为实验组,1组为海水对照组,1组为丙酮对照组(丙酮体积比<0.01%),每组设3个重复.为了增加两种海洋生物实验组之间的可比性,根据预实验结果,在预实验的安全浓度范围内,将两种海洋生物实验组浓度梯度均设为:0.45,0.15,0.05μg/L.每个容器内分别放入70尾脊尾白虾,40只三疣梭子蟹.24h保持充氧,溶氧量>5mg/L,实验期间水温为23.6~24.4℃.
富集阶段:整个实验过程中加入海水量为100L,每24h 100%换水1次.脊尾白虾、三疣梭子蟹饵料均为配合饲料(青岛六合饲料有限公司),每天定时定量喂食(8:00和18:00投喂一次,投喂量为受试生物体质量的2%).分别于第0,3,5,10,15d采集5尾脊尾白虾,2只三疣梭子蟹样品,剥壳取肌肉组织,匀浆,迅速冷冻,以备分析.
释放阶段:富集阶段结束后将容器中的溶液全部排出,在流水条件下(流速3.6L/h)进行BaP的释放实验.分别于第18,20,25,30d采集5尾脊尾白虾、2只三疣梭子蟹样品,投喂、取样方法与富集阶段一致.
1.3 样品分析
脊尾白虾、三疣梭子蟹体内BaP的含量参照吴文婧等[13]的方法测定,取样品5g,加适量无水硫酸钠研磨,用100mL二氯甲烷和正己烷的混合溶剂(体积比4:1)索式提取24h(60℃水浴).提取完毕将混合溶剂转换至正己烷溶剂,并浓缩至3mL,利用乙腈和正己烷进行液液萃取,萃取后样品经硅胶柱净化,以正己烷为固定相,50mL二氯甲烷和正己烷混合溶剂(体积比2:3)为流动相,浓缩净化后的样品至0.2mL,加内标检测.采用GC6890(HP-5MS毛细管色谱柱,30m×0.25mm× 0.25μm)分离,MSD检测器(Agilent 5973)检测BaP含量,检出限为0.1ng/g.每批样品的处理过程中,进行空白实验,在空白样品中加标测定回收率,进行质量控制样品的检测,回收率在80~120%,相对标准偏差小于10%,以峰面积对质量浓度作线性回归分析,绘制标准曲线,线性关系良好,其相关系数(R)大于0.99.
1.4 半静态双箱动力学模型
半静态双箱动力学模型[12]通常假设污染物在生物体内的生物富集可近似看作是污染物在水相和生物体之间的两相分配过程,同时考虑到了富集和释放两个过程,即生物体从环境中吸收、富集并释放污染物,富集、释放过程可用一级动力学过程进行描述.
其主要描述如下图所示:
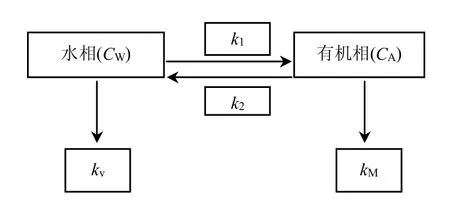
图1 生物富集双箱动力学模型Fig.1 Two-compartment kinetic model of accumulation

式中:k1为生物吸收速率常数;k2为生物释放速率常数;kv为挥发速率常数;kM为生物体的代谢速率常数;CW为水体污染物浓度,μg/L;CA为生物体内污染物浓度,ng/g.在公式的推导过程中,忽略水体中污染物的自然挥发及生物体的代谢.
由式(2)得出富集过程(0<t<t*),其中t*为富集阶段结束的天数(d):
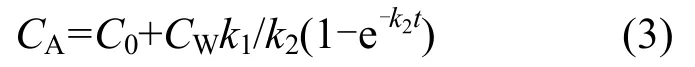
式中:C0为实验开始前生物体中的污染物含量,ng/g,释放过程(t>t*):

由式(3)和(4),通过非线性拟合得到k1、k2.理论中,平衡状态下,BCF用以下公式得到:

生物的半衰期指的是生物因生命活动过程的结果,体内累积的污染物释放一半所需的时间,用公式表示为:

富集达到平衡时,生物体内污染物含量CAmax用式表示为:

即使没有达到浓度平衡,双箱动力学模型也可以用来计算理论中平衡状态下的动力学参数.
1.5 数据处理及模型的拟合优度检验
使用OriginPro 8软件对富集和释放过程中两种海洋生物体内BaP含量进行非线性曲线拟合,通过判定系数R2来评价双箱动力学模型的拟合优度,采用F检验对模型整体的显著性进行检验,并对模型的输出值和实际值进行配对t检验,同时利用Kruskal-Wallis非参数检验对各处理组两种海洋生物体内BaP含量进行统计比较,当P<0.05时,差异显著.
2 结果与讨论
2.1 丙酮作为BaP助溶剂的可行性及配合饲料的影响
在本实验中使用丙酮作为助溶剂来溶解BaP,使用配合饲料投喂受试生物,经检验,在整个实验过程中,丙酮处理组与海水对照组中脊尾白虾、三疣梭子蟹体内的BaP含量分别为(6.71± 0.34),(6.69±0.17)ng/g,无显著性差异(P>0.05),可见用丙酮作为BaP助溶剂是可行的,同时也说明投喂配合饲料对实验结果没有影响.
2.2 两种海洋生物对BaP的生物富集拟合结果
通过对富集和释放过程中两种海洋生物体内BaP的动态检测,并采用式(3)和式(4)对检测结果进行非线性曲线拟合,得到不同暴露浓度下两种海洋生物对BaP的富集与释放曲线,两种海洋生物的生物富集变化趋势基本一致(图2).

图2 不同浓度BaP浓度条件下脊尾白、三疣梭子蟹体内BaP的生物富集曲线Fig.2 Bioccumulation and elimination curves of BaP in E. carinicauda and P. trituberculatus at different concentration
在脊尾白虾、三疣梭子蟹对BaP的富集阶段,BaP富集量随水体BaP浓度的增加而增加,脊尾白虾体内BaP富集量增加幅度分别为15.53(0.45μg/L),7.02(0.15μg/L),3.78ng/(g·d)(0.05μg/L);三疣梭子蟹体内BaP富集量增加幅度分别为9.98(0.45μg/L), 6.13(0.15μg/L), 3.66ng/(g·d)(0.05μg/L).在富集前期两种海洋生物体内BaP含量快速增加,脊尾白虾、三疣梭子蟹体内BaP含量在富集的前3d增加幅度最高均为0.45μg/L实验组,增加幅度分别为14.61,11.52ng/(g·d).随着富集时间的延长,两种海洋生物体内BaP含量增加速度减慢,在富集的最后5d,尽管富集时间较长,但前期脊尾白虾、三疣梭子蟹BaP增加量最高的0.45μg/L实验组增加幅度仅分别为8.59,4.27ng/(g·d).在两种海洋生物对BaP的释放阶段,BaP的释放量均随水体BaP浓度的增加而降低,脊尾白虾体内BaP释放量分别为73.62%(0.45μg/L)、82.55%(0.15μg/L)、87.67%(0.05μg/L);三疣梭子蟹体内BaP释放量分别为74.47%(0.45μg/L)、86.25%(0.15μg/L)、92.67%(0.05μg/L).在释放前期两种海洋生物体内BaP含量急剧下降,脊尾白虾、三疣梭子蟹体内BaP在释放的前3d下降幅度最高均为0.05μg/L实验组,下降幅度分别为45.56%、52.06%.随着释放时间的延长,两种海洋生物体内BaP浓度释放速度减慢,在释放的最后5d,尽管释放时间较长,脊尾白虾、三疣梭子蟹体内前期BaP释放量最高0.05μg/L实验组下降幅度仅分别为34.87%、42.06%.
BaP作为PAHs的典型代表,具有很强的脂溶性,可以通过呼吸、体表渗透和食物链传递的方式进入海洋生物体内[14].被吸收的BaP迅速溶于脂肪,由于其性质稳定,难以被生物体分解排泄,随着摄入量的增加,在海洋生物体内含量会逐渐增大,因此在BaP污染水体中生物体具有很高的生物富集系数,即使水体中BaP浓度很低,生物体中富集量也能达到很高水平[11].本实验研究发现,水体中的BaP能在两种海洋生物体内快速富集并达到很高的浓度,脊尾白虾体内最高富集量达到了239.58ng/g(0.45μg/L),增加幅度为15.53ng/(g·d),三疣梭子蟹体内最高富集量达到了152.98ng/g(0.45μg/L),增加幅度为9.98ng/(g·d),但在同等浓度(0.05μg/L)条件下与贝类相比,两种海洋生物的富集量依然较低[11].
2.3 不同浓度BaP在两种海洋生物体内的富集动力学参数
根据两种海洋生物体内BaP的富集与释放过程的非线性曲线拟合,得到吸收速率k1,释放速率常数k2,然后根据式(5)~(7),得到BCF、CAmax、B1/2的动力学参数(表1),脊尾白虾、三疣梭子蟹对BaP的吸收速率常数k1范围分别为12.34~24.96、13.24~32.64,平均值分别为18.80、22.55,均随外部水体中BaP浓度的增大而减少;对BaP的释放速率常数k2范围分别为0.06~0.10、0.09~0.19,平均值分别为0.08、0.14,均随外部水体中BaP浓度的增大而减少;对BaP的生物富集系数BCF范围分别为208.41~248.03、147.11~ 171.79,平均值分别为228.02、158.11,均随着外部水体BaP浓度的增大而减少;平衡状态下BaP含量CAmax的范围分别为12.40~93.79,8.59~66.20ng/g,平均值分别为46.78,32.70ng/g,均随着外部水体BaP浓度的增大而增大;生物学半衰期B1/2范围分别为6.89~11.71,3.65~7.70d,平均分别为8.95,5.43d,均随着外部水体BaP浓度的增大而增大.
生物体的脂肪组织是有机化合物生物富集的主要位点[15],而三疣梭子蟹肌肉组织中脂肪含量高于脊尾白虾[16-17],但三疣梭子蟹对BaP的吸收速率(k1)高于脊尾白虾(表1),这似乎与上述脊尾白虾体内BaP富集量增加幅度高于三疣梭子蟹结果矛盾,但从表1可以看出,三疣梭子蟹对BaP的释放速率(k2)高于脊尾白虾,吸收速率(k1)、释放速率(k2)的共同作用是最终控制脊尾白虾BaP富集量增加幅度高于三疣梭子蟹的主要因素.因此,不同海洋生物的生理、生态等特征的差异对BaP的生物富集有着密切的关系[15,19].同时,研究表明[18],如果有机化合物在生物体内的BCF值小于100,则可认为该化合物对环境的影响较小,不易在水生生物体内富集,在本研究中,两种海洋生物三组不同浓度BaP实验组的BCF均高于100,表明BaP容易在两种海洋生物体内富集.
BaP在两种海洋生物体内的生物富集动力学参数均呈现规律性的变化特征,前期富集量快速增加,后期增速逐渐趋缓(图2),吸收速率(k1)、释放速率(k2)、BCF随水体BaP浓度的增加而降低(表1),这可能主要受BaP在水相和脂肪相之间的分配平衡以及BaP诱导的以解毒代谢酶为代表的解毒代谢系统的变化影响[15,20].在富集初期,由于两种海洋生物体内BaP含量较低,水体中BaP通过主动或被动吸收迅速分配到生物体内,尽管在CYP450酶、抗氧化酶等解毒代谢酶的转化脱毒及生物排泄作用下部分BaP以水溶性产物的形式被并释放到水体中,但此时两种海洋生物对BaP的吸收速率(k1)依然高于释放速率(k2),整体依然表现为富集量的快速增加,随着两种海洋生物体内BaP富集量趋于饱和,两种海洋生物吸收BaP速率趋于低水平平稳状态,吸收、释放两个过程渐趋平衡,富集曲线也趋于平缓.同时,与低浓度BaP相比较,高浓度BaP更接近两种海洋生物的毒性效应阀值,解毒代谢酶更容易受到损伤,对BaP的代谢能力相比也较弱[21],这种影响直接反应在释放速率(k2)的变化上,并最终引起BCF随水体BaP浓度的增加而降低.这种在低浓度有机化合物的条件下所得的BCF比高浓度条件要高的情况与水生生物对苯酚[20]、阿特拉津[22]等有机化合物的生物富集特征一致,具有一定的普遍性.
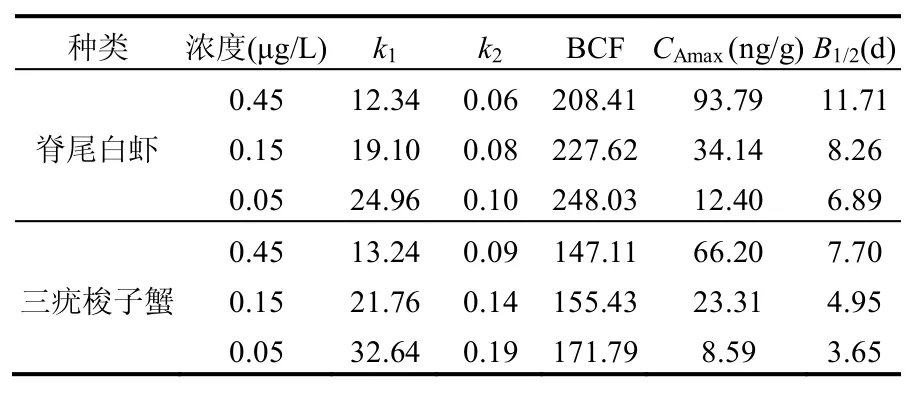
表1 两种海洋生物对不同浓度BaP的富集动力学参数Table 1 Kinetic parameters of bioaccumulation of BaP in E. carinicauda and P. trituberculatus at different concentration
同样,这两种控制因子也体现在两种海洋生物对BaP的释放阶段,前期,两种海洋生物体内的BaP被迅速分配到水相中,随着BaP含量的降低,释放速率(k2)降低并趋向于平缓.同时,低浓度BaP条件下解毒代谢酶的代谢活动更加活跃,释放速率(k2)高于高浓度BaP实验组,这也直接体现在生物半衰期(B1/2)的变化上,低浓度BaP条件下生物半衰期(B1/2)更小,BaP更容易被释放.但在15d后,脊尾白虾、三疣梭子蟹体内BaP释放量最大的实验组(0.05μg/L)也未能将体内BaP完全排除,残留量依然均超过了本底值,表明脊尾白虾对BaP具有一定的排出能力,但依然具有相当的残留量,这与贝类[11]体内的BaP释放趋势类似,表明BaP较难被生物体代谢.
2.4 模型的拟合优度检验
利用判定系数R2对对富集和释放过程中两种海洋生物体内BaP的非线性曲线拟合结果进行检验,两种海洋生物各组拟合曲线判定系数R2范围分别为0.94~0.97、0.72~0.96(表2),拟合程度良好,同时F检验结果(表2)表明模型回归方程是显著的(P<0.05),在模型显著性基础上,对模型的输出值和实际值进行配对t检验,在α=0.05条件下,所有的P>α(表2),即模型输出结果和实际值差异不显著,上述检验结果表明,本实验条件下半静态双箱动力学模型应用于两种海洋生物对BaP的生物富集动力学研究是可信的.

表2 半静态双箱动力学模型用于两种海洋生物对BaP生物富集的拟合优度检验信息Table 2 Summary of statistical information to assess the goodness-of-fit of the two compartment models applied in the bioaccumulation of BaP in E. carinicauda and P. trituberculatus
3 结论
3.1 脊尾白虾对BaP的最高富集量高于三疣梭子蟹,分别为239.58,152.98ng/g,最高增加幅度分别为15.53,9.98ng/(g·d),前期富集迅速,后期富集速率逐渐下降,对BaP的释放主要集中在前期,后期释放速率放缓,模型拟合结果良好;
3.2 脊尾白虾、三疣梭子蟹对BaP的吸收速率常数k1范围分别为12.34~24.96、13.24~32.64,释放速率常数k2范围分别为0.06~0.10、0.09~0.19,BCF范围分别为208.41~248.03、147.11~171.79,均随外部水体中BaP浓度的增大而减少, CAmax范围分别为12.40~93.79,8.59~66.20ng/g,生物学半衰期B1/2范围分别为6.89~11.71,3.65~7.70d,随外部水体中BaP浓度的增大而增大.
[1]Haritash A K, Kaushik C P. Biodegradation aspects of polycyclicaromatic hydrocarbons (PAHs): a review [J]. Journal of Hazardous Materials, 2009,169(1):1-15.
[2]Douben P E T. PAHs: an ecotoxicological perspective [M]. New York: Wiley, 2003:377.
[3]于秀艳,丁永生.多环芳烃的环境分布及其生物修复研究进展[J]. 大连海事大学学报:自然科学版, 2004,30(4):55-59.
[4]Baran S, Bielińska E J, Oleszczuk P. Enzymatic activity in an airfield soil polluted with polycyclic aromatic hydrocarbons [J]. Geoderma, 2004,118(3):221-232.
[5]匡少平,孙东亚.多环芳烃的毒理学特征与生物标记物研究 [J].世界科技研究与发展, 2007,29(2):41-47.
[6]Stegeman J J. Benzo [a]pyrene oxidation and microsomal enzyme activity in the mussel (Mytilus edulis) and other bivalve mollusc species from the Western North Atlantic [J]. Marine Biology, 1985,89(1):21-30.
[7]Kidd K A, Hesslein R H, Ross B J, et al. Bioaccumulation of organochlorines through a remote freshwater food web in the Canadian Arctic [J]. Environmental Pollution, 1998,102(1):91-103.
[8]Neff J M, Cox B A, Dixit D, et al. Accumulation and release of petroleum-derived aromatic hydrocarbons by four species of marine animals [J]. Marine Biology, 1976,38(3):279-289.
[9]Baussant T, Sanni S, Jonsson G, et al. Bioaccumulation of polycyclic aromatic compounds: 1. Bioconcentration in two marine species and in semipermeable membrane devices during chronic exposure to dispersed crude oil [J]. Environmental Toxicology and Chemistry, 2001,20(6):1175-1184.
[10]Neff J M, Anderson J W. Accumulation, release, and distrubution of benzo [a]pyrene C14in the clam Rangia Cuneata [A].// International Oil Spill Conference Proceedings [C]. Lawrence: Allen Press, 1975:469-471.
[11]杨慧赞.苯并[a]芘在栉孔扇贝(Chlamys farreri)体内的毒代与毒效动力学研究 [D]. 青岛:中国海洋大学, 2008.
[12]Kahle J, Zauke G P. Bioaccumulation of trace metals in the copepod Calanoides acutus from the Weddell Sea (Antarctica): comparison of two-compartment and hyperbolic toxicokinetic models [J]. Aquatic Toxicology, 2002,59(1/2):115-135.
[13]吴文婧,谢金开,徐福留,等.苯并(a)芘在四种食用淡水鱼中的含量和分布 [J]. 环境科学学报, 2008,28(10):2072-2077.
[14]Wang X H, Wang W X. Bioaccumulation and transfer of benzo (a)pyrene in a simplified marine food chain [J]. Marine Ecology Progress Series, 2006,312:101-111.
[15]薛秋红.经济贝类对石油烃及其特性化合物的生物富集性研究[D]. 青岛:青岛海洋大学, 2000.
[16]邵银文,王春琳,励迪平,等.脊尾白虾自然群体与养殖群体的营养差异 [J]. 水利渔业, 2008,28(4):34-37.
[17]徐善良,张 薇,严小军,等.野生与养殖三疣梭子蟹营养品质分析及比较 [J]. 动物营养学报, 2009(5):695-702.
[18]Davies R P, Dobbs A J. The prediction of bioconcentration in fish[J]. Water Research, 1984,18(10):1253-1262.
[19]Gunther A J, Davis J A, Hardin D D, et al. Long-term bioaccumulation monitoring with transplanted bivalves in the San Francisco Estuary [J]. Marine Pollution Bulletin, 1999,38(3): 170-181.
[20]Franke C. How meaningful is the bioconcentration factor for risk assessment? [J]. Chemosphere, 1996,32(10):1897-1905.
[21]李 康,周忠良,陈立侨,等.苯并[a]芘对鲫鱼生物标志物的影响研究 [J]. 环境科学研究, 2006,19(1):91-95.
[22]Jacomini A E, Avelar W E, Martinêz A S, et al. Bioaccumulation of atrazine in freshwater bivalves Anodontites trapesialis(Lamarck, 1819) and Corbicula fluminea (Muller, 1774) [J]. Archives of Environmental Contamination and Toxicology,2006,51(3):387-391.
Kinetic study of the bioaccumulation of benzo [a]pyrene in two sea creature’s tissues.
LI Lei1, JIANG Mei1*, SHEN Xin-qiang1, WANG Yun-long1, WU Qing-yuan2, NIU Jun-xiang2, XU Gao-peng2(1.East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;2.College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China). China Environmental Science, 2015,35(1):291~297
Benzo [a]pyrene (BaP) was one of the most important pollutants in the marine environment. To understand the bioaccumulation characteristics of BaP in Exopalaemon carinicauda and Portunus trituberculatus, the kinetic parameters (uptake rate constant (k1), elimination rate constant (k2), bioaccumulation factor (BCF), and biological half-life (B1/2) of the BaP bioaccumulation and elimination in crustaceans E. carinicauda and P. trituberculatus tissues were determined used the semi-static two-compartment kinetic model. The range of k1,k2, BCF, CAmaxand B1/2was 12.34 to 24.96, 0.06 to 0.10, 208.41 to 248.03, 12.40 to 93.79ng/g, 6.89 to 11.71days, respectively, the average value of k1,k2, BCF, CAmaxand B1/2was 18.80, 0.08, 228.02, 129.07ng/g, 8.95days for BaP in the E. carinicauda tissues. And in the P. trituberculatus tissues, the range of k1,k2, BCF, CAmaxand B1/2was 8.59to 66.20, 0.09to 0.19, 147.11to 171.79,8.59 to 66.20ng/g, 3.65 to 7.70 days, respectively, the average value of k1,k2, BCF, CAmaxand B1/2was 22.55, 0.14,158.11, 32.70ng/g, 5.43 days. It was found that the uptake rate constant (k1), elimination rate constant (k2) and bioaccumulation factor (BCF) in E. carinicauda and P. trituberculatus tissues generally decreased with the increase in BaP exposure concentration in ambient seawater, the CAmax, B1/2was increased with the increase in BaP exposure concentration in ambient seawater. The results showed that BaP could easily cause bioaccumulation in E. carinicauda and P. trituberculatus tissues, the bioaccumulation contents in E. carinicauda tissues was higher than in P. trituberculatus tissues, the bioaccumulation rate in early stage was higher than the bioaccumulation stage in later,where the release rate of BaP become slower in later stage.
Exopalaemon carinicauda;Portunus trituberculatus;benzo [a]pyrene;bioaccumulation;kinetics
X171
A
1000-6923(2015)01-0291-07
李 磊(1985-),男,安徽亳州人,助理研究员,研究方向为海洋生态毒理学.发表论文25篇.
2014-01-28
上海市科学技术委员会项目(12231203403);农业部应对溢油关键技术专项(2012-2014);中国水产科学研究院基本科研业务费(NO.2014A02XK01);中央级公益性科研院所基本科研业务费专项(2014T06)
* 责任作者, 研究员, jiangrose73@163.com

