恶臭假单胞菌腈水合酶βAla97影响催化己二腈的区域选择性
张 君,崔文璟,刘 义,崔幼恬,周哲敏
(江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
恶臭假单胞菌腈水合酶βAla97影响催化己二腈的区域选择性
张 君,崔文璟,刘 义,崔幼恬,周哲敏
(江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122)
对恶臭假单胞菌(Pseudomonas putida)腈水合酶(PpNHase)催化己二腈进行研究,发现PpNHase只能催化己二腈中1个氰基生成单酰胺产物5-氰基戊酰胺,具有区域选择性;睾丸酮丛毛单胞菌(Comamonas testosteroni)腈水合酶(CtNHase)能催化己二腈直接生成己二酰二胺,不具有催化区域选择性。为了阐明这一区域选择性差异的机制,对CtNHase和PpNHase β亚基的氨基酸序列进行比对,结果显示同源性为94.1%,CtNHase存在βAla97缺失。基于此分析,构建了PpNHase β97位Ala的缺失突变体(ΔAla97)。利用高效液相色谱检测ΔAla97催化己二腈的产物,发现ΔAla97能将底物完全催化为己二酰二胺,表明βAla97是影响催化己二腈由5-氰基戊酰胺向己二酰二胺转化的关键氨基酸。
腈水合酶;己二腈;生物催化;区域选择性
腈水合酶(EC 4.2.1.84,nitrile hydratase,NHase),是一种用来催化腈类物质生成酰胺类物质的金属酶[1],在自然界中分布广泛,大多产腈水合酶的微生物为革兰氏阳性菌属,如诺卡氏菌属(Nocardia)、红球菌属(Rhodococcus)、假棒状杆菌属(Corynebacterium)、假诺卡氏菌属(Pseudonocardia)、短杆菌属(Brevibacterium)、产碱杆菌属(Alcaligenes)、假单胞菌属(Pseudomonas)和丛毛单胞菌属(Comamonas)等。腈水合酶根据活性中心所需辅因子的不同,一般可以分为钴型腈水合酶[2](Co-NHase)和铁型腈水合酶[3](Fe-NHase)。恶臭假单胞菌(Pseudomonas putida)来源的NHase为钴型腈水合酶,成熟酶由2个α亚基和2个β亚基构成[4],一般以α2β2四聚体形式存在,α亚基和β亚基的相对分子质量分别为2.3×104和2.41×104[5],其活性中心Co2+的摄取依赖编码β、α亚基基因(ba)下游p基因的翻译产物P亚基,通过自身交换机制来完成[2]。腈水合酶在工业上主要用来生产烟酰胺[6]及丙烯酰胺[7],与化学催化相比,利用腈水合酶进行生物转化有高选择性、无副产物、反应条件温和、反应速度快及环境污染较小等诸多优势[8-12]。
腈水合酶根据催化底物类型的不同,还可以分为芳香型腈水合酶(包括杂环型)和脂肪型腈水合酶两类[4]。现有研究仅发现腈水合酶能催化己二腈以及多聚物如聚丙烯腈[13-16],而对其催化过程和机制尚不明确。Moreau等[17]研究发现腈水合酶催化己二腈可生成中间产物5-氰基戊酰胺和终产物己二酰二胺,具有催化的区域选择性。与此不同,Comamonas testosteroni腈水合酶能将底物己二腈全部转化为己二酰二胺,不生成中间产物5-氰基戊酰胺。5-氰基戊酰胺是一种农药中间体,可以用来生产三唑啉酮类除草剂[18],也可以作生产己内酰胺和碱性红29的前体。终产物己二酰二胺,是重要的精细化工原料、医药中间体,价格较昂贵。因此,阐明腈水合酶催化己二腈的区域选择性机制对利用酶法制备5-氰基戊酰胺和己二酰二胺具有重要意义。
本研究中,笔者在P.putida来源的NHase催化己二腈具有区域选择性的基础上,通过序列比对、缺失突变鉴定影响P.putida腈水合酶催化己二腈区域选择性的热点氨基酸。此研究结果将对进一步阐明腈水合酶对己二腈的区域选择性机制、提高底物转化率及利用腈水合酶催化制备己二酰二胺具有重要的指导意义。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒和培养基
含有Pseudomonas.putida NRRL-18668来源的NHase(PpNHase)的重组质粒pET24a-bap、Escherichia coli JM109和BL21(DE3)保藏于笔者所在实验室。
2YT固体培养基(g/L):胰蛋白胨16,酵母提取物10,NaCl 5,琼脂粉20;pH 7.0。
1.1.2 试剂与仪器
Primer STARTMHS DNA Polymerase、DpnⅠ,TaKaRa公司;己二腈、己二酰二胺,Sigma公司;5-氰基戊酰胺,天津科技大学王敏教授惠赠。引物合成委托生工生物工程(上海)股份有限公司完成。质粒DNA小提试剂盒、DNA纯化回收试剂盒,天根生化科技(北京)有限公司。
1.2 方法
1.2.1 NHase的表达和纯化
将编码P.putida腈水合酶(PpNHase)及P亚基基因的重组质粒pET24a-bap转化至大肠杆菌BL21(DE3),37℃过夜培养。挑取单菌落,接种至含有50 μg/mL(终质量浓度)卡那霉素的10mL 2YT培养基中,200r/min、37℃过夜培养。再将活化的重组菌BL21(DE3)按1∶100的体积比接种到100mL新鲜的2YT培养基中,按上述条件培养至600nm吸光度值(OD600)0.6~0.8,加入终浓度为0.6mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)以及终质量浓度为0.1mg/L的 Co2+,200r/min、28℃下诱导16 h。
1)酶分离、纯化过程 收集菌体,用20mmol/L Tris-HCl缓冲液洗清洗3次,超声破碎后收集上清液,进行(NH4)2SO4分级沉淀,范围为40%~75%,将最终得到的蛋白液在4℃透析12 h。
3)凝胶过滤层析 将浓缩后的酶蛋白液注入预先用缓冲液(20mmol/L Tris-HCl pH 7.4)平衡的Superdex 200 10/300GL层析柱中,用分离缓冲液(20mmol/L Tris-HCl,pH 7.4,含 0.15mol/L NaCl)进行洗脱,并收集目的蛋白,即为纯化得到的纯酶,SDS-PAGE检测纯化结果。纯化的蛋白置于-20℃保存,用于测定酶的区域选择性。
1.2.2 催化产物的检测
反应体系:将20 μL 300 μg/mL纯酶加入到430 μL 20mmol/L Tris-HCl缓冲液中,再加入50 μL 200mmol/L底物己二腈,30℃反应10min,加入500 μL甲醇终止反应。产物测量参考Moreau等[17]报道的测量方法,并稍作改进。使用Diamonsil 5μm×250 mm×4.6 mm C18色谱柱分离5-氰基戊酰胺和己二酰二胺。流动相采用25mmol/L H3PO4和色谱纯甲醇(体积比89.01∶10.09,pH 2.5),柱温为30℃,流速1.0mL/min,紫外检测波长为200nm。
1.2.3 突变株的构建
以pET24a-bap为模板,将β链97位Ala进行缺失,构建出缺失突变体ΔAla97,用PrimeSTAR®HS DNA Polymerase试剂盒进行全质粒扩增(PCR),扩增引物见表1。PCR条件:95℃5min,98℃20 s,57℃30 s,68℃6.5min,18个循环;68℃5min终止程序。扩增产物经1%琼脂糖凝胶电泳验证,再用DNA纯化试剂盒切胶回收7 kb左右的pET24a-bap及突变后的重组质粒,经过DpnⅠ酶37℃将模板消化1 h后,转化JM109,挑取单菌落过夜培养后提取质粒,验证后转化大肠杆菌BL21(DE3)进行表达。

表1 本研究中所用引物Table 1 Primers used in this study
2 结果与讨论
2.1 腈水合酶表达、纯化
收集过夜诱导的重组菌BL21(DE3)/pET24abap,经过破碎,离心、(NH4)2SO4沉淀、离子层析凝胶过滤等进行分离得到较纯的腈水合酶,结果如图1所示。由图1可见:在2.4×104处有较纯的目的蛋白条带(α亚基相对分子质量2.34×104,β亚基相对分子质量2.4×104),表明经过此分离纯化方法得到了较纯的NHase,通过测定纯化前后酶的比活力,得出纯化倍数为11.6倍。
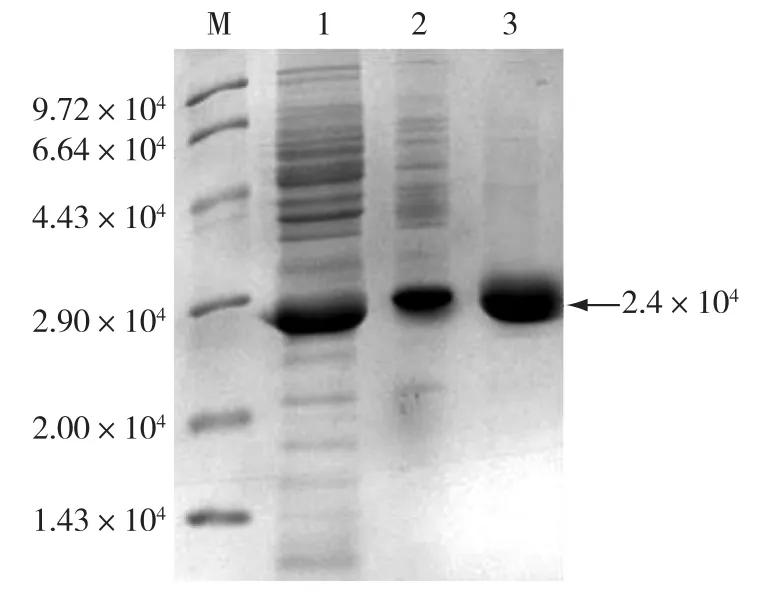
图1 NHase纯化过程的SDS-PAGE分析Fig.1 SDS-PAGE analysis of purified NHase
2.2 野生型NHase催化底物区域选择性的检测
首先利用高效液相色谱(HPLC)分别检测10mmol/L的己二酰二胺和5-氰基戊酰标准样品,然后检测用纯化的恶臭假单胞菌NHase(PpNHase)催化己二腈生成的产物,结果如图2所示。由图2(a)和图2(b)可知:己二酰二胺标准样品保留时间为3.32min,5-氰基戊酰胺标准样品保留时间为5.27min。由图2(c)可知:反应时间分别为10和30min时,产物为5-氰基戊酰胺,没有己二酰二胺生成;反应时间为80min时,产物中没有明显的己二酰二胺生成,绝大部分为中间产物5-氰基戊酰胺;继续延长反应时间,不能增加己二酰二胺的生成量。本结果说明PpNHase对己二腈具有催化的区域选择性,仅能催化己二腈生成5-氰基戊酰,不能继续催化5-氰基戊酰生成二酰二胺。
2.3 基因序列比对结果
C.testosteroni5-MGAM-4D来源的NHase能催化己二腈生成己二酰二胺,具有区域选择性[19]。而NHase的β亚基与底物的选择、结合有密切的关系。将C.testosteroni来源的NHase(CtNHase,GenBank:AY743666)和PpNHase(GenBank:U89363.1)蛋白质一级序列进行BLAST比对,结果如图3所示。由图3可知:CtNHase与PpNHase氨基酸序列的相似度为94.1%。一个明显的区别是,相对于PpNHase,CtNHase缺失了βAla97,有缺失突变。βAla97可能与己二腈催化的区域选择性有关。
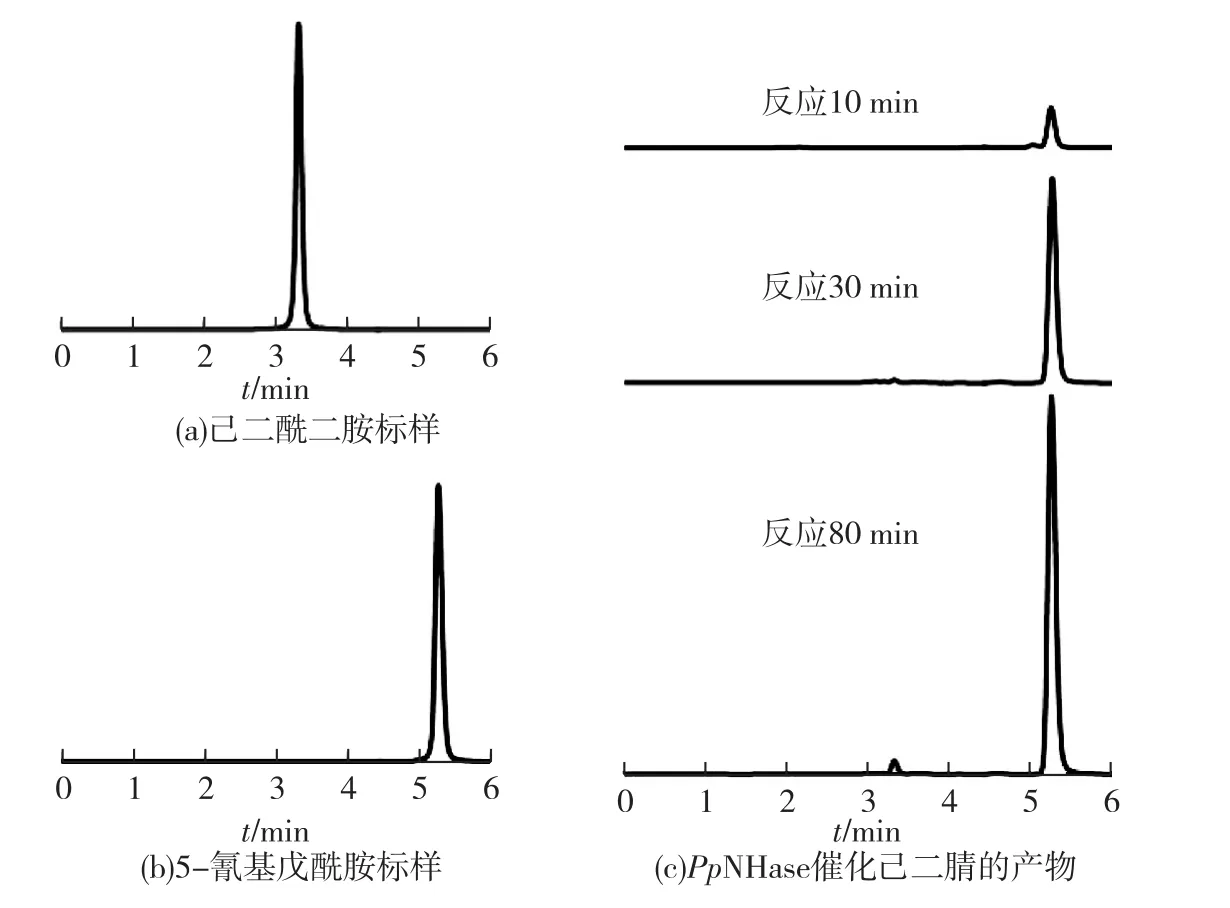
图2 样品的HPLC图谱Fig.2 HPLC spectra of samples

图3 恶臭假单胞菌和睾丸酮丛毛单胞菌来源的腈水合酶β链氨基酸序列比对Fig.3 Amino acid sequence alignment of the β chain of NHase from P.putida and C.testosteroni
2.4 缺失突变体的构建及表达
基于以上分析,笔者构建了 βAla97缺失的PpNHase和ΔAla97。以含有PpNHase(基因结构为bap)的重组质粒pET24a-bap作为模板,按“1.2.3”方法进行全质粒PCR,构建突变体,基因测序表明成功构建了突变体。
将重组质粒pET24a-bap/ΔAla97转化E.coli BL21(DE3),挑取单菌落,诱导表达 ΔAla97。按“1.2.1”方法纯化,获取突变体纯酶ΔAla97。SDSPAGE分析纯化结果如图 4所示。由图 4可见:PpNHase的β亚基缺失97位Ala后,其NHase的α、 β亚基相对分子质量都为2.3×104左右,可以看到NHase实现了表达,并且得到了较纯的蛋白。
2.5 PpNHase中Ala97缺失突变体区域选择性变化
利用HPLC检测突变体ΔAla97催化己二腈区域选择性的变化,结果如图5所示。由图5可知:突变体ΔAla97纯酶与己二腈分别反应10、60和80min时,催化产物中均有明显的己二酰二胺生成,并且己二酰二胺的生成量随反应时间延长而增加。反应80min时,底物己二腈完全被催化为己二酰二胺,无5-氰基戊酰胺保留,说明βAla97缺失显著改变了PpNHase催化己二腈的区域选择性,βAla97是影响NHase催化己二腈区域选择性的热点氨基酸。
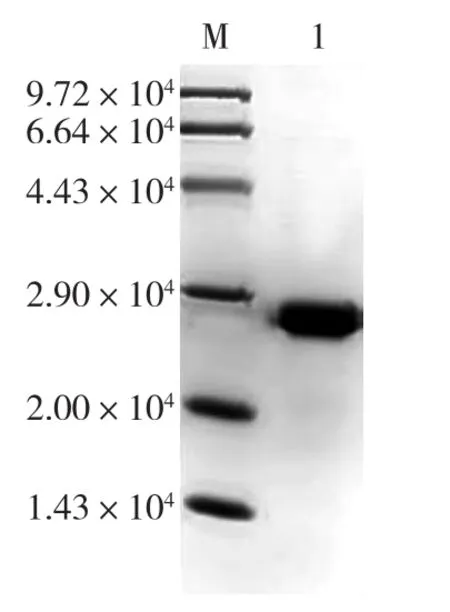
图4 突变体的纯化蛋白SDS-PAGEFig.4 SDS-PAGE analysis of the purified mutant NHase
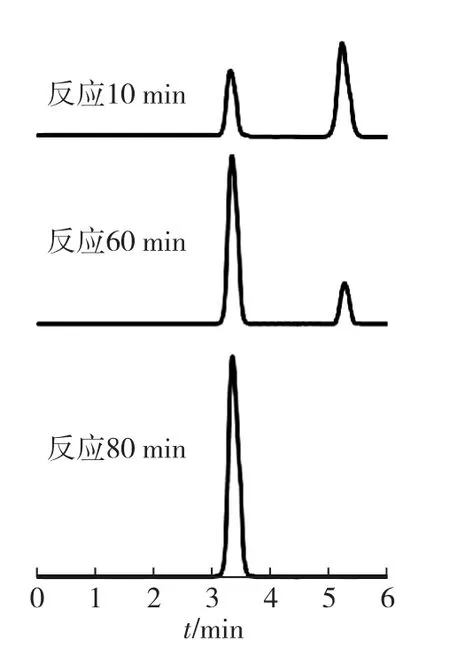
图5 突变体的NHase催化己二腈不同时间下产物的HPLC图谱Fig.5 HPLC spectra of the product of mutant PpNHase catalyzing adiponitrile at different reaction time
腈水合酶的区域选择性与酶分子自身和底物均有关。李建军等[20]分析了Rhodococcus sp.AJ270腈水合酶催化二腈的反应,发现该催化的区域选择性会受底物结构的影响。首先,底物二腈分子的柔顺性和2个氰基的空间伸展方向,能决定该底物分子能否被酶所水解,当分子结构具有刚性的顺式共平面时,对酶催化有抑制作用。其次,底物分子中2个氰基的距离和构型影响酶催化的区域选择性,刚性的顺式共平面不利于选择性地水解二腈分子中的单个氰基。本研究中选用的己二腈,在空间结构上不是上述刚性平面结构,而是具有较好的柔顺性,适宜用来作为研究不同来源的腈水合酶对二腈催化的区域选择性的底物。目前有报道的NHase催化己二腈区域选择性的3种菌株,分别是Rhodococcus ruber CGMCC3090[21]、 P.chlororaphis B23[6]和C.testosteroni 5-MGAM-4D[19],其中前2种菌株的NHase能够区域选择地催化己二腈,主要生成5-氰基戊酰胺。与本研究所用的P.putida NRRL-18668 NHase催化性质相似,而C.testosteroni NHase与己二腈反应生成的终产物全部为己二酰二胺。通过比对4个不同区域选择性的腈合酶氨基酸序列,α链的相似性为31.3%,β链的相似性为58.43%,其中P.putida NRRL-18668 NHase与 C.testosteroni NHase相似度极高,却有着不同的区域选择性。P.putida NRRL-18668 NHase β链的97位丙氨酸残基位于β链上的不规则区域,在具有相同区域选择性菌株中没有一定的规律。
3 结论
通过缺失β链的97位丙氨酸,改变了腈水合酶催化己二腈的区域选择性,原始酶仅能将己二腈转化为5-氰基戊酰胺,而变异体可以将己二腈转化为己二酰二胺。变异体在反应过程中有5-氰基戊酰胺积累,随着时间的推移,5-氰基戊酰胺逐步减少,说明此过程是分两步进行的,己二腈分子的1个氰基首先被催化,之后另外1个氰基被催化。推测此氨基酸残基的缺失可以使中间产物5-氰基戊酰胺易于结合活性中心,最终促进其转化为己二酰二胺。
综上,笔者利用基因序列比对,采用定点突变的方法,发现了决定腈水合酶催化己二腈反应生成己二酰二胺为终产物的区域选择性的关键氨基酸位点,为β链上97位的Ala。本研究初步阐明了P.putida来源的腈水合酶对己二腈的区域选择性机制,提高了底物转化率,对利用腈水合酶催化制备己二酰二胺具有重要的指导意义。
[1]Mahadevan S,Thimann K V.Nitrilase:II.substrate specificity and possible mode of action[J].Arch Biochem Biophys,1964,107:62-68.
[2]Zhou Z,Hashimoto Y,Shiraki K,et al.Discovery of posttranslational maturation by self-subunit swapping[J].Proc Nat Aca Sci USA,2008,105(39):14849-14854.
[3]Mascharak P K.The active site of nitrile hydratase:an assembly of unusual coordination features by nature[J].Mol Design Inorg Biochem,2013,85:89-113.
[4]Liu Y,Cui W,Xia Y,et al.Self-subunit swapping occurs in another gene type of cobalt nitrile hydratase[J].PloS One,2012,7(11):e50829.
[5]Brodkin H R,Novak W R P,Milne A C,et al.Evidence of the participation of remote residues in the catalytic activity of co-type nitrile hydratase from Pseudomonas putida[J].Biochemistry,2011,50(22):4923-4935.
[6]Nishiyama M,Horinouchi S,Kobayashi M,et al.Cloning and characterization of genes responsible for metabolism of nitrile compounds from Pseudomonas chlororaphis B23[J].J Bacteriol,1991,173(8):2465-2472.
[7]Martinez S,Kuhn M L,Russell J T,et al.Acrylamide production using encapsulated nitrile hydratase from Pseudonocardia thermophila in a sol-gel matrix[J].J Mol Catal B:Enzymatic,2014,100:19-24.
[8]Banerjee A,Sharma R,Banerjee U C.The nitrile-degrading enzymes:current status and future prospects[J].Appl Microbiol Biotechnol,2002,60(1/2):33-44.
[9]Kobayashi M,Shimizu S.Nitrile hydrolases[J].Curr Opin Chem Biol,2000,4(1):95-102.
[10]Martinkova L,Mylerova V.Synthetic applications of nitrileconverting enzymes[J].Curr Org Chem,2003,7:1279-1295.
[11]Singh R,Sharma R,Tewari N,et al.Nitrilase and its application as a"green"catalyst[J].Chem Biodivers,2006,3:1279-1287.
[12]Wang M X.Enantioselective biotransformations of nitriles in organic synthesis[J].Top Catal,2005,35(1/2):117-130.
[13]Babu V,Choudhury B.Competitive adsorptions of nitrile hydratase and amidase on polyacrylonitrile and its effect on surface modification[J].Colloid Surf B,2012,89:277-282.
[14]Battistel E,Morra M,Marinetti M.Enzymatic surface modification of acrylonitrile fibers[J].Appl Surf Sci,2001,177(1/2):32-41.
[15]Fischer-Colbrie G,Matama T,Heumann S,etal.Surface hydrolysis of polyacrylonitrile with nitrile hydrolysing enzymes from Micrococcus luteus BST20[J].J Biotechnol,2007,129(1):62-68.
[16]Tauber M M,Cavaco-Paulo A,Robra K H,et al.Nitrile hydratase and amidase from Rhodococcus rhodochrous hydrolyze acrylic fibers and granular polyacrylonitriles[J].Appl Environ Microb,2000,66(4):1634-1638.
[17]Moreau J L,Azza S,Bigey F,et al.Application of highperformance liquid-chromatography to the study of the biological transformation of adiponitrile[J].J Chromatogr B Biomed Appl,1994,656(1):197-202.
[18]Shapiro R,Dicosimo R,Hennessey S M,et al.Discovery and development of a commercial synthesis of azafenidin[J].Org Process Res Dev,2001,5(6):593-598.
[19]Petrillo K L,Wu S J,Hann E C,et al.Over-expression in Escherichia coli of a thermally stable and regio-selective nitrile hydratase from Comamonas testosteroni 5-MGAM-4D[J].Appl Microbiol Biotech,2005,67(5):664-670.
[20]李建军,李纪生,王梅祥.二腈的区域和对映选择性生物水解反应:腈水合酶与二腈分子作用模式初探[J].化学学报,2001,59(10):1827-1830.
[21]Wang S,Dai Y,Wang J,et al.Molecular insights into substrate specificity of Rhodococcus ruber CGMCC3090 by gene cloning and homology modeling[J].Enzyme Microb Tech,2013,52(2):111-117.
(责任编辑 管 珺)
βAla97 of nitrile hydratase from Pseudomonas putida affects regioselectivity towards adiponitrile
ZHANG Jun,CUI Wenjing,LIU Yi,CUI Youtian,ZHOU Zhemin
(Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Nitrile hydratase(NHase)from Pseudomonas putida(PpNHase)to catalyzes adiponitrile(a kind of dinitriles)only to 5-cyanopentanamide(monoamide),indicating that only one of the cyano group was catalyzed to amide whereas the others not.This finding demonstrates that PpNHase exhibits catalyzing regioselectivity.On the other hand,NHase derived from Comamonas testosterone(CtNHase)catalyzes adiponitrile directely to adipamide(diamide),without catalyzing regioselectivity towards adiponitrile.In order to illustrate the mechanism of regioselectivity of PpNHase towards adiponitrile,alignment of protein sequence of β subunit between PpNHase and CtNHase was compared.Though they shows high homology(94.1%),the β subunit of PpNHase has an additional 97 alanine compared to that of the CtNHase.Therefore,a mutant PpNHase with deletion of Ala97(ΔAla97) was constructed.Highperformance liquid chromatography(HPLC) analysis showed that the mutant ΔAla97 converted adiponitrile to adipamide completely,indicating that Ala97 locating at the β-subunit is the pivotal aminoacid influencing conversion of 5-cyanopentanamide to adipamide.Those results will be helpful to elucidatethe regioselective mechanism.
nitrile hydratase;adiponitrile:biocatalysis;regioselectivity
Q814;Q78
A
1672-3678(2015)03-0041-06
10.3969/j.issn.1672-3678.2015.03.008
2014-02-16
国家自然科学基金(31070711)
张 君(1989—),女,湖南益阳人,硕士研究生,研究方向:酶工程;周哲敏(联系人),教授,E-mail:zhmzhou@jiangnan.edu.cn

