重组大肠杆菌产疏绵状嗜热丝孢菌脂肪酶分批补料发酵工艺
马红叶,郑仁朝,赵川东,郑裕国
(浙江工业大学 生物工程研究所 教育部生物转化与生物净化工程研究中心,浙江 杭州 310032)
重组大肠杆菌产疏绵状嗜热丝孢菌脂肪酶分批补料发酵工艺
马红叶,郑仁朝,赵川东,郑裕国
(浙江工业大学 生物工程研究所 教育部生物转化与生物净化工程研究中心,浙江 杭州 310032)
为了获得低成本的疏绵状嗜热丝孢菌脂肪酶(TLL),在5 L发酵罐发酵中对工程菌E.coli BL21(DE3)/ pET28b-TLL的分批补料发酵工艺进行研究。结果表明:以葡萄糖为碳源的补料培养基,采用溶氧(DO)反馈补料策略进行补料,当OD600=60时降温至28℃,分2次加入终质量浓度为30g/L乳糖进行诱导表达。优化后TLL的表达量提高到798.5 U/L,是优化前的2.4倍。本研究为规模化发酵重组菌生产TLL奠定了基础。
疏绵状嗜热丝孢菌脂肪酶;分批补料;发酵;大肠杆菌
疏绵状嗜热丝孢菌脂肪酶(Thermomyces lanuginosus lipase,TLL)是一种嗜碱性、热稳定脂肪酶,其最适反应温度为60℃[1]。TLL与其他嗜热真菌脂肪酶相比,具有更高的催化效率[2]。目前,TLL已被Novozymes公司制成商品化脂肪酶Lipolase®和Lipozyme TL IM®,广泛应用于食品、洗涤、生物柴油和精细化学品等领域[2-3]。近年来,随着绿色制药的兴起,TLL在手性医药中间体制备中的应用越来越多,如利用Lipolase®选择性水解外消旋2-羧乙基-3-氰基-5-甲基己酸乙酯(CNDE)合成(3S)-2-羧乙基-3-氰基-5-甲基己酸,用于普瑞巴林的生产[4]。
由于TLL商品化酶价格昂贵,一定程度上限制了其大规模应用。通过前期研究,笔者所在课题组成功实现了TLL在大肠杆菌中的活性表达,并优化了其在摇瓶中的表达条件[5]。分批补料技术通过控制培养过程基质浓度,解除细胞生长底物抑制,实现工程菌的高密度生长与目标酶的高表达,已成为微生物发酵工艺研究和工业化应用的重要策略之一[6-7]。
本研究中,笔者采用分批补料培养技术,在5 L发酵罐中对基因工程菌 E.coli BL21(DE3)/ pET28b-TLL分批补料培养工艺进行研究,优化培养控制条件,以期实现 TLL的高表达,用于水解CNDE制备普瑞巴林手性中间体。
1 材料与方法
1.1 材料
1.1.1 菌种
从Thermomyces lanuginosus ZJB09222中克隆获得的TLL基因,插入pET28b的NcoⅠ和XhoⅠ酶切位点之间,构建基因工程菌 E.coli BL21(DE3)/ pET28b-TLL[5]。
1.1.2 培养基
斜面培养基(g/L):蛋白胨 10、酵母粉 5、NaCl 10、琼脂粉20。
种子培养基(g/L):蛋白胨 10、酵母粉 5、NaCl 10,pH 7.0。
产酶培养基(g/L):蛋白胨 7、酵母粉 8、甘油3、K2HPO42、MgSO4·7H2O 2、NaCl 1;pH 7.0。
补料培养基A(g/L):甘油100、酵母粉25、蛋白胨25、MgSO4·7H2O 10、KH2PO47、NaCl 5。
补料培养基B(g/L):甘油100、酵母粉50、蛋白胨5、MgSO4·7H2O 10、KH2PO47、NaCl 5。
补料培养基 C(g/L):葡萄糖 500、酵母粉50、蛋白胨 75、MgSO4·7H2O 7、柠檬酸 3、KH2PO47、(NH4)2SO45、Na2HPO4·12H2O 3、MgCl25、NH4Cl 0.1。
1.1.3 仪器与设备
GC-14C型气相色谱仪,岛津苏州仪器有限公司;DU-800型紫外分光光度计,Beckman Coulter有限公司;RALFplus-5L生物反应器,上海宝兴生物器材有限公司;SBA40E型生物传感器分析仪,山东省生物科学研究所。
1.2 培养方法
1.2.1 种子液培养
从活化斜面挑取菌落接种至LB培养基(含终质量浓度为50 μg/mL的卡那霉素)中,37℃、150r/min振荡培养8 h,作为种子液。
1.2.2 初始发酵培养条件
种子液按2%(体积分数)的接种量接入装有2.5 L基础发酵培养基的5 L发酵罐中,在37℃、搅拌速率500r/min、通气量2 L/min条件下发酵。当OD600达到一定值时,降温至28℃,加入乳糖进行诱导。
1.3 分析方法
1.3.1 菌体干质量和葡萄糖含量测定
发酵过程中通过测定 600 nm下的吸收值OD600,并根据菌体生物量(DCW)(y)与OD600(x)线性回归方程为y=0.061 6+0.036 6x(R2=0.997 1)得到菌体生物量;发酵液中葡萄糖含量使用生物传感器分析仪测定。
1.3.2 酶活测定
以CNDE为底物,检测水解产物2-羧乙基-3-氰基-5-甲基己酸的生成量测定大肠杆菌全细胞的TLL活力。将10mL发酵液离心,得到菌体,转移至转化瓶,用10mL Tris-HCl缓冲液(50 mmol/L,pH 8.0)悬浮细胞,加入150 mmol/L醋酸钙解除产物抑制[4]。置于 40℃ 水浴摇床,加入 100 mmol/L CNDE,150r/min,反应60min后取样。样品经乙酸乙酯萃取,有机相用于气相色谱分析,色谱柱为Astec CHIRALDEX G-TA(30 m×0.25mm,0.25 μm),柱温为135℃,检测器和进样口温度均为220℃[8]。
酶活(U)单位定义:在pH 8.0,40℃条件下,每分钟水解CNDE产生1 μmol(3S)-2-羧乙基-3-氰基-5-甲基己酸所需的酶量定义为1个酶活单位。
2 结果与讨论
2.1 补料培养基对菌体生长和脂肪酶表达的影响
分别以葡萄糖补料培养基和甘油补料培养基进行补料分批发酵,考察不同补料培养基对工程菌生长和脂肪酶表达的影响,结果见图1。由图1可知:补料培养基A和B均以甘油为碳源,但氮源含量不同,菌体生长速度较慢,发酵后期出现菌体自溶现象,菌体量较低,分别为16.5和18.4g/L。补料培养基C以葡萄糖作为碳源,发酵前期菌体生长速度较快,整个发酵过程菌体持续生长,未出现菌体自溶,菌体密度比以甘油为碳源时高,且脂肪酶比酶活(496.3 U/L)也高于以甘油做碳源的补料培养基A(339.0 U/L)和B(402.1 U/L)。其原因可能是菌体代谢甘油效率低,无法满足菌体生长需要,菌体量较低。此外,发酵过程中甘油残留量高,导致发酵液黏度系数上升,供氧不足,菌体出现自溶。综合考虑培养基成本和脂肪酶表达量,选择补料培养基C进行流加补料。
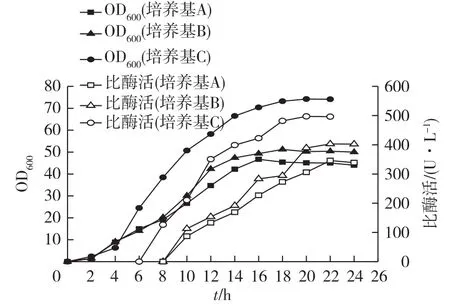
图1 补料培养基对细胞生长和脂肪酶表达的影响Fig.1 Effects of fed-batch medium on cell growth and lipase production
2.2 补料控制工艺对菌体生长和脂肪酶表达的影响
发酵过程中pH和溶解氧(DO)受菌体代谢基质影响,当发酵液的pH和溶解氧过高或过低时,均会抑制菌体的生长代谢和表达[9]。根据分批补料培养不同控制方式特点[10-11],选择在pH 7.2时进行pH反馈流加补料,当发酵液pH低于7.2时,便以一定的速率及时补入补料培养基;溶氧反馈补料则控制DO为50%,当DO大于50%时,流加补料培养基,降低搅拌转速,维持DO的稳定。考察pH反馈流加和溶氧反馈流加2种补料策略对菌体生长及酶表达的影响,结果分别见图2和图3。
由图2和图3可知:pH反馈补料(图2)和溶氧反馈补料(图3)均维持葡萄糖浓度在较低水平,减弱葡萄糖效应,实现脂肪酶的高效表达。溶氧反馈补料时,菌体量和比酶活分别为26.9g/L和501.7 U/L,均优于pH反馈补料时的菌体量(23.1g/L)和比酶活(435.3 U/L)。因此选择控制溶氧进行分批补料培养。

图2 pH反馈补料对细胞生长和脂肪酶表达的影响Fig.2 Effects of pH feed-back controlled substrate feeding on cell growth and lipase production

图3 溶氧反馈补料对细胞生长和脂肪酶表达的影响Fig.3 Effects of dissolved oxygen feed-back controlled substrate feeding on cell growth and lipase production
2.3 诱导时机对菌体生长和脂肪酶表达的影响
前期研究表明,当E.coli BL21(DE3)/pET28b-TLL的OD600大于70时进行诱导,细胞生长速率和酶活较低,在乳糖诱导终质量浓度为15g/L条件下,对诱导时机(OD600分别为20、40和60)进行优化,结果见图4。图4可知:菌体生物量和体积酶活均随诱导时菌体浓度的增加而增加。当选择在OD600=20诱导时,所得到的菌体生物量和比酶活最低,分别仅为25.8g/L和496.5 U/L;OD600=60诱导时,菌体生物量(31.6g/L)和比酶活(566.9 U/L)均达最大值。综合菌体生物量和脂肪酶表达量,选择在菌体密度OD600=60时诱导。
2.4 诱导剂浓度对菌体生长和脂肪酶表达的影响
在重组菌发酵过程中,诱导剂浓度过高或过低均不利于宿主细胞生长和目的蛋白表达。一定范围内,目的蛋白表达与诱导剂浓度成正比。诱导剂浓度对工程菌生长的影响见图5。由图5可知:选择乳糖质量浓度10和20g/L进行诱导时,诱导剂浓度不足,不能充分诱导蛋白表达,发酵终期,比酶活分别为571.3 U/L和645.7 U/L;当诱导剂质量浓度为30g/L时,比酶活可达726.3 U/L,继续提高乳糖诱导质量浓度至40g/L时,诱导剂浓度过大抑制菌体生长,目的蛋白表达降低,比酶活仅为652.1 U/L。因此,选择乳糖质量浓度为30g/L进行诱导。

图4 诱导时机对菌体生长和脂肪酶表达的影响Fig.4 Effects of induction time on cell growth and lipase production

图5 诱导剂浓度对细胞生长和脂肪酶表达的影响Fig.5 Effects of induction concentration on cell growth and lipase production
2.5 诱导方式对工程菌生长和脂肪酶表达的影响
为了获得较好的诱导效果,提高重组菌的产酶效率,考察乳糖添加次数对工程菌生长和脂肪酶表达的影响,结果见图6。由图6可知:一次性加入乳糖诱导时,造成诱导强度过大,对宿主菌造成代谢负担,发酵结束时OD600为103.1,比酶活仅为721.5 U/L。采用分3次加入乳糖的诱导效果更低(OD60097.7,比酶活589.9 U/L),可能是分次加入时乳糖诱导强度不够,影响了目的基因的表达。而分2次加入诱导剂更有利菌体生长和脂肪酶的表达,OD600为106.2,比酶活达到792.4 U/L。
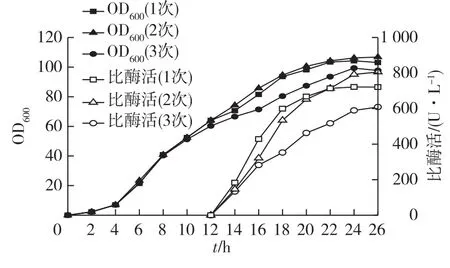
图6 诱导方式对细胞生长和脂肪酶表达的影响Fig.6 Effects of induction methods on cell growth and lipase production

图7 工程菌溶氧反馈分批补料发酵过程Fig.7 Fermentation of genetic engineering bacteria with DO feed-back controlled substrate feeding
2.6 优化后的分批补料发酵
通过对补料培养基、补料方法、诱导等条件进行优化,最终确定5 L发酵罐中分批补料发酵工艺:溶氧反馈-分批补料发酵,选择补料培养基C进行分批补料,当DO高于50%时,补料泵以10mL/min速率进行补加补料培养基,当DO低于50%时,停止补加。菌体生长阶段温度控制在37℃,12 h后降温至28℃诱导表达,分别在12 h和18 h时加入45g乳糖,使诱导剂终质量浓度为30g/L,26 h时终止发酵。发酵过程中通过流加20%氨水控制pH为7.2。图7显示了发酵过程中的pH、残糖(RSC)、DO、比酶活及OD600变化。由图7可知:发酵终期菌体生物量为38.4g/L,比酶活为798.5 U/L,与优化前的菌体量16.6g/L,比酶活339.0 U/L相比,优化后的分批补料发酵工艺明显提高了菌体量和和比酶活(2.4倍),为生物酶法制备普瑞巴林关键中间体奠定了基础。
3 结论
通过对E.coli BL21(DE3)/pET28b-TLL在5 L发酵罐中分批补料发酵工艺的优化,最终确定溶氧反馈补料的控制工艺。选择葡萄糖为碳源的补料培养基进行补料,诱导时机为OD600=60,2次分批加入终质量浓度为30g/L乳糖进行诱导。在优化后发酵条件进行分批补料发酵,TLL的比酶活由优化前的339.0 U/L提高到798.5 U/L,是优化前的2.4倍。
[1]Arima K,Liu W H,Beppu T.Isolation and identification of the lipolytic and thermophilic fungus[J].Agric Biol Chem,1972,36(11):1913-1917.
[2]Singh S,Madlala A M,Prior B A.Thermomyces lanuginosus:properties of strains and their hemicellulases[J].FEMS Microbiol Rev,2003,27(1):3-16.
[3]Fernandez-Lafuente R.Lipase fromThermomyces lanuginosus:uses and prospects as an industrial biocatalyst[J].J Mol Catal B: Enzymatic,2010,62(3/4):197-212.
[4]Martinez C A,Hu S,Dumond Y,et al.Devolopment of a chemoenzymatic manufacturing process for Pregabalin[J].Org Process Res Dev,2008,12(3):392-398.
[5]雷丽华,郑仁朝,柳志强,等.Thermomyces lanuginosus ZJB09222脂肪酶基因克隆及在大肠杆菌中的表达[J].食品与发酵工业,2012,38(5):56-60.
[6]Salehmin M N I,Annuar M S M,Chisti Y.High cell density fedbatch fermentation for the production of a microbial lipase[J]. Biochem Eng J,2014,85(15):8-14.
[7]Lee J,Lee S Y,Park S,et al.Control of fed-batch fermentations[J].Biotechnol Adv,1999,17(1):29-48.
[8]Li X J,Zheng R C,Ma H Y,et al.Engineering of Thermomyces lanuginosus lipase Lip:creation of novel biocatalyst for efficient biosynthesis of chiral intermediate of Pregabalin[J].Appl Microbiol Biotechnol,2013,98(6):2473-2483.
[9]Tashiro Y,Takeda K,Kobayashi G,et al.High butanol production by Clostridium saccharoperbutylacetonicum N1-4 in fed-batch culture with pH-stat continuous butyric acid and glucose feeding method[J].J Biosci Bioeng,2004,98(4):263-268.
[10]丛春水,苏志国,邓继先.重组大肠杆菌的分批补料培养方法[J].微生物学杂志,1998,18(4):44-47.
[11]Salehmin M,Annuar M,Chisti Y.High cell density fed-batch fermentations for lipase production:feeding strategies and oxygen transfer[J].Bioproc Biosyst Eng,2013,36(11):1527-1543.
(责任编辑 荀志金)
Optimization of fed-batch fermentation for Thermomyces lanuginosus lipase production with recombinant Eschericha coli
MA Hongye,ZHENG Renchao,ZHAO Chuandong,ZHENG Yuguo
(Engineering Research Center of Bioconversion and Biopurification of the Ministry of Education,Institute of Bioengineering,Zhejiang University of Technology,Hangzhou 310032,China)
To establish cost-effective Thermomyces lanuginosus lipase(TLL)production process,fedbatch fermentation of the recombinant Eschericha coli BL21(DE3)/pET28b-TLL was optimized in a 5-L bioreactor.The fed-batch medium with glucose as the main carbon source was fed by dissolved oxygen(DO)feedback method.The temperature was lowered down to 28℃ until the optical density at 600 nm reached about 60.And lactose was added twice at a final concentration of 30g/L to induce expression. Under the optimal culture conditions,the volumetric activity of TLL reached 798.5 U/L that was 2.4-fold higher than that before the optimization.This findings will provide basis industrial production of TLL.
Thermomyces lanuginosus lipase;fed-batch culture;fermentation;Eschericha coli
Q815
A
1672-3678(2015)02-0009-04
10.3969/j.issn.1672-3678.2015.02.002
2014-03-13
浙江省重大科技专项重大社会发展项目(2012C03005-2)
马红叶(1986—),女,河南南阳人,硕士研究生,研究方向:工业生物技术;郑裕国(联系人),教授,E-mail:zhengyg@zjut.edu.cn

