棘白菌素B提取液脱色工艺
邹树平,刘 苗,钟 伟,牛 坤,姚黎栋,郑裕国
(1.浙江工业大学 生物工程研究所 生物转化与生物净化教育部工程研究中心,浙江 杭州 310032;2.浙江震元制药有限公司,浙江 绍兴 312071)
棘白菌素B提取液脱色工艺
邹树平1,刘 苗1,钟 伟1,牛 坤1,姚黎栋2,郑裕国1
(1.浙江工业大学 生物工程研究所 生物转化与生物净化教育部工程研究中心,浙江 杭州 310032;2.浙江震元制药有限公司,浙江 绍兴 312071)
研究碱性阴离子交换树脂WD-6对发酵棘白菌素B(ECB)提取液的脱色效果。通过对ECB提取液和ECB标准溶液的全波长扫描,确定ECB提取液中色素的最佳吸收波长为315 nm;考察了树脂添加量、脱色温度、摇床转速和脱色时间对脱色率和ECB损失率的影响,获得最佳脱色工艺:树脂添加量4% (质量分数),脱色温度30℃,摇床转速150r/min,脱色时间100min。在此条件下,ECB提取液的脱色率可达88.3%,ECB损失率仅为4.8%。
棘白菌素B;脱色;离子交换树脂
棘白菌素类抗生素是新一代临床治疗真菌感染的抗真菌药物,该类抗生素能够非竞争性抑制真菌细胞壁β-1,3-葡聚糖合成酶的活性,作用机制独特,毒副作用低,且对一些唑类和两性霉素B耐药的真菌抗菌活性强[1]。目前已经上市的棘白菌素类药物有卡泊芬净(caspofungin)、米卡芬净(micafungin)和阿尼芬净(anidulafungin)[2]。棘白菌素B(echinocandin B,ECB)是由构巢曲霉(Aspergillus nidulans)发酵产生的一种次级代谢产物,是合成阿尼芬净的前体化合物[3]。ECB分子式为C52H81N7O16,相对分子质量为1 060.2,化学结构式如图1所示。
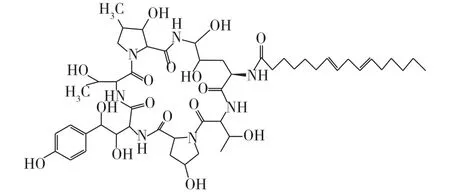
图1 棘白菌素B结构式Fig.1 Structure of echinocandin B
构巢曲霉发酵生产ECB的周期较长,发酵后期有大量的色素产生[4]。ECB存在于构巢曲霉菌丝体内,用有机溶剂浸提ECB时,由于色素物质的存在,提取液一般呈橙黄色。若不经过脱色处理,不仅会降低后续产品的回收率及纯度,还会影响最终产品的色泽[5]。张雪霞等[6]在提取ECB过程中,通过树脂吸附解吸后,在解吸液中添加1%活性炭脱色,脱色不完全。Kery等[7]在用异丁醇萃取 ECB后,浓缩异丁醇相,用酸洗后加入活性炭脱色,可以使萃取液澄清,但ECB损失较大。张磊等[8]在浓缩液中加入有效组分2.5倍体积的Al2O3于20℃下脱色,虽然脱色效果良好,但使用的脱色剂Al2O3价格昂贵,难以工业化应用。本文中笔者选用广泛使用的碱性阴离子交换树脂WD-6对ECB提取液进行脱色研究,以期获得良好的脱色效果。
1 材料与方法
1.1 仪器与材料
高效液相色谱,日本岛津公司;酶标仪,美谷分子仪器(上海)有限公司;Eppendorf 5810R型离心机,德国Eppendorf公司;蛋白层析仪,美国Bio-Rad公司。
ECB发酵菌丝体,浙江工业大学生物工程研究所ZJB09223构巢曲霉发酵;ECB标准品,澳大利亚BioAustralis公司;WD-6碱性阴离子树脂,安徽皖东树脂有限公司;甲醇、乙腈(色谱纯),中国百灵威试剂公司;其他试剂均为国产分析纯。
1.2 ECB提取液的制备
将构巢曲霉发酵液离心,收集菌丝体,称取一定质量菌丝体,按照m(菌丝体)∶V(乙醇)=1∶1.5加入乙醇溶液,于35℃下搅拌浸提2 h,总共浸提3次。收集乙醇浸提液,用蒸馏水将乙醇稀释到体积分数40%,加入预处理好的HP20大孔吸附树脂吸附4 h,吸附完成后加入纯乙醇解吸3 h,解吸后的ECB溶液,调pH为6,即为本实验用到的样品。
1.3 树脂的预处理
将WD-6碱性阴离子树脂用质量分数5%的NaCl溶液浸泡4 h,接着用蒸馏水反复洗涤,洗净表面的NaCl,然后加入5%的NaOH溶液浸泡4 h,用蒸馏水反复洗涤,直到洗出液的pH为7,于60℃下烘干。
1.4 静态和动态吸附实验
静态吸附实验:在恒温水浴摇床中进行,测定WD-6树脂吸附前后提取液中色素的吸光值以及ECB的浓度,计算提取液的脱色率和 ECB的损失率。
动态吸附实验:在Bio-Rad蛋白层析柱中进行,装载WD-6树脂8g,通过自动收集装置,毎5mL流出液收集1次,实验完成后需测定样品收集液中色素的吸光值和ECB的浓度,计算提取液的脱色率和ECB的损失率,绘制脱色洗脱曲线图。
1.5 分析方法
1.5.1 色度的测定
在波长为200~450 nm范围内对ECB提取液和ECB标准溶液进行对比扫描,以确定提取液中色素的最佳吸收波长。
1.5.2 脱色率的计算
提取液脱色率计算按式(1)进行。

式中:A1为脱色前吸光值,A2为脱色后吸光值。
1.5.3 ECB浓度及损失率的计算
采用高效液相色谱法测定ECB的浓度,高效液相色谱条件参照文献[9]。色谱柱:伊利特Hypersil ODS2 5 μm×4.6mm×250mm;检测器为PDA;检测波长222 nm;流动相V(甲醇)∶V(超纯水)∶V(乙腈)=7∶2∶1;进样量20 μL;流速1mL/min;柱温箱40℃。ECB的损失率按照式(2)计算。

式中:ρ1和 ρ2分别为脱色前、后 ECB质量浓度(mg/L)。
1.5.4 平衡吸附量及平衡时溶液中色素浓度的测定[10]
当吸附平衡后,单位质量树脂所吸附色素的量称为平衡吸附量(g/g),用Qe表示,计算见式(3);剩余色素的相对含量用C表示,其计算见式(4)。

2 结果与讨论
2.1 ECB提取液色度的确定
取一定ECB提取液和ECB标准液,在波长范围为200~450 nm范围内对样品进行扫描,结果如图2所示。由图2可知,有色素的提取液与标准液的吸光度最大差值在310~320 nm处,所以选取315 nm为提取液中色素的测定波长。
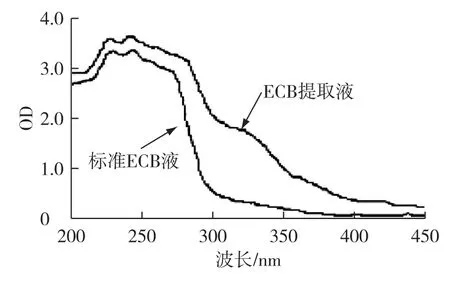
图2 样品和标准品全波长扫描Fig.2 Curves of wavelength scanning between sample and standard
2.2 树脂添加量对脱色效果的影响
在脱色过程中,既要保证树脂对色素尽可能大的吸附量,又要减少对ECB的吸附。取10mL ECB提取液,添加不同质量的WD-6脱色树脂,在30℃、150r/min条件下,静态吸附3 h,结果如图3所示。由图3可知:树脂添加量(质量分数)从2%增加到4%时,提取液脱色率也明显提高;但当树脂添加量超过4%后,脱色率基本不变,这可能是树脂对色素的吸附已达到平衡。而随着树脂添加量的增大,ECB损失率却不断上升,可能是树脂对ECB仍有一定的吸附作用。因此,综合考虑到脱色率和ECB损失率这2个因素,以4%作为WD-6树脂的最适添加量。
2.3 温度对脱色效果的影响
取10mL ECB提取液,添加质量分数 4% WD-6树脂,摇床转速为150r/min,在不同温度下静态吸附3 h,实验结果如图4所示。由图4可以看出:随着温度的上升,脱色率缓慢上升。这可能是由于温度上升后加速了分子扩散的速度,对色素的吸附有利,从而提高脱色率[11]。温度升高后,ECB的损失率也逐渐上升,一方面可能是由于温度的升高加速了ECB与树脂间的吸附作用;另一方面也可能是温度的升高使得ECB部分降解,导致损失率上升。因此,综合考虑,选择30℃为最佳脱色温度。
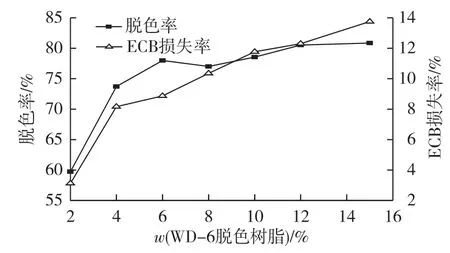
图3 树脂添加量对脱色的影响Fig.3 Effects of amount of WD-6 resin on decolouring rate
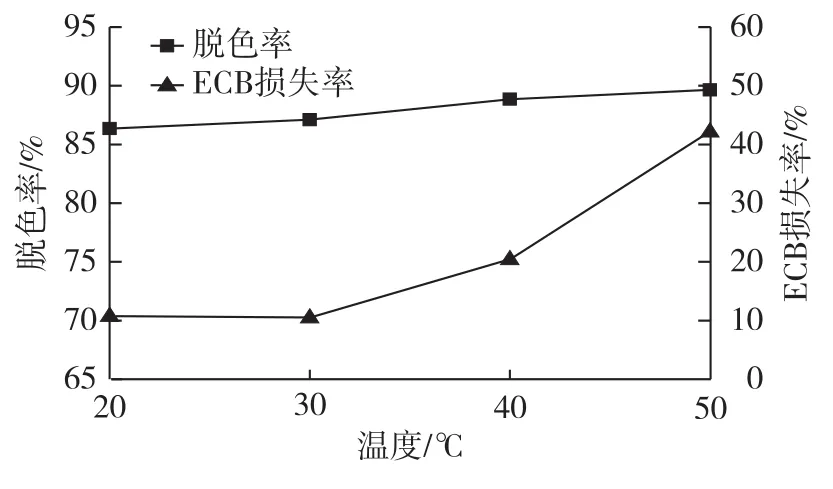
图4 温度对脱色效果的影响Fig.4 Effects of decolorization temperature on decolouring rate
2.4 摇床转速对脱色效果的影响
取20mL ECB提取液,添加质量分数4%WD-6树脂,恒温水浴摇床温度为30℃,摇床转速分别为50、100、150和200r/min,在此条件下静态吸附3 h,结果如图7所示。由图7可知,ECB的损失率并没有太大变化。对于脱色率,当摇床转速在50~150r/min时,脱色率略有上升,而随着转速继续增加,脱色率却稍有下降,可能的原因是,当摇床转速提高后,ECB提取液与WD-6脱色树脂呈高速分散状态,导致二者交换吸附并不充分,故而脱色率反而有所下降。因此,选择150r/min为脱色过程中的转速。

图5 转速对脱色效果的影响Fig.5 Effects of rotate speed on decolouring rate
2.5 脱色时间对脱色效果的影响
对于固液之间的吸附反应,达到吸附平衡过程需要一定的时间。一般吸附时间延长后,溶液中色素的浓度会越来越低,当吸附剂表面与溶液中色素浓度相等,即吸附平衡时,吸附便不再发生[12]。取50mL提取液,添加质量分数4%WD-6树脂,摇床转速设置为150r/min,于30℃下静态吸附6 h,每次间隔45min取样,测定不同时间下色素的吸光值和溶液中剩余ECB浓度,并计算提取液脱色率和ECB损失率,结果如图6所示。由图6可以看出:在前100min脱色率缓慢增加,在吸附100min后吸附基本达到饱和,但ECB损失率随时间延长继续上升。考虑到脱色效果以及ECB损失率这2个因素,确定脱色时间为100min。在此优化条件下,ECB提取液脱色率为88.3%,ECB损失率仅为4.8%。

图6 脱色时间对脱色效果的影响Fig.6 Effects of decolorization time on decolouring rate
2.6 脱色吸附等温线
目前研究吸附平衡模型的方程主要有以下3种[13]。Henry型吸附模型的表达式:G=KC+b(K、b为常数);Langmuir型吸附模型表达式:C/G=1/ab+ C/a(a、b为常数);Freundlich型吸附模型表达式:lg G=K+Nlg C(K、N为常数)。
根据3种吸附等温线公式,于30℃下对WD-6树脂吸附ECB提取液中色素的实验数据进行拟合,其拟合方程和相关系数见表1。

表1 吸附等温线的线性拟合结果Table 1 Result of linear model of adsorption isotherm line
由表1结果可知:3种吸附模型都可以描述WD-6树脂对ECB提取液中色素的吸附,但是比较相关系数R2,该吸附更符合Henry模型。其拟合结果如图5所示。由图5可知:此吸附等温式为线性,根据Henry模型的特点,说明该吸附是在低浓度下的吸附,并且吸附过程只存在单一分子的现象。
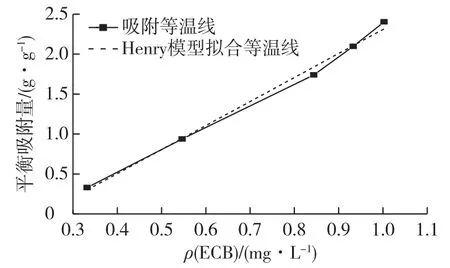
图7 WD-6吸附树脂的吸附等温线Fig.7 Adsorption isotherm line of WD-6 resin
2.7 动态吸附实验
准确称取经过预处理的WD-6干树脂8.0g,用湿法装柱装入蛋白层析柱中,样品总共150mL。在室温下,将流速设置为0.5mL/min进行动态脱色实验,每10min收集1管样品,通过酶标仪和高效液相色谱检测样品的吸光值和ECB的浓度,结果见图8。由图8可以看出:当流出液体积越来越大时,其脱色率下降较快。当提取液流出体积约80mL时,脱色率下降近一半;随着流出液体积增大,脱色效果越来越差,而ECB的损失率在下降到一定阶段后不再下降。可能是在动态吸附过程中,树脂与色素的接触时间较短,使得色素不能完全被吸附。而WD-6树脂对ECB有轻微吸附作用,随着时间的延长,树脂对ECB吸附饱和后,损失率不再升高。
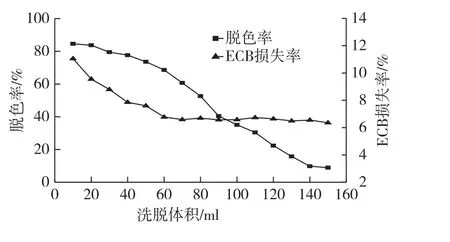
图8 ECB提取液动态脱色曲线Fig.8 Decolrization curves of echinocandin B extract
3 结论
研究碱性阴离子交换树脂WD-6对发酵棘白菌素B(ECB)提取液的脱色效果。当WD-6树脂添加量为4%(质量分数)、脱色温度为30℃、摇床转速为150r/min、脱色时间为100min时,WD-6树脂对ECB提取液的脱色率可达到88.3%以上,而ECB损失率仅为4.8%。说明WD-6树脂能够较好地吸附ECB提取液中的色素。对WD-6树脂吸附ECB提取液中色素的吸附等温线的研究表明,该吸附反应符合Henry等温吸附模型。
[1]Kreuzman A J,Hodges R L,Swartling J R,et al.Membrane-associated echinocandin B deacylase of Actinoplanes utahensis:purification,characterization,heterologous cloning and enzymatic deacylation reaction[J].J Ind Microbiol Biotech,2000,24(3):173-180.
[2]Shao Lei,Li Jian,Liu Aijuan,et al.Efficient bioconversion of echinocandin B to its nucleus by overexpression of deacylase genes in different host strains[J].Appl Environ Microbiol,2012,79(4):1126-1133.
[3]曹国颖,傅德兴.新型棘白菌素类抗真菌药阿尼芬净[J].中国新药杂志,2005,14(11):1358-1361.
[4]郑裕国,邹树平,牛坤,等.一种发酵法制备棘白菌素B的方法及菌株:中国,201310477670.8[P].2013-10-12.
[5]秦为辉,张晓琳,陈新,等.多杀菌素提取液的脱色工艺研究[J].中国抗生素杂志,2011,36(1):48-52.
[6]张雪霞,王海燕,李晓露,等.Echinocandin B的分离纯化工艺研究[J].中国抗生素杂志,2012,37(3):216-219.
[7]Kery V,Csorvasi A,Seress P,et al.Purification processes for echinocandin-type compounds:US,20080108806[P].2008-05-08.
[8]张磊,杨洋,郭东初,等.一种从发酵液中提取棘白菌素类物质的方法:中国,201210064411.1[P].2013-09-18.
[9]李继安,卢亮,颜晨晨,等.棘白菌素B的纯化:中国,2009101-33117.6[P].2009-04-01.
[10]刘元法,裘爱泳,王兴国.Freundlich方程在不同吸附剂的油脂脱色体系中的应用[J].食品与生物技术学报,2007,26(1):1-4.
[11]欧阳艳,李紫薇,腊萍,等.棉籽壳木聚糖提取液的脱色工艺研究[J].食品研究与开发,2013,34(5):60-65.
[12]江波,陈超,沐万孟,等.苯乳酸发酵液脱色体系中活性炭吸附的研究[J].食品工业科技,2008,29(3):59-63.
[13]于瑞莲,胡恭任.苯酚在滩涂沉积物上的吸附特性[J].生态环境,2004,13(4):535-537.
(责任编辑 管 珺)
Decoloring of echinocandin B extraction
ZOU Shuping1,LIU Miao1,ZHONG Wei1,NIU Kun1,YAO Lidong2,ZHENG Yuguo1
(1.Engineering Research Center of Bioconversion and Biopurification of the Ministry of Education,Institute of Bioengineering,Zhejiang University of Technology,Hangzhou 310032,China;2.Zhejiang Zhenyuan Pharmaceutical Co.Ltd.,Shaoxing 312071,China)
Decoloring of echinocandin B(ECB)extract by ion exchange resin WD-6 was investigated. Through full wavelength scanning of ECB extract and ECB standard,best absorbance of pigment was determined at 315 nm.The effects of resin(WD-6 resin)content,decoloring temperature,rotation speed and adsorption time on decoloring and loss of ECB were studied.The optimal operation conditions were as follows:resin content 4%(w/w),decolourization temperature at 30℃,rotation speed 150r/min and adsorption time 100min.Under these conditions,the decolorization rate was above 88.3%,with ECB loss rate of 4.8%.
echinocandin B;decoloring;ion exchange resin
TQ465.5
A
1672-3678(2015)02-0098-05
10.3969/j.issn.1672-3678.2015.02.019
2014-03-20
国家重点基础研究发展计划(973计划)(2011CB710806);教育部博士点新教师基金(2012331712004)
邹树平(1980—),男,湖南常德人,博士,副教授,研究方向:微生物药物发酵与产业化开发;郑裕国(联系人),教授,E-mail:zhengyg@ zjut.edu.cn

