流苏花总黄酮超声提取工艺及抗氧化活性研究
孙鲜明,李小方,邓瑞雪,刘一琼,侯学文,省永朋,刘 普
(河南省伏牛山野生药材基源工程技术研究中心,河南科技大学化工与制药学院,河南洛阳471023)
流苏花总黄酮超声提取工艺及抗氧化活性研究
孙鲜明,李小方,邓瑞雪,刘一琼,侯学文,省永朋,刘普*
(河南省伏牛山野生药材基源工程技术研究中心,河南科技大学化工与制药学院,河南洛阳471023)
研究流苏花中总黄酮超声辅助提取最佳工艺条件,并评价提取总黄酮的抗氧化活性。在单因素实验的基础上,以总黄酮的得率为指标,采用响应面法优化总黄酮超声提取条件;并通过总黄酮清除O2-·、DPPH·和·OH及抗脂质体过氧化等的能力来研究其抗氧化活性。流苏花总黄酮的最佳提取工艺条件为:乙醇体积分数为65%,液料比为37∶1 mL/g,水浴温度54℃,超声时间40 min,在此条件下,总黄酮的得率达到10.736%。流苏花总黄酮对O2-·、DPPH·和·OH具有较好的清除作用,具有较好的抗脂质过氧化活性,并与总黄酮的浓度呈一定的量效关系。利用响应面分析法分析结果可靠,得到了流苏花总黄酮超声辅助提取的最佳工艺条件,提取得到的总黄酮具有较好的抗氧化活性。
流苏花,总黄酮,超声波辅助提取,响应面法,抗氧化
流苏树(Chionanthus retusa Lindl et Paxt)为木犀科流苏树属植物,又名花木、萝卜丝花、油根子、牛荆子、四月雪,为国家二级保护植物。流苏树主要分布于黄河中下游及其以南地区[1]。《中国经济植物志》中记载,流苏树的芽、叶具有消暑止渴功效,主治中暑。民间有在春天采流苏的嫩叶和花,制作茶饮用的历史。用流苏花制作的茶称为“糯米花茶”,清香爽口,别具一番风味[2-3]。流苏花作为一种珍贵的民间茶原料正因其特殊的风味及功能受到越来越多的关注。胡喜兰等[4]研究了由流苏叶及花制成的“糯米茶”和“糯米花茶”中有效成分,明确了其中含有较多的多酚类化合物,并证明这些多酚类物质具有较好抑制DPPH自由基的活性。并通过分离进一步证实其中含有黄酮类化合物,并初步探索了黄酮类化合物的抗氧化活性[5]。
课题组前期对流苏花的化学成分进行了研究,证明其中主要含有黄酮类成分[6]。本文继续研究流苏花中黄酮类成分的提取工艺及抗氧化活性,以期为流苏花的进一步研究开发提供参考。
1 材料与方法
1.1材料与仪器
流苏花材料采自伏牛山区的嵩县,经河南农业大学高致明教授鉴定为木犀科(Oleaceae)流苏树属(Chionanthus)植物流苏(Chionanthus retusa Lindlet Paxt)的花和少量嫩叶;卵磷脂、2-硫代巴比妥酸(TBA)、三氯乙酸、三羟甲基氨基甲烷(Tris)、1,1-二苯基-2-三硝基肼(DPPH)、还原性烟酰胺腺嘌呤核苷酸(NADH)、吩嗪甲酯硫酸盐(PMS)、氯化硝基四氮唑(NBT) 分析纯,阿拉丁化学有限公司;水杨酸、磷酸氢二钠、磷酸二氢钠、硫酸亚铁、双氧水、无水乙醇、氢氧化钠、硝酸铝、亚硝酸钠分析纯,天津市科密欧化学试剂有限公司;芦丁标准品本实验室自制,经核磁和HPLC测定,纯度大于98%;二次蒸馏水自制。
Ymnl-2008DE智能温控双频超声波萃取仪超声频率25 KHz和40 KHz,超声功率100~1500 W连续可调,南京以马内利仪器设备有限公司;RE-2000A型旋转蒸发器巩义予华仪器有限责任公司;FA2004电子天平天津市天分分析仪器厂;YXJ-A型高速大容量电动离心机江苏金坛市环宇科学仪器厂;SB-2A型紫外分光光度仪天津市天分分析仪器厂。
1.2研究方法
1.2.1流苏花总黄酮的提取工艺流苏花室温下于阴凉处阴干,粉碎,过20目筛,准确称取1.0 g流苏花,加入到离心管中,按照实验设计的条件,加入一定质量倍数、一定浓度的乙醇,设定超声萃取仪的超声频率为40 KHz,超声功率为1000 W,控制一定的超声时间及超声波水浴温度进行提取。提取完成后,6000 r/min离心10 min,收集提取液。重复提取3次,合并提取液,定容于容量瓶中,测定总黄酮含量。
1.2.2总黄酮的定量测定
1.2.2.1芦丁标准曲线的制作以芦丁为对照品,按照参考文献[7]的方法精确称取0.0103 g芦丁标准品,加入体积分数为70%的乙醇溶液溶解,定容至50 mL,然后分别取一定量的溶液,分别加入到容量瓶中。取一定量的芦丁溶液,加入显色剂,用紫外分光光度仪在510 nm处测定溶液吸光度,对照组为不加入芦丁标准品。以浓度为横坐标,以吸光度为纵坐标,建立标准曲线。
1.2.2.2流苏花总黄酮得率的测定取一定量的黄酮提取物,准确称重,溶解后,按照文献[7]的方法加入显色剂,用紫外分光光度仪在510 nm处测定溶液吸光度,然后根据芦丁标准曲线计算总黄酮的含量,然后根据下列公式计算总黄酮得率。
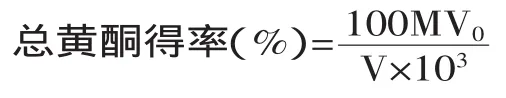
式中:M—一定体积测试液中总黄酮含量/mg;V—测定时所吸取样品试液的体积;V0—离心后定容的总体积;103—质量换算因数。
1.2.3单因素实验设计
1.2.3.1液料比对流苏花总黄酮得率的影响称取五份样品,设置液料比分别为10∶1、20∶1、30∶1、40∶1、50∶1(mL/g),在超声时间为30 min,超声提取温度为45℃,乙醇体积分数为65%条件下提取。每组实验做3组平行。
1.2.3.2乙醇体积分数对流苏花总黄酮得率的影响
准确称取六份样品,设置乙醇体积分数分别为35%、45%、55%、65%、75%、85%,固定液料比为30∶1(mL/g),提取时间为30 min,提取温度为45℃。每组实验做3组平行。
1.2.3.3超声时间对流苏花总黄酮得率的影响准确样品五份,设置超声时间分别为10、20、30、40、50 min,固定乙醇体积分数为65%,液料比为30∶1 mL/g,提取温度为45℃。每组实验做3组平行。
1.2.3.4水浴温度对流苏花总黄酮得率的影响准确称取五份样品,设置水浴温度分别为35、45、55、65、75℃,固定提取流苏花黄酮时乙醇体积分数为65%,液料比为30∶1 mL/g,提取40 min。每组实验做3组平行。
1.2.4响应面优化实验在单因素实验结果基础上,选取乙醇体积分数、液料比、超声时间、水浴温度对流苏花总黄酮得率影响较大的因素,根据Box-Beknhen中心组合实验设计原理,设计4因素3水平的响应面实验[8]。总共进行29次实验,每个实验点重复3次,结果取3次数据的平均值。采用随机化的原则以减少随机误差。实验安排见表1。

表1 响应面实验因素和水平表Table 1 Coded values and corresponding actual values of the optimization parameters used in response surface analysis
1.2.5流苏花总黄酮的抗氧化活性测定
1.2.5.1总黄酮对O2-·清除率测定O2-·的测定用NADH-PMS-NBT法[9]测定:采用Tris-HCl缓冲液(浓度0.05 mmol/L,pH8.0)将流苏花总黄酮粗提物溶液稀释成不同的浓度梯度,用移液管从不同浓度的黄酮溶液中各取1.5 mL分别置于5 mL容量瓶中,依次在各个容量瓶中加入0.5 mL 300 μmol/L的NBT(用pH8.0的Tris-HCl缓冲液进行配制),0.5 mL 468 μmol/L的NADH(用pH8.0的Tris-HCl缓冲液进行配制),0.5 mL 60 μmol/L的PMS(用pH8.0的Tris-HCl缓冲液进行配制),充分混匀之后,25℃水浴5 min,在波长为560 nm条件下测定吸光度,以缓冲液作为空白对照。
E(O2-·)(%)=(1-A0/A1)×100
式中:E(O2·-)—总黄酮提取液对O2·-的清除率(%);A1—总黄酮提取液的吸光度;A0—空白对照组的吸光度。
1.2.5.2总黄酮对DPPH·清除率测定参考文献[10]的方法:从已配好的各个浓度的总黄酮提取物中各取2 mL于容量瓶中,再向其中加入浓度为0.04 mg/mL的DPPH溶液2 mL,混合均匀,室温下反应20 min,离心,吸取上清液,在波长为517 nm处测定样品的吸光度为A1。另外,再各取2 mL上述不同浓度的总黄酮溶液置于容量瓶中,分别向其中加入无水乙醇2 mL,室温下反应20 min,离心,取上清液,在波长517 nm处测定样品的吸光度为A2;以2 mL 0.04 mg/mL的DPPH和2 mL无水乙醇反应做为参比,其吸光度记为A0。
E(DPPH·)(%)=[1-(A1-A2)/A0]×100
式中:E(DPPH·)—总黄酮提取液对DPPH自由基的清除率(%);A0—2 mL DPPH溶液+2 mL无水乙醇反应后的吸光度;A1—2 mL DPPH溶液+2 mL总黄酮提取液的吸光度;A2—2 mL无水乙醇+2 mL总黄酮提取液的吸光度。
1.2.5.3总黄酮对·OH清除率的测定参考文献[11]方法:从已配好的各个浓度的总黄酮提取物中各取2 mL溶液于容量瓶中,先向其中加入2 mL 6 mmol/L的FeSO4,再加入2 mL 6 mmol/L的H2O2,混合均匀,室温下静置10 min,最后加入2 mL 6 mmol/L的水杨酸,混合均匀,室温下静置30 min。在波长为510 nm处测定其吸光度,用二次蒸馏水代替水杨酸并测定吸光度,以二次蒸馏水做空白对照。
E(·OH)(%)=[1-(A1-A2)/A0]×100
式中:E(·OH)—羟基自由基的清除率(%);A1—总黄酮提取物反应的吸光度;A2—有无水杨酸参加反应时总黄酮提取物的吸光度;A0—空白吸光度。
1.2.5.4总黄酮抗脂质体过氧化活性的测定参考文献[12]的方法:向10 mL容量瓶中分别加入不同质量浓度的总黄酮提取物样品溶液各1.00 mL,卵磷脂溶液1.0 mL,1.0 mL 0.4 mmol/L的FeSO4,混合均匀,在37℃水浴中加热1 h,再向其中各加入2.0 mL三氯乙酸(TCA)-硫代巴比妥酸(TBA)-盐酸(HC1)混合液,然后再于100℃水浴中加热15 min后放冰箱中急速冷却,离心,吸取上清液,在波长为532 nm处测定吸光度,用二次蒸馏水作为参比,用VC作为对照组。
抑制率(%)=[A0-(A1-A2)]/A0×100
式中:A0—空白对照液的吸光度;A1—加入总黄酮提取液后的吸光度;A2—不加卵磷脂的总黄酮提取液的吸光度。
1.3数据处理
2 结果与分析
2.1芦丁标准曲线
以吸光度A为纵坐标,芦丁对照品的质量(mg)为横坐标作标准曲线,得回归方程为:M=0.992A+ 0.0012(M为芦丁标准品的质量/mg,A为吸光度),相关系数R2=0.998。
2.2单因素实验结果
2.2.1液料比对流苏花总黄酮得率的影响从图1可以得出,随着液料比的增大,流苏花黄酮的得率不断的快速升高,当液料比为30∶1(mL/g)时,达到了最大得率10.654%;之后随着液料比的增大,流苏花总黄酮的得率缓慢下降。因此,选取液料比为30∶1(mL/g)最为合适。
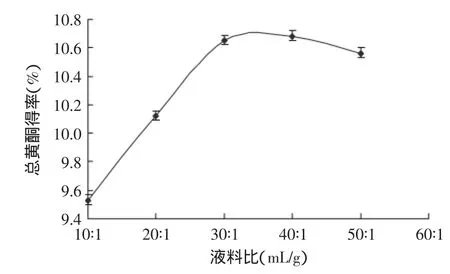
图1 液料比单因素实验Fig.1 Solid-liquid ratio single factor test
2.2.2乙醇体积分数对流苏花总黄酮得率的影响从图2可以得出,随着乙醇体积分数的增大,流苏花黄酮的得率不断的升高,当乙醇体积分数达到70%时达到最大黄酮得率10.782%;当体积分数大于70%时,流苏花黄酮的得率开始下降。因此,选用乙醇体积分数为70%最为合适。
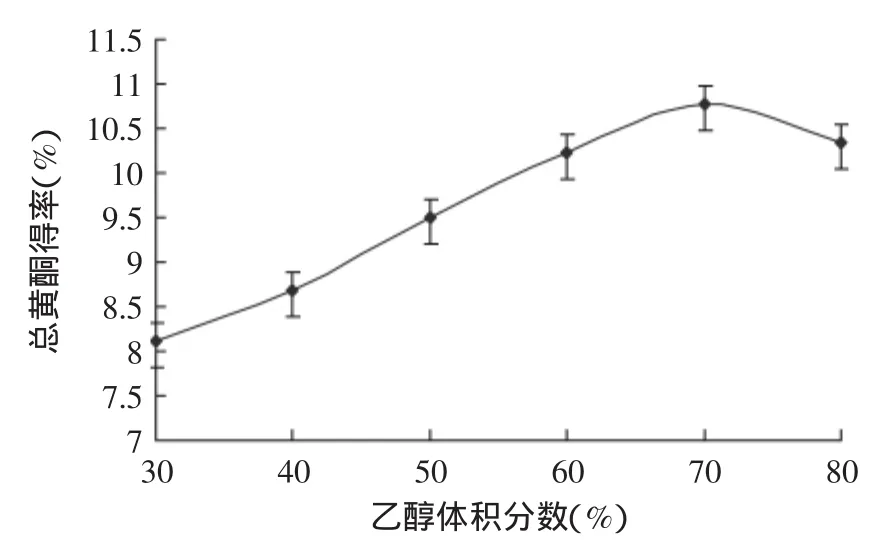
图2 乙醇体积分数单因素实验Fig.2 Ethanol volume fraction of single factor test
2.2.3超声时间对流苏花总黄酮得率的影响由图3可以看出,流苏花中黄酮的得率在6.886%~7.165%之间变化。在提取时间为10~30 min之间时黄酮得率随提取时间的增加而增大。当提取时间大于30 min黄酮的得率随时间的增加趋势变缓。因此超声的时间可以选定为30 min。
2.2.4水浴温度对流苏花总黄酮得率的影响从图4可知,流苏花黄酮的得率随着超声温度的增大而增大,在55℃时折线又下降,增大与下降的速度都较快。即在55℃的时候基本达到最大得率为8.255%,得率总的变化值为7.505%~8.255%。在最大得率的温度非常适合提取流苏花中黄酮类化学成分,而且不会导致由于高温而产生的活性物质的活性丧失。因此,选择55℃进行响应面实验。
由单因素实验确定了乙醇体积分数的选择区间为60%~80%,液料比的选择区间为20∶1~40∶1 mL/g,超声时间为20~40 min,水浴温度为45~65℃。
2.3响应面实验结果
响应面分析实验所得结果如表2所示。利用统计软件Design Expert 8对所得数据进行分析,进行回归拟合,得方程:
Y(%)=10.44-0.33A+0.51B+0.11C+0.032D+ 0.19AB+0.1AC-0.42AD+7.5E-003BC+0.013BD-0.078CD-1.29A2-0.36B2+0.01C2-0.13D2。
模型p<0.0001,表明回归模型达到了极显著水平,失拟项(p=0.0806)不显著,说明回归模型和预测值之间有较好的拟合度,能够正确反映出总黄酮得率与超声时间、乙醇体积分数、水浴温度、液料比之间的关系。因此,该模型可以用于预测总黄酮得率的实际情况。
由表3可以看出,模型的一次项A、B极显著;交互项AD显著;二次项A2、B2极显著。由此可知,自变量和响应值之间不是简单的线性关系。从F值的大小可以看出,四个因素对总黄酮得率的影响顺序为:B(液料比)>A(乙醇体积分数)>C(超声时间)>D(水浴温度)。
为了更直观地表现两个因素对流苏花总黄酮得率(综合指标)的影响,可以令其他因素水平值为零,即以乙醇体积分数、超声时间、液料比、水浴温度4个因素中两个因素取零水平时,另两个因素对流苏花总黄酮得率的影响进行分析。图5直观地反映了各因素交互作用对响应值的影响。
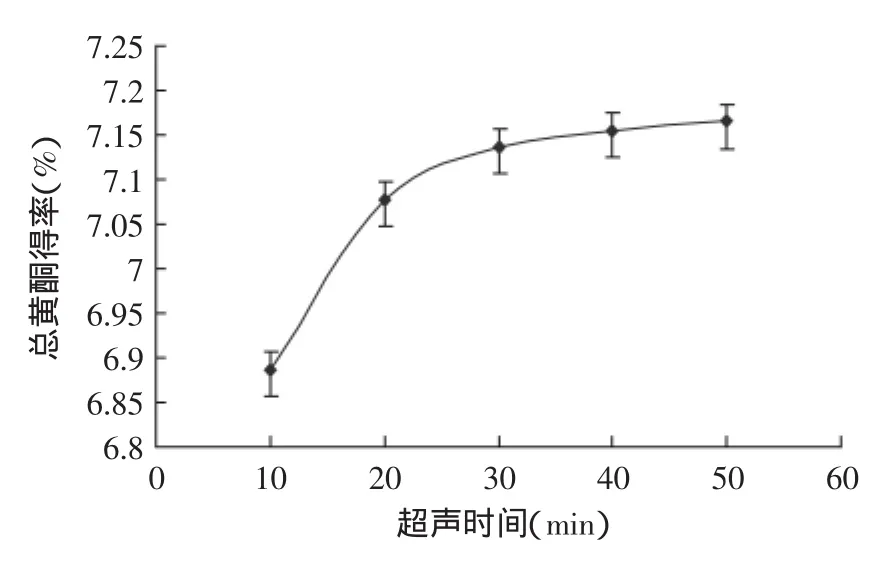
图3 超声时间单因素实验Fig.3 The ultrasonic time single factor test
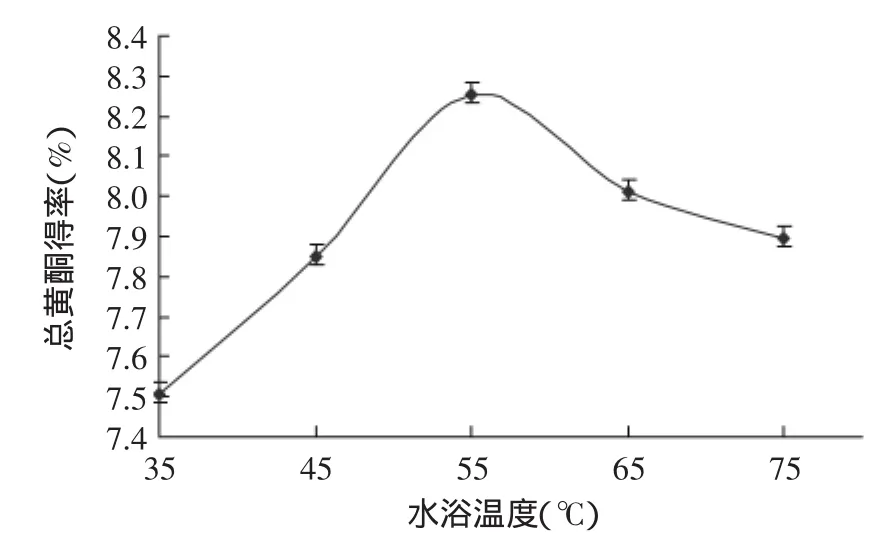
图4 水浴温度单因素实验Fig.4 The temperature of the water bath single factor test
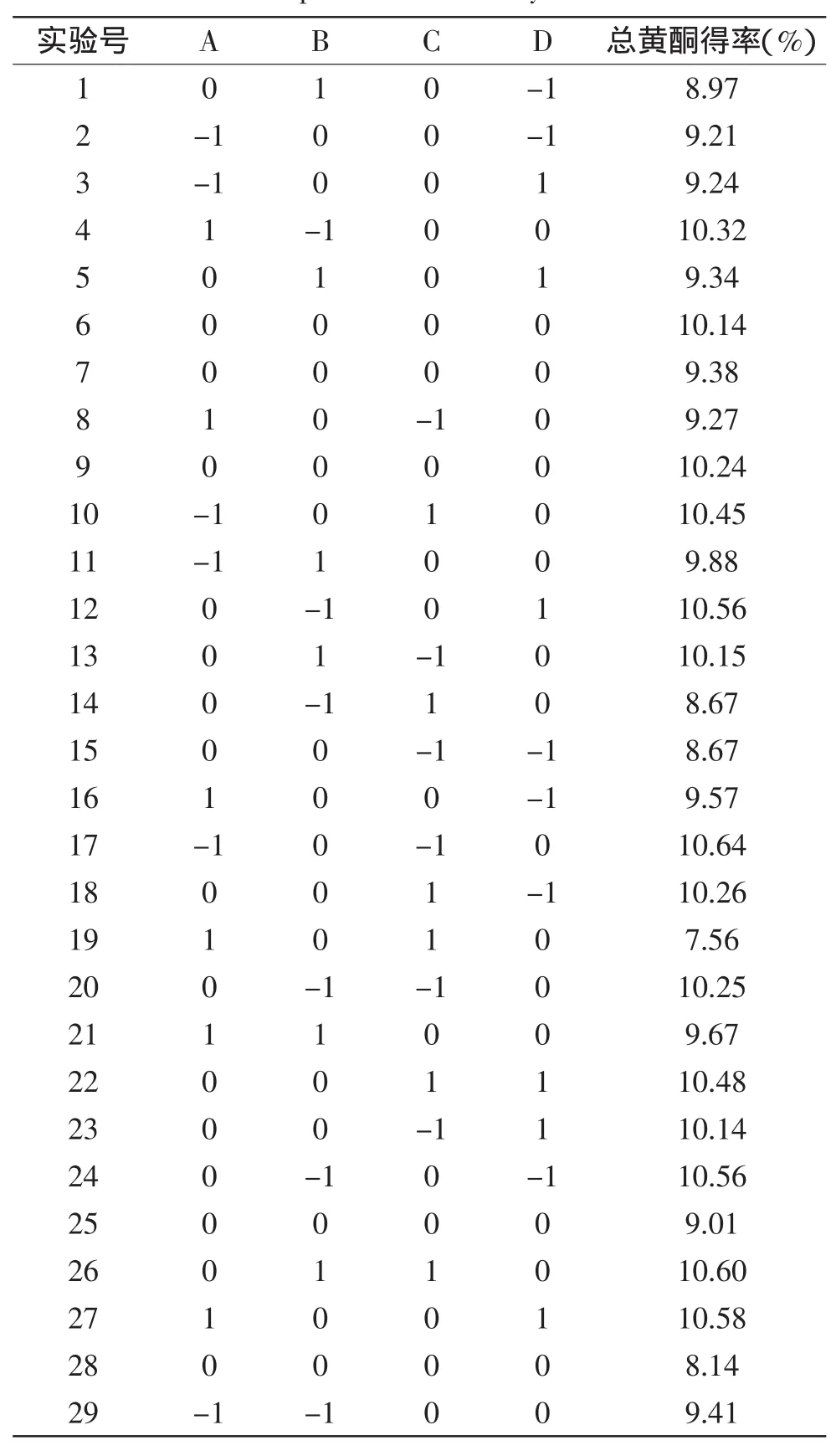
表2 响应面实验分析及结果Table 2 Experimental design and results for response surface analysis
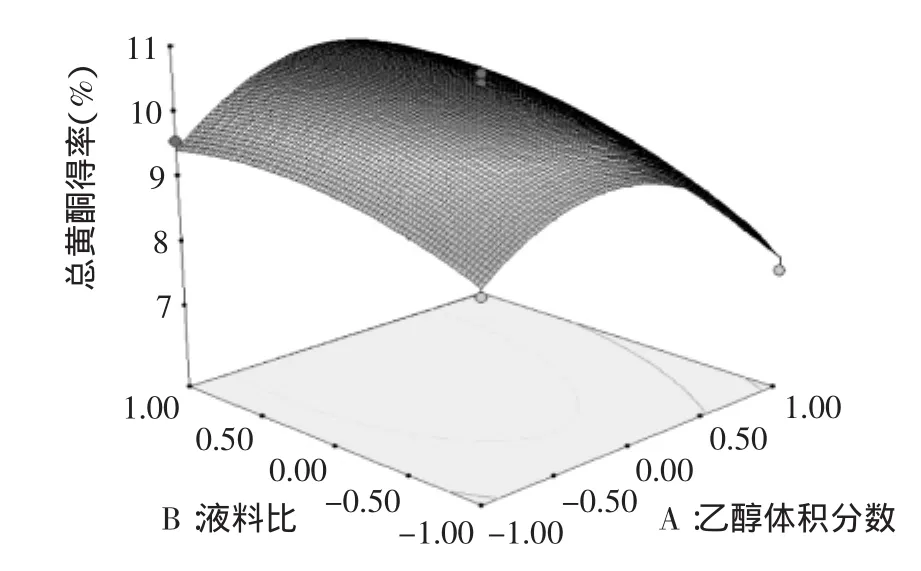
图5 液料比与乙醇体积分数对总黄酮得率影响的响应面图Fig.5 Response surface plot showing the interactive effects of liquid/material ratio and ethanol concentration on the extraction rate of total flavonoids
根据回归分析结果,得到响应面曲面图5~图10,由图5可以看出,随着液料比的增大,总黄酮的得率有明显的变化趋势,随着乙醇体积分数的增大,总黄酮的得率变化不太明显。由等高线疏密可以看出,沿液料比移动的密度大于沿乙醇体积分数的密度,表明液料比对响应面的影响更大一些。同理得出单因素对总黄酮得率的影响程度依次为B(液料比)>A(乙醇体积分数)>C(超声时间)>D(水浴温度),与F值结构相符。

表3 响应面实验方差分析结果Table 3 Analysis of variance for the fitted regression model
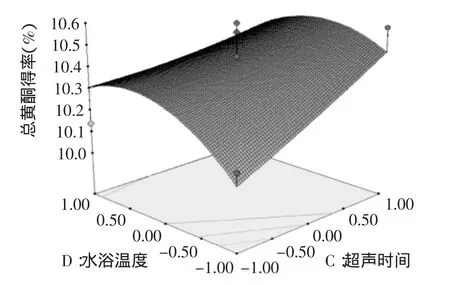
图6 水浴温度与超声时间与对黄酮得率影响的响应面图Fig.6 Response surface plot showing the interactive effects of extraction temperature and extraction time on the extraction rate of total flavonoids
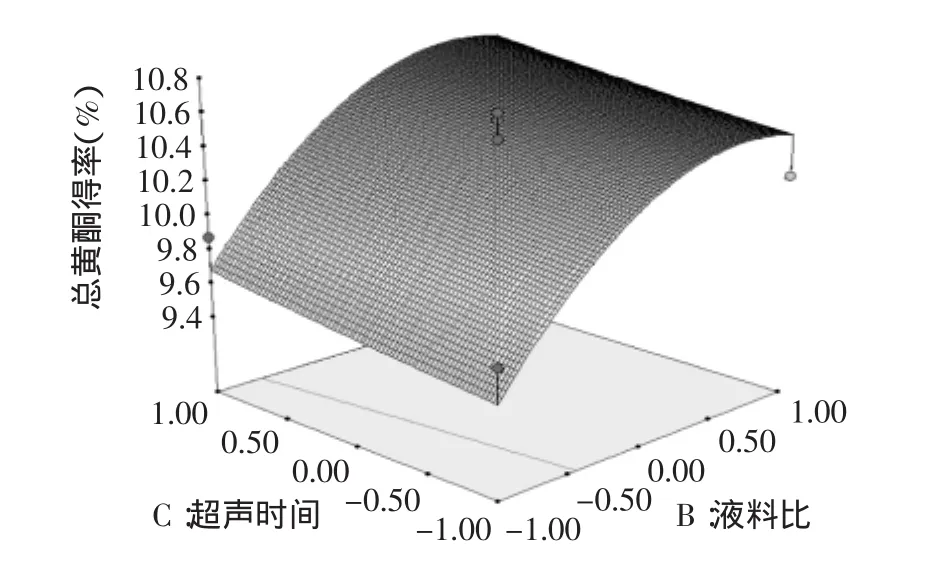
图7 液料比和超声时间对总黄酮得率影响的响应面图Fig.7 Response surface plot showing the interactive effects of liquid/material ratio and extraction time on the extraction rate of total flavonoids
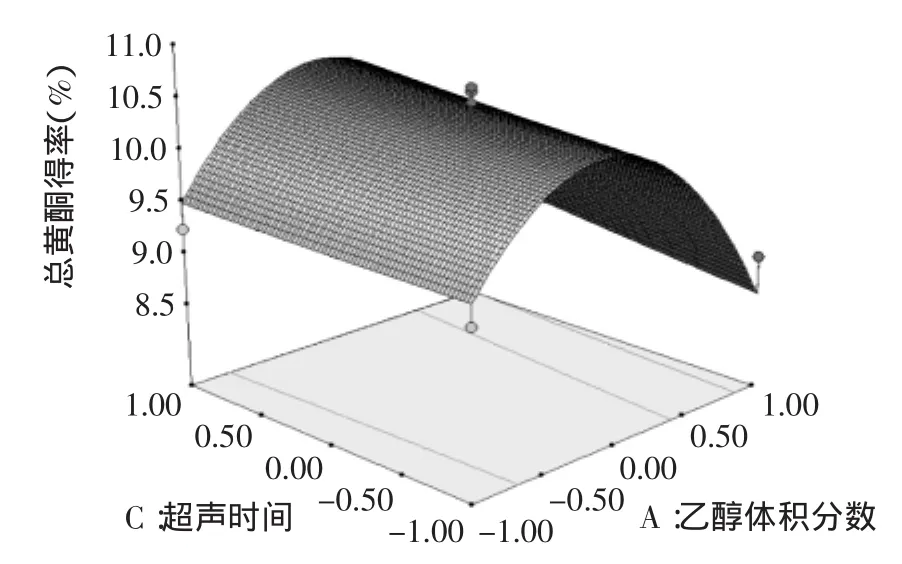
图8 超声时间与乙醇体积分数对总黄酮得率影响的响应面图Fig.8 Response surface plot showing the interactive effects of extraction time and ethanol concentration on the extraction rate of total flavonoids
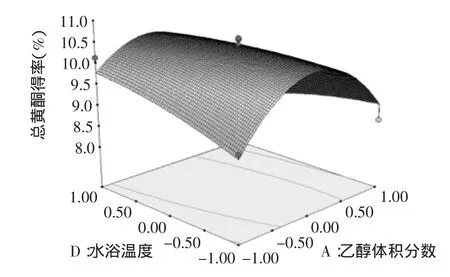
图9 水浴温度与乙醇体积分数与对黄酮得率影响的响应面图Fig.9 Response surface plot showing the interactive effects of extraction temperature and ethanol concentration on the extraction rate of total flavonoids
由响应面回归方程,通过软件的分析,得到流苏花黄酮的理论最佳提取工艺的条件:体积分数为64.67%,液料比为37.15∶1 mL/g,超声时间为40.00 min,水浴温度为53.93℃,流苏花黄酮的理论得率可达到10.7484%。考虑到实际操作,将最优条件校正为乙醇体积分数65%,液料比37∶1 mL/g,超声时间40 min,水浴温度54℃,在此条件下,总黄酮得率为10.736%。与理论预测值基本吻合,说明采用响应面法优化得到的超声提取条件参数准确可靠,具有一定的实用价值。
2.4总黄酮的抗氧化活性
2.4.1总黄酮对超氧阴离子清除率测定由图11可以看出,随着流苏花黄酮提取物浓度的增加,黄酮对超氧阴离子的清除能力也就越来越好,清除能力较强,EC50为0.03831 mg/mL。VC的清除率变化趋势与流苏花黄酮相类似,但是其清除率与黄酮相比,效果稍差。VC的EC50为0.05637 mg/mL,约为流苏花黄酮的1.6倍,这可以说明流苏花黄酮本身具有很强的超氧阴离子清除能力。
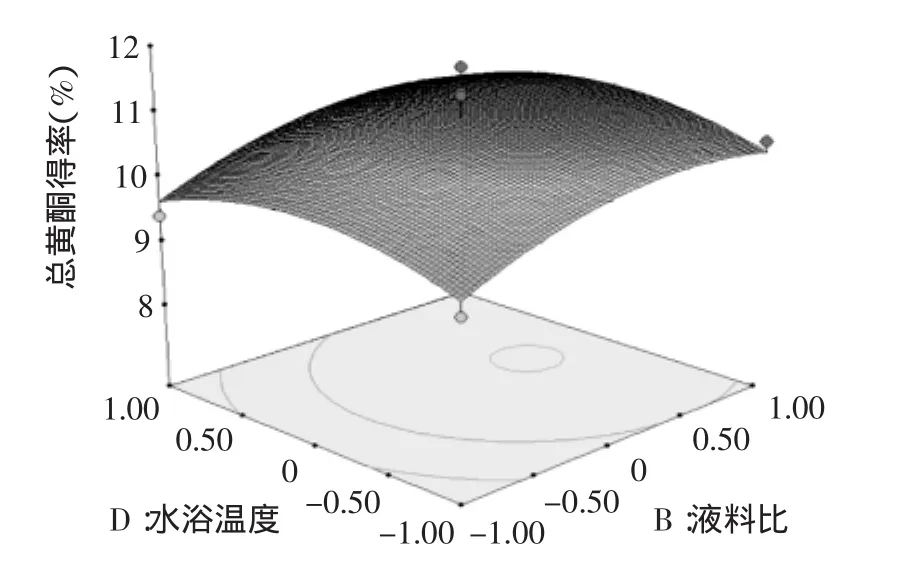
图10 水浴温度与乙醇体积分数与对黄酮得率影响的响应面图Fig.10 Response surface plot showing the interactive effects of extraction temperature and ethanol concentration on the extraction rate of total flavonoids
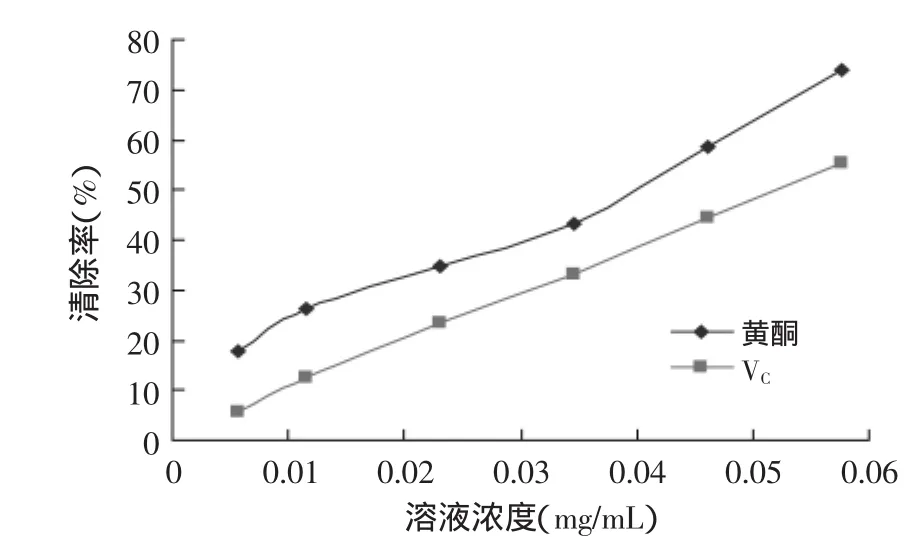
图11 超氧阴离子清除率曲线Fig.11 Curve of superoxide anion scavenging rate
2.4.2总黄酮对DPPH自由基清除率测定由图12可以看出,流苏花黄酮随着浓度的增大,对DPPH的清除率也随着增大,EC50为0.02635 mg/mL。相比之下,VC的清除率要大于流苏花黄酮的清除率,其EC50值为0.001424 mg/mL。流苏花黄酮的DPPH自由基EC50约为VC的1.85倍。流苏花黄酮的DPPH自由基清除率较VC差,但是也有一定的清除能力。
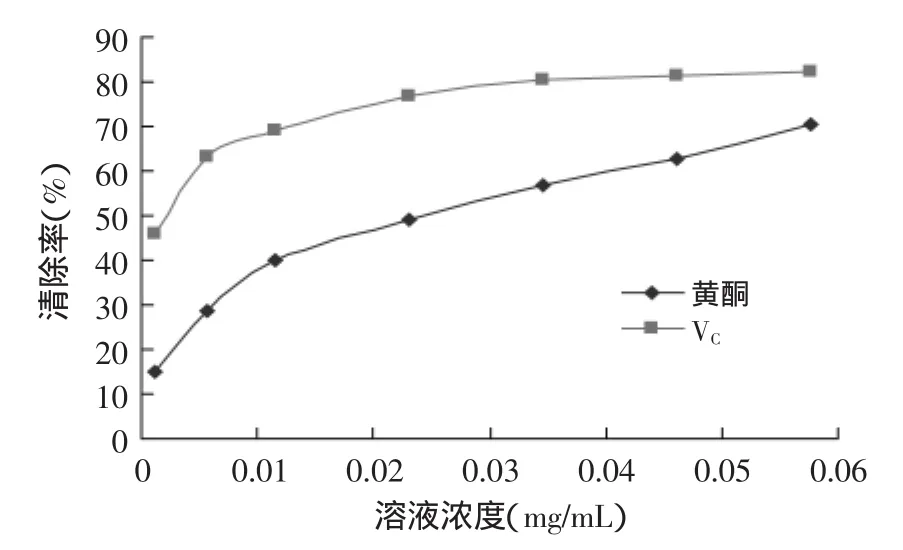
图12 DPPH自由基清除率曲线Fig.12 Curve of DPPH radical scavenging rate
2.4.3总黄酮对羟自由基(·OH)清除率的测定由图13可以看出,流苏花黄酮和VC对羟基自由基清除率的走势类似,流苏花黄酮的EC50值为0.00567 mg/mL,VC的EC50值为0.00508 mg/mL,流苏花黄酮的EC50值约是VC的1.1倍,因此流苏黄酮清除效果和VC相似,显示出较好的清除能力。
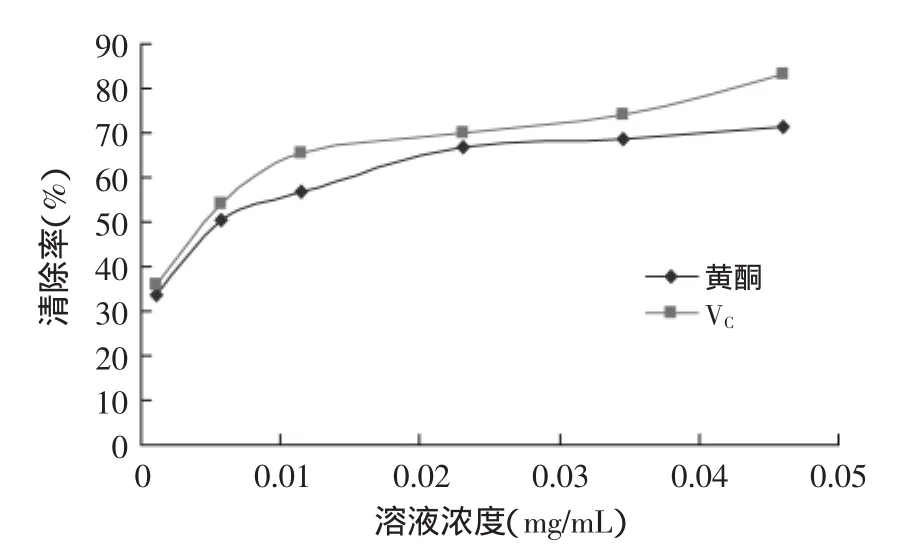
图13 羟基自由基清除率曲线Fig.13 Curve of·OH scavenging rate
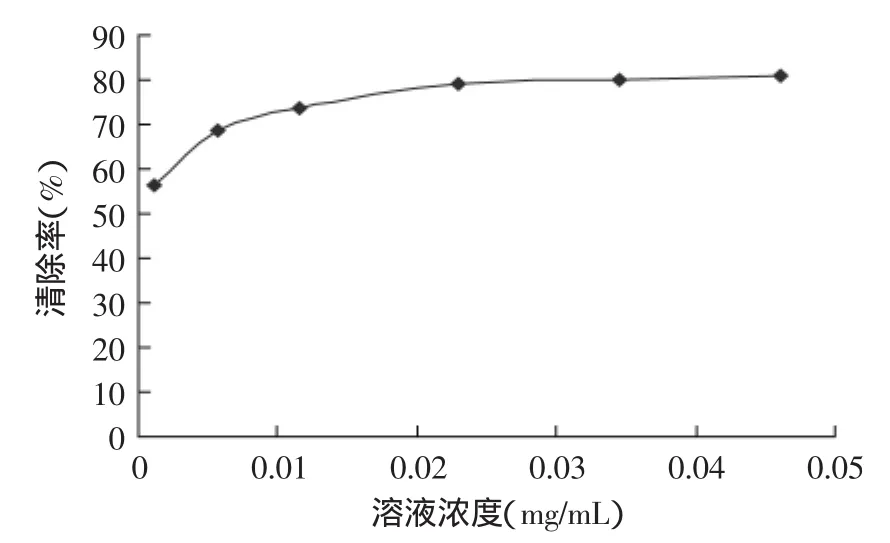
图14 抗脂质体过氧化能力折线图Fig.14 Line curve of anti-lipid peroxidation ability
2.4.4总黄酮抗脂质体过氧化活性的测定由图14可知,流苏花黄酮的质量对Fe2+引发的卵磷脂脂质体过氧化有抑制作用,随着流苏花黄酮质量浓度的增加抑制率增强,具有较强的的抗脂质体过氧化能力。
3 结论
通过单因素实验和Box-Behnken实验设计及响应面分析法,采用乙醇-水体系超声辅助提取对流苏花中的黄酮提取工艺进行了优化,得到的最佳提取条件为:乙醇体积分数65%,液料比37∶1 mL/g,超声时间40 min,水浴温度54℃,在此条件下,总黄酮得率为10.736%,与理论值吻合很好。超声技术可以有效缩短提取时间、提高得率,降低提取温度,在黄酮等活性物质提取领域具有良好的应用前景。
流苏花总黄酮对超氧阴离子、DPPH、羟基自由基等具有较好的清除能力,EC50分别为0.03831、0.02635和0.00567 mg/mL,并具有较好的抗脂质体过氧化能力。流苏花制作的“糯米花茶”在民间泡茶饮用,本实验对流苏花中黄酮成分提取工艺和体外抗氧化活性进行了研究,发现其抗氧化活性较强,可进一步对其进行深入的开发利用。
[1]杨玉梅,胡江.流苏树的繁殖栽培与园林应用[J].山东林业科技,2005,35(1):56-56.
[2]胡世才.优良饮料植物—流苏树及其枝叶泡制法[J].林业科技开发,1991,5(3):16-16.
[3]房绍坤,杜庆志,郑冬.流苏树的繁育与应用[J].国土绿化,2005,21(9):45-46.
[4]胡喜兰,姜琴,尹福军,等.花果山“糯米茶”和“糯米花茶”中有效成分提取与测定[J].食品科学,2010,31(18):112-115.
[5]胡喜兰,姜琴,尹福军,等.花果山“糯米茶”中黄酮化合物的分离纯化及活性研究[J].食品科学,2012,33(5):106-108.
[6]邓瑞雪,张创峰,刘普,等.流苏花黄酮类化学成分的分离鉴定[J].食品科学,2014,35(1):74-78
[7]吴琼英,贾俊强.柚皮黄酮的超声辅助提取及其抗氧化性研究[J].食品科学,2009,30(2):29-33.
[8]刘玉芬,夏海涛.响应面法优化碱蒿黄酮提取工艺及其体外抗氧化作用[J].食品科学,2013,33(12):63-68.
[9]LI H P,ZHANG M M,MA G J.Radical scavenging activity of flavonoids from Trollius chinensis Bunge[J].Nutrition,2011,27(10):1061-1065.
[10]AMMAR R B,BHOURI W,SGHARIER M B,et al. Antioxidant and free radical-scavenging properties of three flavonoids isolated from the leaves of Rhamnus alaternus L.(Rhamnaceae):A structure-activity relationship study[J].Food Chemistry,2009,116(1):258-264.
[11]陈利梅.超声波辅助双水相提取条斑紫菜黄酮类物质及其抗氧化活性研究[J].食品科学,2012,33(4):41-46.
[12]YANG X W,GU Z M,WANG B X,et al.Comparison of Anti-LipidPeroxidativeEffectsoftheUndergroundPartsof Notopterygium incisum and N.forbesii in Mice[J].Planta Medical,2007,57(5):399-402.
Study on the extraction technology and antioxidant activity of total flavonoids from the flower of Chionanthus retusa
SUN Xian-ming,LI Xiao-fang,DENG Rui-xue,LIU Yi-qiong,HOU Xue-wen,XING Yong-peng,LIU Pu*
(Henan Engneering Techndogy Research Center for Funiu Mountain Wild Medicinal Source,Chemical Engineering& Pharmaceutical College,Henan University of Science and Technology,Luoyang 471023,China)
To explore the optimal ultrasonic-assisted extraction conditions of total flavonoids from the flower of Chionanthus retusa Lindl et Paxt.,and evaluate the antioxidant activity.Based on the single-factor tests,the ultrasonic extraction conditions of total flavonoids from the flower of C.retusa Lindl et Paxt.were optimized by response surface methodology in order to increase the extraction rate of total flavonoids.Meanwhile,the antioxidant activity of total flavonoids was assessed by scavenging assays of hydroxyl,superoxide anion free radicals,DPPH radical and resisting lipid peroxidation.The optimal extraction conditions of total flavonoids were ethanol concentration of 65%,liquid-material ratio of 37∶1 mL/g,extraction time of 40 min and extraction temperature of 54℃.Under the optimal conditions,the maximum extraction rate of total flavonoids was 10.736%.Extracted total flavonoids had strong scavenging capacity on hydroxyl,superoxide anion free radicals and DPPH radical,and strong resisting lipid peroxidation in a dose-dependent manners.Response surface methodology was applicable for the optimization of ultrasonic extraction of total flavonoids from the flower of C.retusa Lindl et Paxt.The total flavonoids from the flower of C.retusa Lindl et Paxt.had strong antioxidant capacity.These investigations will be theoretical reference for further development and utilization of the flower of C.retusa Lindl et Paxt.
flower of Chionanthus retusa;total flavonoids;ultrasonic extraction;response surface optimization;antioxidant activity
TS201.1
B
1002-0306(2015)16-0266-07
10.13386/j.issn1002-0306.2015.16.046
2014-12-22
孙鲜明(1956-),大学本科,副教授,主要从事液相分析方法方面的研究,E-mail:sxm_1956@126.com。
刘普(1978-),博士,副教授,主要从事天然功能食品研究与开发方面的研究,E-mail:liuputju@163.com。
河南省重点科技攻关项目(122102310274)。

