活性炭对鱿鱼皮酶解液脱色效果的研究
刘振锋,戴圣佳,黄小鸣,吕卫金,陈士国,叶兴乾,*
(1.浙江宇翔生物科技有限公司,浙江杭州310024;2.浙江蓝色海洋生物科技有限公司,浙江舟山316000;3.浙江大学生物系统工程与食品科学学院,浙江杭州310058)
活性炭对鱿鱼皮酶解液脱色效果的研究
刘振锋1,2,戴圣佳1,黄小鸣1,吕卫金1,陈士国3,叶兴乾3,*
(1.浙江宇翔生物科技有限公司,浙江杭州310024;2.浙江蓝色海洋生物科技有限公司,浙江舟山316000;3.浙江大学生物系统工程与食品科学学院,浙江杭州310058)
本文优化了鱿鱼皮蛋白酶解液的脱色工艺。选用14种国内不同厂家的活性炭对酶解液进行脱色,以脱色率和蛋白质损失率为指标,在单因素实验的基础上,通过正交实验优化活性炭的脱色效果。结果表明:8号活性炭脱色效果较优且蛋白质损失率较低,通过正交实验表明,各因素对于脱色率的影响顺序为:活性炭用量>脱色时间>pH>脱色温度,对于蛋白质损失率的影响顺序为:活性炭用量>脱色温度>pH>脱色时间。综合考虑确定最佳工艺条件:活性炭用量0.3%,pH4.5,温度45℃,时间60 min,此时,脱色率达到86.78%,蛋白质损失率为17.94%。
活性炭,鱿鱼皮蛋白酶解液,正交实验,脱色
鱿鱼加工是我国重要的水产品加工业之一,然而,鱿鱼在加工过程中产生了许多副产物,其中鱿鱼皮占8%~13%左右[1-2],鱿鱼皮中胶原蛋白含量丰富,约占质量的37%[3-4],因此,可以作为一种新型的胶原蛋白资源。
鱿鱼皮蛋白经酶解后得到的酶解液呈紫黑色,影响最终产品蛋白肽粉的色泽和风味[5]。活性炭作为一种脱色剂在食品工业中应用广泛,用活性炭对酶解液进行吸附脱色在鱼肉、鱼皮脱色研究中已取得了满意的效果[6-9]。活性炭来源广泛,制作技术简单,比表面积大(300~1800 m2/g)[10],选择性高,在脱色的同时,还可有效地除嗅、除味[11-12]。活性炭有粒状和粉状两种,粉状吸附能力大,而粒状机械强度大,在使用活性炭脱色时,必须根据具体脱色要求来选择活性炭和脱色方法[13]。但是,活性炭在脱色的同时会造成蛋白质的损失,因此,寻找一种既能高效脱色,又减少蛋白质损失的活性炭是蛋白质提取工艺中的迫切需要。
国内外对活性炭脱色效果的研究较多[14-15],但是利用活性炭对鱿鱼皮蛋白酶解液进行脱色的研究较少,同时,将国内不同厂家的活性炭集中起来比较脱色效果的研究较少。本文选取14种国内不同厂家生产的活性炭对鱿鱼皮蛋白酶解液进行脱色处理,以脱色率和蛋白质损失率为指标,并且对脱色效果最优的8号活性炭脱色条件予以优化,以期找到适合工业化生产的最优工艺,为鱿鱼皮蛋白酶解液脱色的生产实践提供理论依据。
1 材料与方法
1.1材料与仪器
鱿鱼皮购于舟山鱿鱼加工厂,清洗沥干后贮藏于-20℃冰箱;碱性蛋白酶(2.4 AU/g)天津市(中国)诺维信生物制药有限公司;风味蛋白酶(500 LAPU/g) 天津市(中国)诺维信生物制药有限公司;木瓜蛋白酶(20万U/g) 广西南宁庞博生物工程有限公司;活性炭购自国内14家活性炭公司;硫酸铜、浓硫酸、硫酸钾、氢氧化钠等杭州捷成生物科技有限公司。
HH2型数显恒温水浴锅国华电器有限公司;UV-2550型紫外可见分光光度计日本SHIMADZU公司;台式冷冻高速离心机美国Thermo Scientific公司;Milli-Q超纯水装置美国MILLIPORE公司;Kjeltec 2300全自动凯氏定氮仪瑞典FOSS公司;DELTA 320 pH计瑞士METTLER TOLEDO公司。
1.2实验方法
1.2.1鱿鱼皮蛋白酶解液的制备
1.2.1.1鱿鱼皮预处理将鱿鱼皮解冻后放入0.5% NaOH(1∶5,w/v)浸泡过夜,之后用蒸馏水反复洗涤至中性,沥干,以去除杂蛋白。用绞碎机将浸泡后的鱿鱼皮绞碎。
1.2.1.2酶解绞碎的鱿鱼皮称重,以1∶4(w/v)比例加入蒸馏水,一步酶解条件:碱性蛋白酶用量0.3%,pH10.0,温度50,时间3 h,酶解完之后煮沸10 min灭酶。二步酶解条件:木瓜蛋白酶用量0.2%,风味蛋白酶0.1%,pH7.5,温度52.5℃,时间3 h,酶解完之后煮沸10 min灭酶[16-18]。
1.2.1.3离心将灭酶后的酶解液以4000 r/min离心10 min,取上清液,即为鱿鱼皮蛋白酶解液。
1.2.2蛋白酶解液的活性炭脱色
1.2.2.1不同活性炭脱色效果的比较将14种不同种类的活性炭(12种粉末状和2种颗粒状)编号,以0.5%(w/v)分别加入150 mL蛋白酶解液中,调pH至4.0,于恒温电热振荡水槽中在45℃,200 r/min振荡60 min,然后以6000 r/min离心15 min,取上清液,测A350和蛋白质含量,计算脱色率和蛋白质损失率。
1.2.2.2单因素分析选取脱色效果最好的8号活性炭,对其脱色条件进行单因素分析。因素包括活性炭用量、pH、脱色温度和脱色时间。
活性炭用量对脱色效果的影响:选取活性炭用量分别为0.2%、0.3%、0.4%、0.5%、0.6%(w/v),将鱿鱼皮蛋白酶解液在pH4、温度45℃条件下,水浴脱色60 min,比较不同活性炭用量的脱色效果。
pH对脱色效果的影响:选取活性炭用量0.4%,将鱿鱼皮蛋白酶解液在不同的pH为3、3.5、4、4.5、5于 45℃条件下,水浴脱色60 min,比较不同pH下活性炭的脱色效果。
脱色温度对脱色效果的影响:选取活性炭用量为0.4%,pH为4,将鱿鱼皮蛋白酶解液分别在35、40、45、50、55℃温度条件下,水浴脱色60 min,比较活性炭在不同脱色温度下的脱色效果。
脱色时间对脱色效果的影响:选取活性炭用量为0.4%,pH为4,温度45℃,将鱿鱼皮蛋白酶解液分别脱色30、40、50、60、70 min,考察不同脱色时间对脱色效果的影响。
1.2.2.3正交实验选取活性炭用量、pH、脱色温度、脱色时间四因素进行正交实验,每个因素三个水平,选择L9(34)正交表进行实验,以脱色率和蛋白质损失率为考察指标,正交实验因素水平表见表1。

表1 正交实验水平表Table 1 Factors and levels of the orthogonal array design
1.2.3脱色率的测定将鱿鱼皮蛋白酶解液稀释后进行了紫外-可见光波长(200~800 nm)扫描,发现在320~380 nm范围内吸光值最高,所以选定350 nm作为判别酶解液色泽变化的测定波长。
脱色率(%)=(脱色前A350-脱色后A350)/脱色前A350×100
1.2.4蛋白质损失率的测定蛋白质总氮含量通过凯氏定氮法(GB/T 5009.5-2003)测定。
蛋白质损失率(%)=(脱色后蛋白含量-脱色前蛋白含量)/脱色前蛋白含量×100
1.2.5数据分析文中数据为3次平行测定值的平均值。采用Origin 7.5绘图,显著性分析采用SPSS 18.0的单因素方差分析(One-Way ANOVA,Turkey)在显著性水平p<0.05下进行数据分析与统计。
2 结果与分析
2.1不同种类活性炭对脱色效果的影响
不同厂家的活性炭对鱿鱼皮蛋白酶解液的脱色效果如表2所示,其中1~12号活性炭为粉末状活性炭,13、14号为颗粒状活性炭。由表2可知,粉末状比颗粒状活性炭脱色效果好,这与宗绪岩等[19]的研究结果一致。原因可能是粉状活性炭颗粒小、脱色吸附比表面积大,所以吸附色素的能力更强[20]。但是活性炭在脱色的同时,蛋白质也会有不同程度的损失,因此在选择活性炭时应综合考虑两种指标。在12种粉末状活性炭中,8号活性炭和1号活性炭的脱色效果最佳,脱色率分别达到84.42%和78.07%,而两者的蛋白质损失率分别为17.16%和16.54%,8号活性炭的脱色率比1号高了8.13%,而蛋白质损失率比1号活性炭仅高出3.75%,说明在同等条件下,8号活性炭的脱色效果更佳。因此,选取8号活性炭作为本实验鱿鱼皮蛋白酶解液的脱色剂,并且对其脱色条件进行优化研究。

表2 不同活性炭对鱿鱼皮蛋白酶解液的脱色效果Table 2 Decoloring effect of different activated carbon for hydrolysis of squid skin protein
2.2活性炭用量对脱色效果的影响
由图1可知,随着活性炭用量的增加,脱色率也随之增加,活性炭用量为0.4%、0.5%、0.6%时脱色率分别达到79.15%、83.49%和85.77%,但是从显著性分析可知,这三种活性炭添加量对脱色效果差异不显著(p>0.05)。而蛋白质损失率随着活性炭用量的增加而增加,在0.4%以后蛋白质损失率显著增加,0.5%和0.6%的活性炭用量下,蛋白质损失率分别达到23.09%和25.20%,而0.4%用量时蛋白质损失率仅为17.00%(p<0.05),可能的原因是较高浓度的活性炭在吸附色素的同时,也吸附了酶解液中部分具有极性的多肽类物质和氨基酸等,而使得蛋白质含量降低[21-22]。从工业和成本的角度综合考虑,选取活性炭用量0.4%较为合适,此时脱色效果较好,且蛋白质损失率也较低。

图1 活性炭用量对脱色率和蛋白质损失率的影响Fig.1 The effect of activated carbon content on decoloring rate and loss ratio of protein
2.3pH对脱色效果的影响
由图2可知,脱色率随pH的上升而下降,说明活性炭在酸性条件下脱色效果较好,这可能是由于氢离子能够改变色素大分子的结构或电荷性质,从而使其易于被活性炭吸附[23]。但是pH过低,蛋白质的损失也较大,pH3和pH3.5蛋白质损失率达到31.0%和27.7%,最终影响产品得率。而当pH为4时,脱色率达到81.2%,同时蛋白质损失率较小,综合考虑蛋白质损失率、脱色率以及pH过低影响后续工艺等因素,确定pH为4。
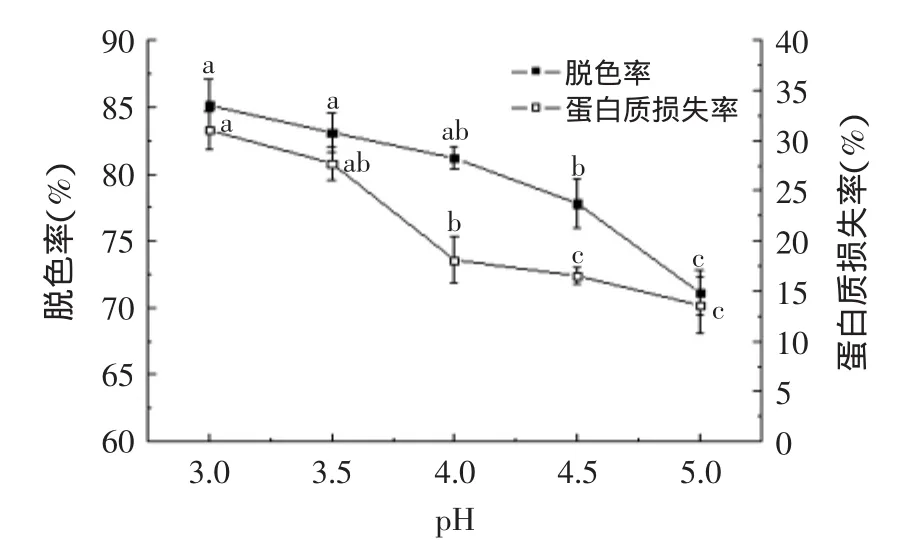
图2 pH对脱色率和蛋白质损失率的影响Fig.2 The effect of pH on decoloring rate and loss ratio of protein
2.4脱色温度对脱色效果的影响
由图3可知,随着脱色温度的升高,脱色率和蛋白质损失率均呈现先上升后趋于平缓的趋势。Sessa等[24]研究表明,活性炭脱色是一个吸热的过程,属于物理吸附,液体粘度会随温度的升高而降低,从而有利于溶液中色素分子的扩散,使其与活性炭颗粒充分接触,提高脱色效果[25]。但是,在温度升高的同时,蛋白质等大分子热运动加剧,活性炭在吸附色素的同时,也会吸附部分蛋白质,造成蛋白质损失率增加。当温度升高到45℃左右时,活性炭的吸附和解吸作用达到动态平衡,蛋白质损失率不再增加,但是当温度继续升高,脱色率增加不明显,原因可能是温度升高活性炭的脱附作用增强[26]。综合考虑温度过高对酶解产物的影响,以及温度升高能耗随之增大,确定脱色温度为45℃。
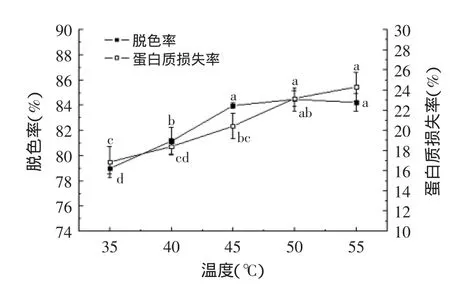
图3 温度对脱色率和蛋白质损失率的影响Fig.3 The effect of temperature on decoloring rate and loss ratio of protein
2.5脱色时间对脱色效果的影响
由图4可知,反应初期,脱色效果随着脱色时间的增加而增加,而脱色时间为60 min后,脱色率变化平缓,说明此时活性炭吸附基本达到饱和状态[27],继续增加脱色时间会降低生产效率,因此,选择脱色时间为60 min。

图4 时间对脱色率和蛋白质损失率的影响Fig.4 The effect of time on decoloring rate and loss ratio of protein
2.6正交实验设计及分析
正交实验结果见表3,由表3可知,比较四个因素的极差,对脱色率影响大小为:活性炭用量>脱色时间>pH>脱色温度,最佳工艺条件为:A3B1C2D2,即活性炭用量为0.5%,pH为3.5,脱色温度为45℃,脱色时间为60 min。对蛋白质损失率影响大小为:活性炭用量>脱色温度>pH>脱色时间,最佳工艺条件为:A1B3C2D2,即活性炭用量为0.3%,pH为4.5,脱色温度为45℃,脱色时间为60 min。

表3 正交实验与结果分析Table 3 Orthogonal experiment and result analysis
由表4和表5可以看出,活性炭用量对脱色效果和蛋白质损失率的影响均达到极显著水平(p<0.05),pH和脱色时间对脱色效果的影响呈显著水平(p<0.1),脱色温度对两个指标均无显著影响(p>0.1)。
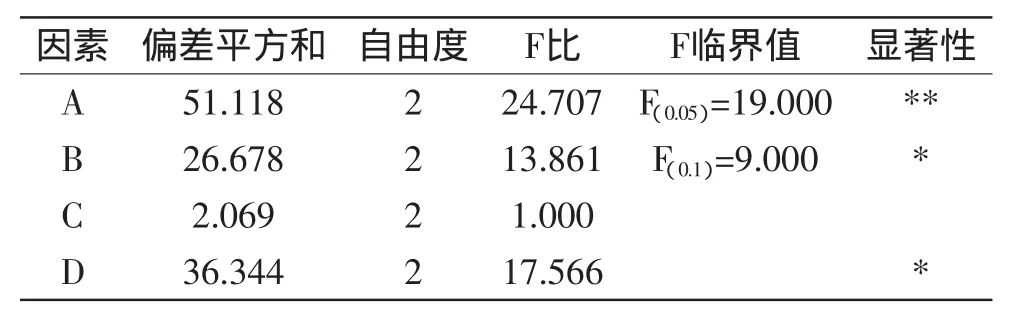
表4 脱色率方差分析Table 4 Variance analysis of decoloring rates
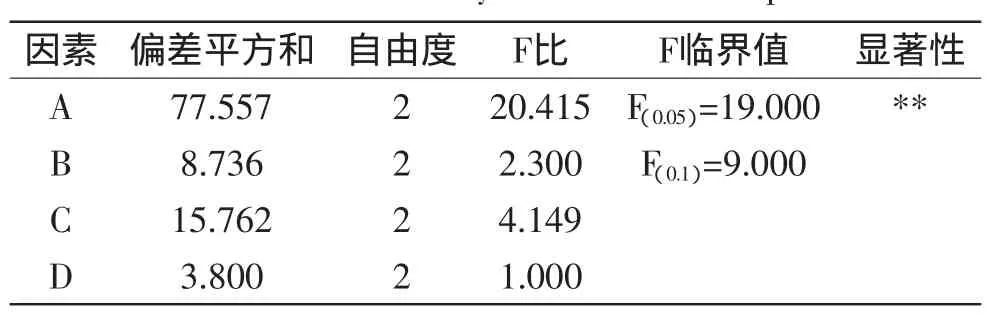
表5 蛋白质损失率方差分析Table 5 Variance analysis of loss ratio of protein
由正交实验结果可知,比较活性炭用量发现,活性炭用量为0.4%时蛋白质损失率最大,所以考虑活性炭用量为0.5%和0.3%,但用量0.5%时的脱色率比用量为0.3%时提高6.57%,同时蛋白质损失率也提高了5.30%,考虑生产成本和蛋白质回收率,选择0.3%作为活性炭用量。酸度增大会提高脱色效果,但是pH过低,在调回中性时会产生大量的盐分,给脱盐工艺带来困难,而反应在pH4.5下的脱色率与pH4.0比较并无差异,但是蛋白质损失率明显比pH4.0低,因此,综合考虑选择pH4.5作为脱色的pH。温度对脱色率与蛋白质损失率的影响均不显著,温度在45℃时脱色率最高且蛋白质损失率最低,并且温度过高会对多肽品质产生不利影响,因此脱色温度选择45℃。脱色时间对脱色率影响显著而对蛋白质损失率无显著影响,按照正交最优工艺条件,选择脱色率最高且蛋白质损失率最低的60 min作为最佳脱色时间。综合分析考虑,最终确定最佳工艺条件为A1B3C2D2,即活性炭用量0.3%,pH4.5,脱色温度45℃,脱色时间60 min。在此条件下进行验证实验,得到酶解液的脱色率达到86.78%,蛋白质的损失率为17.94%。
3 结论
以脱色率和蛋白质损失率为考察指标,对国内14种不同厂家生产的活性炭进行脱色效果的比较,结果发现8号粉末状活性炭脱色效果最佳,且蛋白质损失率较低。并且以此活性炭为脱色剂,在单因素实验的基础之上,进行正交实验。各因素对脱色率影响大小为:活性炭用量>脱色时间>pH>脱色温度;对蛋白质损失率影响大小为:活性炭用量>脱色温度>pH>脱色时间。最终确定最佳工艺条件为:活性炭用量0.3%,pH4.5,脱色温度45℃,脱色时间60 min,此时,脱色率达到86.78%,蛋白质的损失率为17.94%。本实验为鱿鱼皮蛋白酶解液的工业化生产提供了理论依据和实践指导。
[1]秦玉青,刘承初,王慥.鱿鱼皮胶原蛋白的测定与回收[J].上海水产大学学报,2002,11(2):138-144.
[2]俞秋生.介绍秘鲁鱿鱼丝的生产工艺[J].中国水产,2003(12):69-70.
[3]郭恒斌,曾庆祝.酶法提取鱿鱼皮胶原蛋白工艺条件的研究[J].南方水产,2008,4(1):58-63.
[4]刘克海,秦玉青,徐海波,等.鱿鱼皮胶原蛋白的提取及在化妆品中的应用[J].水产科学,2008,27(8):411-413.
[5]王燕,付万冬,吴亮亮,等.鱿鱼皮胶原蛋白提取前处理的条件优化[J].饲料工业,2011,32(7):18-20.
[6]朱芳骞.鲍鱼内脏胶原蛋白多肽的制备及其体外抗氧化活性研究[D].北京:福建农林大学,2012.
[7]Sessa D J,Palmquist D E.Decolorization/deodorization of zein via activated carbons and molecular sieves[J].Industrial Crops and Products,2009,30(1):162-164.
[8]程洪斌,朱宪,朱超.近临界水中鱼蛋白水解及水解液脱色研究[J].化学工业,2007,35(9):70-74.
[9]LOPEZ F,MEDINA F,PRODANOV M,et al.Oxidation of activated carbon:application to vinegar decolorization[J].Journal of Colloid and Interface Science,2003(257):173-178.
[10]吕振磊,王雨生,修方珑.活性炭对紫贻贝蛋白酶解液脱色效果的影响[J].基础研究,2012,28(3):32-35.
[11]周利亘,王君虹,陈新,等.大豆蛋白酶解液脱色工艺的优化[J].浙江农业学报,2002,17(3):130-133.
[12]杨伟,金奇庭.活性炭-超滤膜联用技术的研究与进展[J].市政技术,2007,25(1):34-37.
[13]常瑜,邢金龙,白英彬,等.活性炭脱色性能的研究[J].太原工业大学学报,1995,26(2):95-97.
[14]刘闪,刘培勇,刘良忠,等.鲟鱼皮胶原蛋白肽酶解液脱色工艺的研究[J].食品工业,2013,34(9):120-122.
[15]郭玉华,李钰金,吴新颖.鳕鱼皮胶原蛋白肽酶解液脱色脱腥工艺的研究[J].中国食品添加剂,2010(8):125-128.
[16]任婷婷,董秀萍,朱蓓薇,等.响应面法优化海参胶原蛋白肽的制备条件[J].食品与机械,2010,26(3):120-123.
[17]许丹,杨会成,郑斌,等.具有自由基清除活性的鱿鱼皮胶原蛋白肽酶解工艺研究[J].中国酿造,2012,31(6):79-82.
[18]刘培勇.鲟鱼皮胶原蛋白肽的制备、纯化工艺及理化性质研究[D].武汉:武汉工业大学,2012.
[19]宗绪岩,刘长江,刘玲.啤酒糟蛋白水解液脱色工艺优化研究[J].沈阳农业大学学报,2009,40(5):608-611.
[20]章绍兵,甘晓露,龚琴.花生蛋白酶解液的活性炭脱色工艺研究[J].河南工业大学学报,2011,32(2):10-13.
[21]李鑫,王铁.活性炭对小牛血清去蛋白提取液中多肽的吸附作用[J].辽宁医学院学报,2008,29(4):295-297.
[22]赵谋明,任娇艳,崔春,等.活性炭静态吸附草鱼蛋白水解物中氨基酸特性的研究[J].食品与机械,2005,21(6):13-16.
[23]徐曼,马寒冰,李铮.粉末活性炭脱色豆粕蛋白酶解液的条件优化[J].食品工业科技,2013,34(11):263-266.
[24]Sessa D J,Palmquist D E.Effect of heat on the adsorption capacity of activated carbon for decolorizing/deodorizing yellow zein[J].Bioresource Technology,2008(99):6360-6364.
[25]Li K Wang X H.Adsorptive removal of Pb(Ⅱ)by activated carbon prepared from Spartina alterniflora:Equilibrium,kinetics and thermodynamics[J].Bioresouree Technology,2009(100):2810-2815.
[26]瞿应良,王孝英,刘汉灵.明胶酶解液脱色工艺研究[J].粮油食品科技,2007,15(4):33-35.
[27]章绍兵,甘晓露,龚琴.花生蛋白酶解液的活性炭脱色工艺研究[J].河南工业大学学报,2011,32(2):10-13.
Effect of activated carbon on decolorization of squid skin protein hydrolysate
LIU Zhen-feng1,2,DAI Sheng-jia1,HUANG Xiao-ming1,LV Wei-jin1,CHEN Shi-guo3,YE Xing-qian3,*
(1.Zhejiang Yuxiang Biotech Co.,Ltd.,Hangzhou 310024,China;2.Zhejiang Lansehaiyang Biotech Co.,Ltd.,Zhoushan 316000,China;3.School of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China)
This study aims at optimizing the decolorization conditions for hydrolysis of squid skin protein.14 activated carbons from different companies were selected to decolorize the squid skin protein hydrolysate.The decoloring condition of activated carbon was optimized with orthogonal test on the basis of single factor test,according to the decoloring rate and loss rate of protein.The results showed that active carbon-8 had the best decoloring effect and lower loss rate of protein.The sequences of every factors for decolorization rate were activated carbon content>time>pH>temperature,and for loss rate of protein were activated carbon content>temperature>pH>time.The optimum decoloring conditions were activated carbon 0.3%(w/v),pH4.5,temperature 45℃and time 60 min.The decoloring rate reached 86.78%and the loss rate of protein was 17.94%under the optimal conditions.
activated carbon;squid skin protein hydrolysate;orthogonal test;decolorization
TS209
B
1002-0306(2015)16-0261-05
10.13386/j.issn1002-0306.2015.16.045
2014-09-23
刘振锋(1980-),男,博士,研究方向:海洋生物资源开发与利用,E-mail:zhf00318@zju.edu.cn。
叶兴乾(1962-),男,博士,教授,研究方向:食品科学与工程,E-mail:psu@zju.edu.cn。
杭州市“雏鹰计划”(20131131k132);富阳市科研攻关专项(20140432B72);国家自然科学基金(31301417)。

