复合酶解裂壶藻渣制备抗氧化肽的工艺研究
武 琼,胡 晓,杨贤庆,*,李来好,吴燕燕,郝淑贤,林婉玲,黄 卉,邓建朝
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.农业部水产品加工重点实验室,中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,广东广州510300)
复合酶解裂壶藻渣制备抗氧化肽的工艺研究
武琼1,2,胡晓2,杨贤庆2,*,李来好2,吴燕燕2,郝淑贤2,林婉玲2,黄卉2,邓建朝2
(1.中国海洋大学食品科学与工程学院,山东青岛266003;2.农业部水产品加工重点实验室,中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,广东广州510300)
以提取油脂后的裂壶藻渣为原料采用蛋白酶进行酶解,以水解度、蛋白回收率及产物抗氧化活性为指标,确定最佳复合酶解工艺。结果表明,在pH为7.5,水解温度为50℃,料水比为1∶12(w/w),加酶量为0.5%(E/S,w/w)条件下,采用复合蛋白酶与Alcalase 2.4 L复配方式(1∶1,w/w)酶解裂壶藻渣6 h后的产物水解效果与抗氧化活性均优于其他单酶或复合酶解产物。在此条件下,酶解产物的水解度为11.15%,蛋白回收率为70.82%,羟自由基半抑制浓度IC50为1.656 mg/mL,还原力为1.417(浓度3 mg/mL),具有较好抗氧化活性。
裂壶藻,复合酶解,抗氧化肽,工艺
裂壶藻(S.limacinum),又名裂殖壶菌,是破囊壶菌科一类单细胞球形的海洋真菌类微藻。裂壶藻可以在异养条件下进行发酵培养,可进行大规模工业化生产。由于不易被氧化,使用没有污染水质的危害。裂壶藻中油脂含量丰富,占细胞干重的40%以上,其中多不饱和脂肪酸(PUFA)含量高,DHA的含量可高达50%,还含有丰富的维生素和必需氨基酸等营养成分,裂壶藻及其制品已在水产苗种培育方面引起了广泛关注[1]。此外,随着国内外微藻产DHA藻油的成功商业化生产,其产品已广泛应用在婴幼儿配方奶粉、酸奶、饼干、饮料及高端保健食品等多个方面[2]。裂壶藻作为目前国际公认的最佳DHA生产菌种,我国卫生部已于2007年将其批准作为新资源食品以推广应用。
近年来研究发现,海洋微藻中含有较多的生物活性成分[3-10]。微藻中多肽活性主要表现在抗氧化、抗肿瘤、抗菌及AEC抑制等方面[11-14]。微藻蛋白中蕴含较多活性肽段,可以从中进一步提取功能活性多肽,为实际生产生活提供帮助。裂壶藻经提取多不饱和脂肪酸后所产生的藻渣中蛋白质含量可高达40%以上,然而目前这些藻渣大多被当成饲料或肥料处理,蛋白资源未得到充分开发与利用。本文以工业化提取油脂后的裂壶藻渣为原料,以蛋白回收率、水解度及自由基清除率为指标,先后利用单酶及多酶复合酶解的方法寻找制备裂壶藻抗氧化肽的较优工艺,以期为工业提取藻油后的藻渣废料的高值化利用提供新的思路和方法。
1 材料与方法
1.1材料与仪器
脱脂裂壶藻渣(蛋白含量约40%,水分含量约4%)来源于广东润科生物工程有限公司;Alcalase 2.4 L蛋白酶丹麦诺维信公司;风味蛋白酶、复合蛋白酶、木瓜蛋白酶、胰蛋白酶均购自广州齐云生物技术有限公司;邻二氮菲广州化学试剂厂;甲醛溶液、双氧水、氢氧化钠、浓硫酸、硫酸铜、硫酸钾、甲基红、溴甲酚绿、盐酸、硼酸溶液、乙醇、三氯乙酸、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯化铁、硫酸亚铁、还原型谷胱甘肽以上试剂均购自广州齐云生物技术有限公司,分析纯。
DHG-9145A型电热恒温鼓风干燥箱上海一恒;BS 224S型电子精密天平Sartorius;Delta320精密pH计METTLER TOLEDO;UV2550型紫外可见分光光度计日本岛津;DK-S24型恒温水浴锅上海森信实验仪器厂有限公司;HH-4型数显恒温水浴锅常州澳华仪器有限公司;KjeltecTM2300型蛋白自动分析仪丹麦FOSS。
1.2实验方法
1.2.1酶解工艺流程称取10 g藻渣于适当体积烧杯中,按不同水料比加水,搅拌均匀,调节最适pH,待读数稳定后酶总量按底物质量的0.5%添加,后将烧杯置于水浴锅恒温水解。酶解结束后,将酶解液再置于沸水浴中灭酶处理10 min,之后取出冷却至室温,离心,取上清液量取体积,分装于-20℃冷冻备用。各种蛋白酶分别按照制剂厂家提供的最佳条件进行水解,如表1所示。
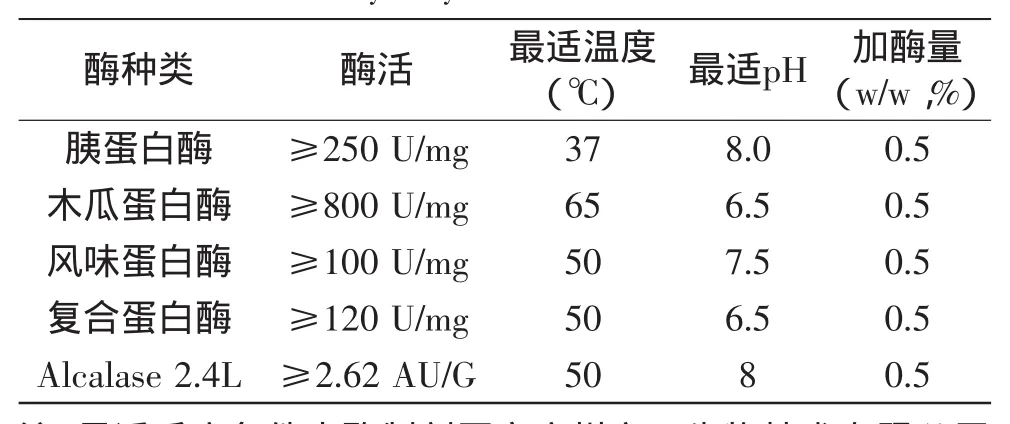
表1 各蛋白酶酶活及水解条件比较Table 1 The comparison of various enzymatic hydrolysis conditions
为减少实验复杂程度,本文首先通过五种不同来源的蛋白酶,在各自最适反应条件下分别酶解原料藻渣6 h,从中选出了3种优质酶类(风味蛋白酶、复合蛋白酶、Alcalase 2.4 L蛋白酶)。将筛选出的三种酶分别进行有关酶解时间(实验点为2、4、6、8 h,实验固定料水比1∶12)、料水比(实验点为1∶6、1∶8、1∶10、1∶12、1∶14,实验固定酶解时间6 h)的因素优化实验,最后再将优化后的酶解工艺用以进行复配酶解并与单酶酶解效果进行比较,以确定原料最佳的复配酶解方案。复配过程中,由于3种优质酶具有相同的最适反应温度及相似的最适pH,故不需进行更复杂深入的条件优化,可直接采用50℃及pH7.5进行反应。实验全程均以水解度、蛋白回收率及酶解物抗氧化活性作为指标,判断反应程度及产物活性。每组实验均设置两组平行,计算偏差标注误差线。
复配酶解(多种酶同时加入),酶总量按底物质量的0.5%添加,两两复配(1∶1,w/w)与三酶复配(1∶1∶1)的水解效果进行比较分析。
1.2.2水解度测定方法采用甲醛电位滴定法[15]测量酶解液中游离氨基态氮的含量。
水解度(DH)(%)=(酶解液游离氨基氮含量/原料总氮含量)×100
1.2.3蛋白回收率测定方法采用半微量凯氏定氮法[16]分别测定酶解液中总氮含量及原料中总氮含量。
蛋白回收率(P)(%)=(酶解液中总氮含量/原料总氮含量)×100
1.2.4羟自由基清除能力测定参照Jin等[17]的测定方法并加以修改。损伤管:取0.3 mL 5 mmol/L邻二氮菲乙醇溶液加入0.2 mL 0.15 mol/L磷酸盐缓冲液(pH7.4)和1 mL去离子水,混匀后加入0.3 mL 0.75 mmol/L FeSO4溶液,混匀再加入0.2 mL 0.1%(V/V)H2O2,37℃水浴60 min,10000 r/min离心10 min后于536 nm测吸光值Aj。样品管:取0.3 mL 5 mmol/L邻二氮菲乙醇溶液加入0.2 mL 0.15 mol/L磷酸盐缓冲液(pH7.4),以1 mL样品溶液代替去离子水,混匀后加入0.3 mL 0.75 mmol/L FeSO4溶液,混匀再加入0.2 mL 0.1%(V/V)H2O2,37℃水浴60 min,10000 r/min离心10 min后于536 nm测吸光值Ai。空白管:取0.3 mL 5 mmol/L邻二氮菲乙醇溶液加入0.2 mL 0.15 mol/L磷酸盐缓冲液(pH7.4)和1 mL去离子水,混匀后加入0.3 mL 0.75 mmol/L FeSO4溶液,再加入0.2 mL去离子水代替H2O2混匀,同样至于37℃水浴60 min,10000 r/min离心10 min后于536 nm测吸光值为A0。每组实验做两组平行对照。
清除率计算公式如下:清除率(%)=(Ai-Aj)/(A0-Aj)×100
对样品溶液分别做梯度稀释,测定各自不同浓度下的羟自由基清除率,经线性回归后计算出自由基清除率为50%时的样品酶解液蛋白浓度,即IC50。
1.2.5还原力测定参照Ahmadi等[18]的测定方法并加以修改。取待测样液1 mL,加入质量分数1%的铁氰化钾溶液1 mL,0.2 mol/L磷酸缓冲液(pH6.6)1 mL,混匀后于50℃水浴保温20 min,再加入质量分数10%三氯乙酸(TCA)1 mL,振荡混匀后离心(10000 r/mim,10 min)。取上清液1 mL,加入1 mL去离子水和0.2 mL质量分数0.1%的FeCl3溶液,振荡混匀后置于50℃保温10 min,体系变为蓝色,再于700 nm下测量吸光值。
2 结果与分析
2.1五种不同蛋白酶水解条件及效果比较分析
各酶均按各自生产说明的最适反应条件以相同料水比水解6 h,其水解效果及产物活性如表2所示。
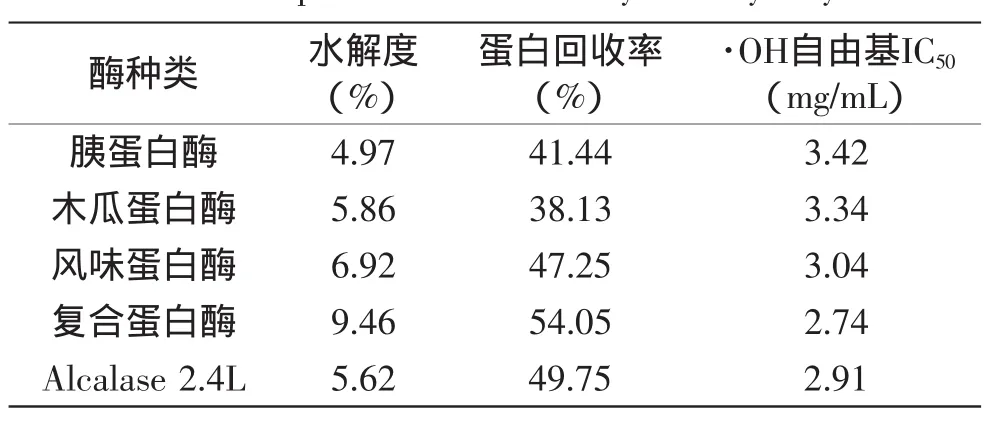
表2 各蛋白酶酶水解效果比较Table 2 The comparison of various enzymatic hydrolysis effect
由表2可知,裂壶藻渣在经过五种不同蛋白酶水解相同时间后,水解度具有一定差异,但都普遍较低。其中胰蛋白酶酶解液水解度为4.97%,水解效果最好的复合蛋白酶为9.46%。水解度的差异是由于不同酶的酶切位点不同,而多酶的水解度均普遍偏低,推测其原因可能与原料在水中溶解性质不佳有关,以致较难被蛋白酶水解。五种酶解液的蛋白回收率差异比较明显,最高可达54.05%,最低为38.13%。实验结果表明,水解相同时间后,五种酶解液中复合蛋白酶的酶解液抗氧化活性最高,羟自由基的半抑制浓度(IC50)为2.74 mg/mL,相对较差的胰蛋白酶酶解液半抑制浓度为3.42 mg/mL。
综合来看,采用5种不同蛋白酶酶解裂壶藻,其酶解液的水解度、蛋白回收率和抗氧化活性均有一定差异。但其中复合蛋白酶的水解效果最好,水解度与蛋白回收率均最高,抗氧化活性也最强;其次,风味蛋白酶和Alcalase 2.4 L蛋白酶的酶解液也具有较高的蛋白回收率和水解度,以及较好的抗氧化活性。因此,从5种蛋白酶中选择复合蛋白酶、风味蛋白酶和Alcalase 2.4 L蛋白酶继续进行后续工艺研究。
2.2不同酶解时间水解效果比较分析
由图1可以看出,随着酶解时间的增长,风味蛋白酶和Alcalase 2.4 L蛋白酶酶解液的水解度变化不大,复合蛋白酶酶解液水解度有所增加,但增长幅度不大,推测原因可能与样品溶解性质有关。由图2可知,酶解液的蛋白回收率随时间变化明显,呈现先增长后降低的趋势。但综合两图来看,不论水解时间多长,复合蛋白酶酶解液的水解度与蛋白回收率均高于另外两种。
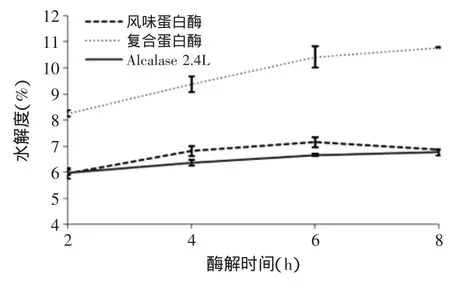
图1 不同酶解时间对水解度的影响Fig.1 Effect of time on hydrolysis degree
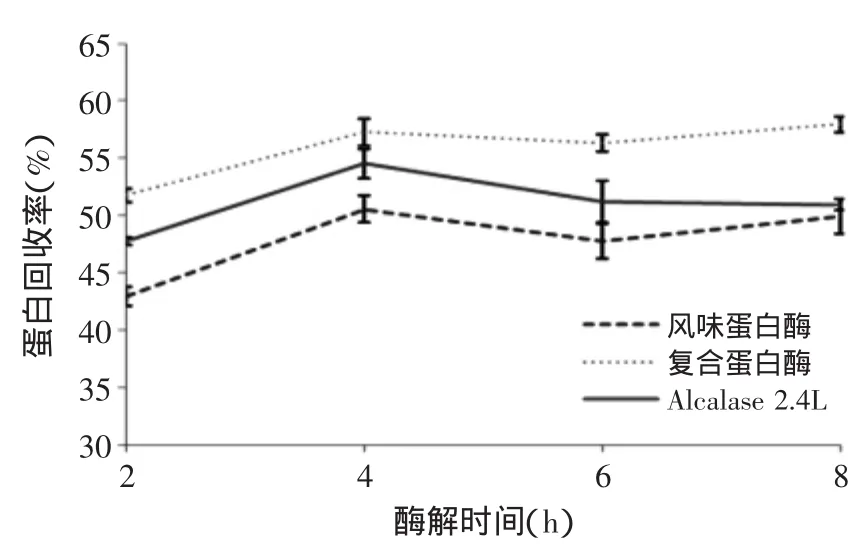
图2 不同酶解时间对蛋白回收率的影响Fig.2 Effect of time on protein recovery
由图3可知,不同酶解时间对裂壶藻酶解液的羟自由基清除能力实际影响不大,三种酶解液的半抑制浓度IC50均维持在3 mg/mL左右。其中,复合蛋白酶与风味蛋白酶酶解液的抗氧化活性基本呈现先升高后降低的趋势。陈美珍等[19]研究大豆分离蛋白的清除羟自由基活性时,发现当酶解大于某个时间长度后,所得酶解物的清除活性会呈现不同程度的下降趋势。这与本实验所得结果基本相符。复合蛋白酶和风味蛋白酶酶解液在酶解6 h时,抗氧化活性最强。
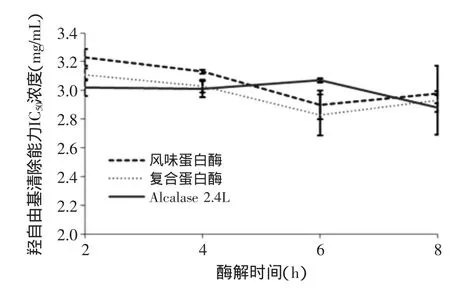
图3 不同酶解时间对羟自由基半抑制浓度IC50的影响Fig.3 Effect of time on scavenging·OH Radical IC50
综合分析可知,酶解时间对裂壶藻酶解液的水解度和蛋白回收率略有影响,主要表现在前6 h之内,6 h后增长幅度变慢或与之前基本持平;酶解时间对羟自由基清除率无显著性影响。综合考虑生产成本与能源耗费等诸多因素,可选择6 h作为较优酶解时间,此时复合蛋白酶的酶解液均具有较好水解度(10.42%)、蛋白回收率(56.3%)与较高抗氧化活性(·OH半抑制浓度IC50=2.83 mg/mL)。
2.3不同料水比水解效果比较分析
由图4、图5可知,随着加水量逐渐增多,样品酶解液的水解度和蛋白回收率均明显提高,酶种类不同其增长幅度有所差异。就水解度一个指标而言,不论酶解时间和料水比怎样变化,复合蛋白酶酶解液的酶解效果均优于另外两种单酶,分析原因应该与其酶切位点较多有关。而不论哪一种蛋白酶,当料水比提高到1∶12之后,其酶解液的水解度和蛋白回收率增长速度均明显减缓甚至保持不变,这可能与加水量增加也在一定程度上稀释了蛋白酶的浓度和样品浓度有关。
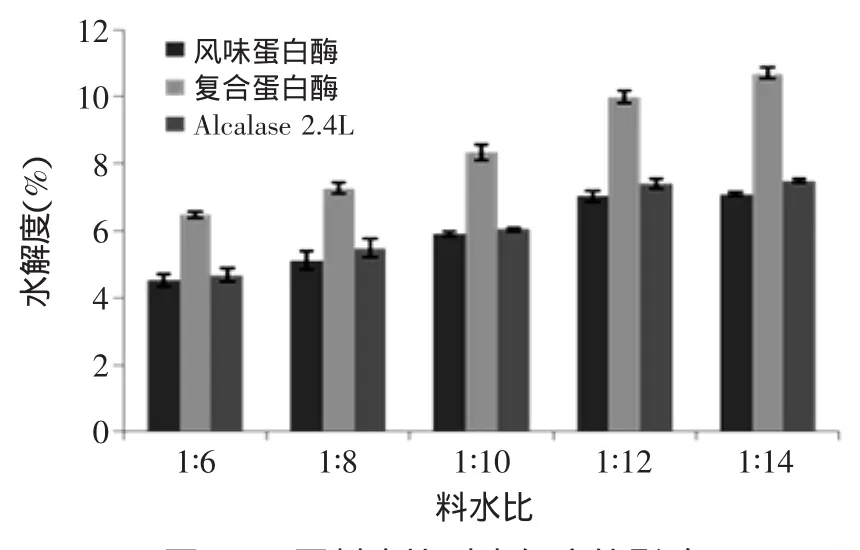
图4 不同料水比对水解度的影响Fig.4 Effect of the ratio of water on hydrolysis degree
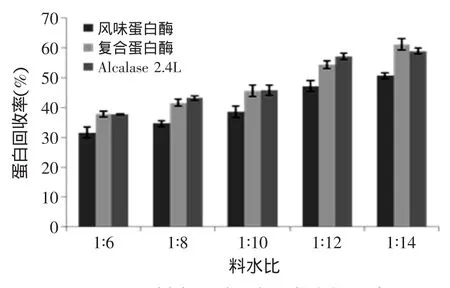
图5 不同料水比对蛋白回收率的影响Fig.5 Effect of the ratio of water on protein recovery

图6 不同料水比对羟自由基半抑制浓度IC50的影响Fig.6 Effect of the ratio of water on scavenging·OH radical IC50
从图6可以看出,三种酶解液的羟自由基清除能力随样品加水量的增多均有所变化,尤以复合蛋白酶酶解液的活性变化表现明显。当料水比为1∶10和1∶12时,三种酶的酶解液具有较强的抗氧化活性。在加水量较少时,由于整个反应体系中水量偏低,不利于蛋白质分子的溶解和充分伸展,使得用于酶解的反应位点较少,影响了抗氧化活性肽的生成量或种类[20]。而当加入的水过量时,酶的有效质量浓度也降低,结果导致反应速度变慢,蛋白降解产物中抗氧化肽生成量减少,影响酶解液的抗氧化活性。这与王艳梅等[21]以黄缘盒龟肉为原料酶解获取抗氧化肽的实验中,料液比对羟自由基清除率的影响效果相符。
综合来看,当料水比为1∶12时,酶解液的水解度和蛋白回收率均较高,且再增多加水量也不再有明显提高,此时酶解液具有较强的抗氧化活性,可以确定1∶12料水比作为最优工艺。
2.4复合酶解的水解效果比较分析
2.4.1单酶与复合酶解裂壶藻酶解液的水解度和蛋白回收率比较从图7和图8可以看出,复合酶解的水解效果对比单酶酶解有了一定提高。当两两进行复配酶解时,复合蛋白酶和Alcalase蛋白酶以1∶1比例混合作用的酶解效果均强于另外两种复配方式,水解度和蛋白回收率均最高,分别达到11.15%和70.82%,而以三种酶共同复配的酶解效果略低于复合蛋白酶+Alcalase的复配方式,也分别达到9.95%和64.62%。但是不论任何一种复配方式,其酶解效果均优于利用单酶直接酶解的方式。因为不同的蛋白酶具有不同的底物专一性,多酶复合共同酶解可以弥补单一酶解的不足。
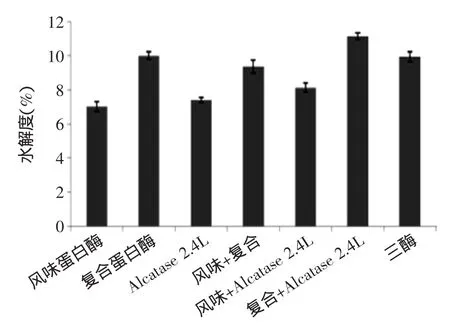
图7 单酶与复合酶解水解度比较Fig.7 The comparison of hydrolysis degree between single and composite enzymatic hydrolysis

图8 单酶与复合酶解蛋白回收率比较Fig.8 The comparison of protein recovery between single and composite enzymatic hydrolysis
2.4.2三酶复合酶解裂壶藻酶解液的抗氧化活性由图9、图10分析可知,通过酶的复合作用,裂壶藻酶解液的抗氧化活性比单酶酶解高。图9中,羟自由基的半抑制浓度IC50最低可达到1.656 mg/mL,比复配之前酶解液的自由基清除能力增强很多。但与还原型谷胱甘肽GSH(羟自由基半抑制浓度IC50为0.6 mg/mL)进行比较,抗氧化能力较低。对几种复配方式进行比较,可知复合蛋白酶与Alcalase 2.4 L蛋白酶共同酶解的酶解液羟自由基清除能力最强。
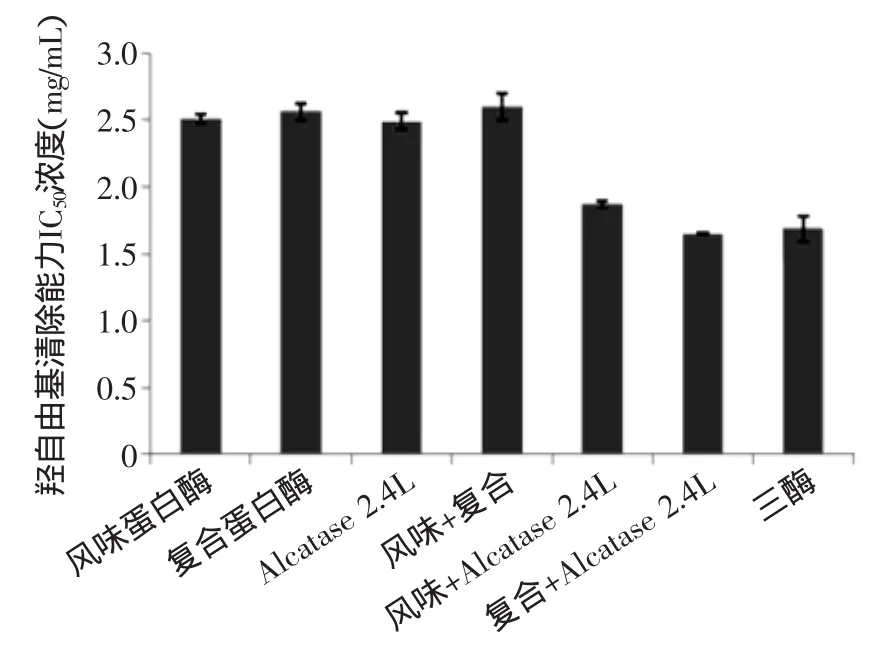
图9 单酶与复合酶解羟自由基半抑制浓度IC50的比较Fig.9 The comparison of scavenging·OH Radical IC50between single and composite enzymatic hydrolysis
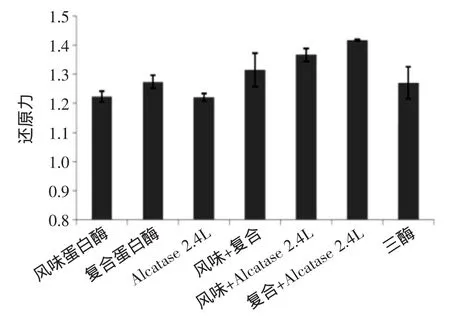
图10 单酶与复合酶解还原力比较(浓度3 mg/mL)Fig.10 The comparison of reductive activity between single and composite enzymatic hydrolysis
为了验证实验可靠性,本文又测量了各复配酶解液的还原力大小。根据各酶解液的总氮含量,将其均稀释到3 mg/mL蛋白浓度测量反应吸光值,结果如图10所示。从图10中可以看出,几种复配方式中,虽然读数差距不大,但依然是复合蛋白酶+Alcalase 2.4 L蛋白酶的复合酶解方式所获产物具有最高还原力,吸光值为1.417与0.5 mg/mL浓度的谷胱甘肽还原力相似。且各复合酶解产物均比单酶酶解产物还原力有明显提高,进一步验证了酶解液抗氧化活性的强弱情况。
综上所述,所采用的复配方式中最优方案是复合蛋白酶+Alcalase 2.4 L蛋白酶(1∶1,w/w)的复配方式,此时酶解产物具有较高的水解度、蛋白回收率和抗氧化活性。
3 结论
通过比较五种不同来源的蛋白酶对裂壶藻渣的酶解效果,探讨酶制剂种类、酶解时间和料水比三种因素对样品水解效果及酶解液抗氧化活性的影响,筛选出水解效果较好的酶种类,优化出最佳酶解时间为6 h,最佳样品料水比为1∶12。在此条件下,继续探讨三种较优酶的两两复配(1∶1)及三酶复配(1∶1∶1)所导致酶解效果和酶解液抗氧化活性的变化。
结果表明,复合酶解效果均显著优于单酶的酶解效果。其中以复合蛋白酶+Alcalase 2.4 L蛋白酶的复配方式对样品进行复合酶解,可获得最高水解度11.15%,最高蛋白回收率70.82%和最强抗氧化活性,其中羟自由基半抑制浓度IC50=1.656 mg/mL,还原力为1.417(酶解产物浓度为3 mg/mL)。由此可见,以工业化提取油脂后的裂壶藻渣为原料,利用酶解法提取抗氧化肽的工艺具有一定可行性,并且产物具有较高的抗氧化活性,为工业提取藻油后的藻渣废料再利用提供了新的思路和利用方法。
[1]陈家鑫.裂壶藻及其制品在水产苗种培育中的应用[J].科学养鱼,2002(6):53.
[2]常桂芳,王兴国.通过商品化DHA藻油的脂肪酸组成推测其微藻属名[J].中国油脂,2011,36(6):45-49.
[3]Kusaikin M I,Ermakova S P,Shevchenko N M,et al.Structural characteristics and antitumor activity of a new chrysolaminaran from the diatom alga Synedraacus[J].Chemistry of Natural Compounds,2010,46(1):1-4.
[4]周妍,王凌,孙利芹,等.5种海洋微藻多糖体外免疫调节活性的筛选[J].海洋通报,2010,29(2):194-198.
[5]韦英益,胡庭俊,苏子杰,等.马尾藻多糖对猪脾细胞免疫活性及其抗病毒活性的影响[J].南京农业大学学报,2012,35(2):120-124.
[6]Yim J H,Son E,Pyo S,et al.Novel sulfated polysaccharide derived from red-tide microalga Gyrodiniumimpudicum strain KG03withimmunostimulatingactivityinvivo[J].Marine Biotechnology,2005,7(4):331-338.
[7]Guzman S,Gato A,Lamela M,et al.Anti-inflammatory and immunomodulatory activities of polysaccharide from Chlorella stigmatophora and Phaeodactylumtricornutum[J].Phytotherapy Research,2003,17(6):665-670.
[8]Arad S M,Levy-Ontman O.Red microalgal cell-wall polysaccharides:biotechnological aspects[J].Current Opinion in Biotechnology,2010,21(3):358-364.
[9]汪少芸,江勇,孟春,等.海洋微藻裂壶藻发酵液胞外多糖的制备及活性研究[J].福州大学学报:自然科学版,2012,39(5):786-791.
[10]曹欢,王培培,吴建东,等.裂壶藻(Schizochytrium limacinum)多糖的提取分离及其结构特性[J].中国海洋药物,2012,30(6):1-5.
[11]Sheih I,Wu T K,Fang T J.Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate indifferent oxidation systems[J].Bioresource Technology,2009,100(13):3419-3425.
[12]欧赟,乔燕燕,王维有,等.螺旋藻抗氧化肽的制备及其体外活性研究[J].食品与生物技术学报,2014,33(1):22-26.
[13]陈丽红,孙利芹,王长海.微藻抗菌物质及筛选模型[J].中国生物工程杂志,2011,31(9):109-116.
[14]张博超,张学武.螺旋藻抗肿瘤肽的分离及壳聚糖纳米粒子复合物的制备[D].广州:华南理工大学,2012.
[15]朱俭.生物化学实验[M].上海:上海科学技术出版社,1987:100-159.
[16]张意静.食品分析技术[M].北京:中国轻工业出版社,2001:186-194.
[17]Jin M,Cai Y X,Li J R,et al.1,10-Phenanthroline-Fe2+Oxidative Assay of Hydroxyl Radical Produced by H2O2/Fe2+[J]. Progress in Biochemistry and Biophysics,1996.
[18]Ahmadi F,Kadivar M,Shahedi M.Antioxidant activity of Kelussia odoratissima Mozaff in model and food systems[J].Food Chemistry,2007,105(1):57-64.
[19]陈美珍,余杰.大豆分离蛋白酶解物清除羟自由基作用的研究[J].食品科学,2002,23(1):43-47.
[20]宋茹,冯婷立,谢超.海产小杂鱼抗氧化肽制备工艺[J].食品科学,2011,32(12):29-33.
[21]王艳梅,万全,赖年悦,等.黄缘盒龟肉的酶解工艺优化及其体外抗氧化活性研究[J].水产学报,2013,37(4):622-630.
表6 未知米糠粕的预测结果Table 6 Predicted results of unknown rice bran meal
参考文献
[1]韩素云,刘磊,张名位,等.米糠整体加工利用研究进展[J].广东农业科学,2014(12):89-94.
[2]Chiou T Y,Ogino A,Kobayashi T,et al.Characteristics and antioxidative ability of defatted rice bran extracts obtained using several extractants under subcritical conditions[J].J Oleo Sci,2013,62:1-8.
[3]Mendel F.Rice Brans,Rice Bran Oils,and Rice Hulls:Composition,Food and Industrial Uses,and Bioactivities in Humans,Animals,and Cells[J].Journal of Agricultural and Food Chemistry,2013,61:10626-10641.
[4]曹秀娟,熊犍,印铁,等.稻谷加工副产物的营养及功能成分分析[J].粮油食品科技,2014,22(1):58-62.
[5]Ferreira D S,Pallone J A L,Poppi R J.Direct analysis of the main chemical constituents in Chenopodium quinoa grain using Fourier transform near-infrared spectroscopy[J].Food Control,2015,48:91-95.
[6]Shao Y N,Cen Y L,He Y,et al.Infrared spectroscopy and chemometrics for the starch and protein prediction of irradiated rice[J].Food Chemistry,2011,126:1856-1861.
[7]魏良明,严衍禄,戴景瑞.近红外反射光谱测定玉米完整籽粒蛋白质和淀粉含量的研究[J].中国农业科学,2004,37(5):630-633.
[8]Khandaker Z H,Khaleduzzaman A B M.Nutritional evaluation of Jambo forage using near infrared reflectance spectroscopy and comparison with wet chemistry analysis[J].Bang J Anim Sci,2011,40(1-2):46-50.
[9]刘建学.实用近红外光谱分析技术[M].北京:科学出版社,2007:131-134.
[10]张德虎,田海清,武士钥,等.河套蜜瓜糖度和坚实度可见近红外光谱检测研究[J].中国农机化学报,2014,35(3):197-201.
[11]李娟.稻谷新陈度近红外快速无损检测的研究[D].长沙:中南林业科技大学,2012.
[12]许禄,邵学广.化学计量学方法[M].北京:科学出版社,2004:279-316.
[13]曹冬梅,张东杰,鹿保鑫,等.BP人工神经网络在稻米储藏质量评估中的应用[J].中国粮油学报,2014,29(4):108-112.
[14]王欣,叶华俊,黎庆涛.近红外光谱结合人工神经网络分析蔗汁的锤度和旋光度[J].光谱学与光谱分析,2010,30(7):1759-1762.
Study on the preparation of antioxidant peptides from Schizochytrium limacinum by composite enzymatic hydrolysis
WU Qiong1,2,HU Xiao2,YANG Xian-qing2,*,LI Lai-hao2,WU Yan-yan2,HAO Shu-xian2,LIN Wan-ling2,HUANG Hui2,DENG Jian-chao2
(1.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China;2.Key Laboratory of Aquatic Product Processing,Ministry of Agriculture,National R&D Center for Aquatic Product Processing,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China)
In this paper,Schizochytrium limacinum after oil extraction was hydrolyzed while the degree of hydrolysis,protein recovery and product antioxidant activity were as index to determine the best complex enzymatic processes.The results showed that the optimum conditions were as follows:pH7.5,temperature 50℃,ratio of material to water 1∶12,time 4 h,Protamex and Alcalase 2.4 L complex method,total amount of enzyme dosage 0.5%(E/S,w/w,1∶1),which was significantly better than the effect of single enzymatic hydrolysis.In this condition,the hydrolysates had the degree of hydrolysis of 11.15%,protein recovery 70.82%.In addition,IC50of hydroxyl radicals was 1.656 mg/mL and reducing power was 1.417.
Schizochytrium limacinum;composite enzymatic hydrolysis;antioxidant peptides;process
TS201.1
A
1002-0306(2015)16-0167-06
10.13386/j.issn1002-0306.2015.16.026
2014-09-26
武琼(1992-),女,硕士研究生,研究方向:食品加工与功能食品,E-mail:wu123qiong@126.com。
杨贤庆(1963-),男,大学本科,研究员,研究方向:水产品加工与质量安全,E-mail:yxqgd@163.com。
国家现代农业产业技术体系(CARS-49);“十二五”国家科技支撑计划项目(2012BAD28B06);国家农业科技成果转化资金项目(2010GB23260577,2010GB2E000335);广东省科技计划重点项目(2011A020102005);广东省海洋渔业科技与产业发展专项(微藻功能性蛋白肽的研究与产品开发);国家自然科学基金青年科学基金项目(21205138,31301454)。

