重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度寻常性银屑病的多中心临床研究
李诚让 杨雪源 顾军 郝飞 郑敏 郭在培 郑青山
·论著·
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度寻常性银屑病的多中心临床研究
李诚让 杨雪源 顾军 郝飞 郑敏 郭在培 郑青山
目的 评价用于重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度寻常性银屑病的安全性和疗效。方法 采用多中心、随机、双盲、阳性药物平行对照的临床研究。两组中重度寻常性银屑病患者均接受重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗,试验组用药商品名为安佰诺,对照组为益赛普。在治疗前(W0)、治疗第2周、第6周及治疗后(疗程12周)分别对各观察指标进行评估记录。结果 5个研究中心共入组病例180例,完成试验174例,采用SAS统计软件包,按分层分段方法产生随机数,其中试验组88例,对照组86例。疗后12周,全分析集(FAS)分析显示,试验组和对照组银屑病皮损面积和严重程度指数(PASI)50、PASI75 的患者分别是 75.6%(68/90)、51.1%(46/90)和 82.2%(74/90)、50.0%(45/90),两组差异无统计学意义(均P>0.05);试验组PASI90达30.0%(27/90),高于对照组的16.7%(15/90),差异有统计学意义(χ2=4.472,P<0.05)。与药物有关的不良反应包括转氨酶升高、白细胞减少、上呼吸道感染、注射部位反应、尿常规异常、结核菌素纯蛋白衍化物试验异常等,两组不良反应发生率差异无统计学意义(χ2=0.188,P>0.05)。不良反应一般程度较轻,未经处理或经相应治疗均能恢复正常。结论 国产重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度寻常性银屑病12周安全有效。
银屑病;生物制剂;随机对照试验;治疗结果;药物毒性;重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白
肿瘤坏死因子α(TNF-α)在银屑病发病机制中的作用明确,国内外[1-3]已有重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗银屑病关节炎及难治性银屑病的报道,其疗效显著,起效快,安全性好。为了评价国产重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(安佰诺)治疗中重度银屑病的疗效和安全性,经国家食品药品监督管理局批准(药物临床试验批件号:2010L00799)和中国医学科学院皮肤病医院伦理委员会批准(批件号:2011临审第013号),2012年2-12月对180例中重度银屑病患者进行了多中心、随机双盲、阳性药物对照的多中心平行临床试验。
对象与方法
一、病例选择
1.入选标准:门诊患者年龄18~65岁,男女不限;中重度稳定期斑块状银屑病,确诊时间至少为6个月以上;皮损面积占体表总面积10%以上,银屑病皮损面积和严重程度指数(PASI)评分 ≥ 10;体重40~85 kg;受试者自愿参加此项研究并遵守研究规定,自愿签署书面知情同意书。
2.排除标准:红皮病性、关节病性、滴状或脓疱性银屑病;乙型肝炎病毒表面抗原、丙型肝炎病毒抗体阳性;HIV抗体阳性;梅毒螺旋体明胶凝集试验(TPPA)阳性;结核菌素纯蛋白衍化物(PPD)试验阳性(>5 mm);3个月内发生过严重的难以控制的局部或全身急、慢性感染;既往有活动性结核或病史;有其他活动性皮肤疾病,影响病情评价;3个月内接受过系统的高效价或大剂量糖皮质激素、维A酸类药物、生物制剂(如人源化单克隆抗体)及免疫抑制剂等治疗;2周内曾接受过维生素D类、煤焦油等外用治疗,光疗;对研究药物过敏,有对研究有影响的其他严重过敏史;肝、肾功能实验室指标异常者,即ALT或AST高于正常值上限1.5倍,尿素氮、肌酐超出各中心正常值上限;静脉血白细胞计数 <4×109/L;有严重心、肝、肺、肾等重要脏器病变及内分泌系统疾病;既往有恶性肿瘤病史或现症患者,有其他免疫性疾病如红斑狼疮及家族史者;孕妇、哺乳期妇女、育龄期妇女尿妊娠试验阳性,近期有生育愿望者;因其他情况研究者认为不宜参加本研究者。
二、试验药物与治疗方法
1.试验用药:试验药和对照药均是国产注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,试验药商品名为安佰诺(浙江海正药业股份有限公司生产,国药准字S20150005),对照药为益赛普(上海中信国健药业有限公司生产,国药准字S20050058),均由浙江海正药业股份有限公司免费提供。两种受试药物均为白色冻干粉针剂,12.5 mg/支。
2.方法及疗程:临床试验开始之前,所有药物将按照随机肓法的要求进行分装,试验药和对照药的规格、外包装完全一致。各研究中心的药物按随机号分发记录。试验药和对照药的剂量、用药方法和疗程均完全相同。
给药方案:采用SAS统计软件包,按分层分段方法产生随机数,将患者分为试验组和对照组,两组均每周2次皮下注射试验药物,每次2支共计25 mg,连续12周。新注射部位距原注射部位至少1 cm,有压痛、擦伤、肌肉紧绷、外伤处及皮肤红肿处不应注射。两侧皮下(大腿、腹部或上肢)轮换注射。患者需每周来院使用药物及接受相应的检查。试验期间不得使用其他外用药或口服药,如确因其他疾病需合并用药时,应在病例报告表中如实记录。
三、疗效观察和评估[3-6]
1.观察方法:研究者在治疗前(W0)、治疗第2、6周(W2、W6)及治疗结束后(W12)分别对患者进行随访,评价临床症状与体征。分别记录皮损瘙痒程度、靶皮损面积变化以及靶皮损浸润苔藓样变、丘疹、鳞屑/结痂,各项症状以0~3级评分。
2.疗效评估:①主要疗效评价指标:PASI,比较治疗结束后两组达到PASI50、PASI75、PASI90患者的比例;②次要疗效评价指标:皮肤病生活质量指数(DLQI)、医师整体评分(PGA)、视觉模拟评分(VAS)、患者生活状况的综合评价(SF-36)。PGA分5 级[5]评估疗效,0 为痊愈,1 为几乎痊愈,2 为轻度,3为中度,4为重度。
3.安全性评价:详细记录各种不良事件和不良反应病例,严重程度按照轻、中、重度进行评价,同时按肯定有关、很可能有关、可能有关、可能无关及肯定无关进行药物的相关性因果分析;记录对不良事件采取的措施及转归。
4.研究数据的统计分析:采用SAS 9.2软件分析。除非劣效检验外,一般统计检验均采用双侧检验,P≤0.05被认为差异有统计学意义。PASI应答率采用χ2检验或Fisher精确概率法比较组间差异,并计算组间差异单侧95%的可信区间,根据δ=20%的非劣标准进行非劣效检验。DLQI、PGA、VAS、SF-36的实测值、变化值历时性变化,采用t检验比较组间差异。PGA达到“痊愈”和“几乎痊愈”的比例采用卡方检验或Fisher确切概率法比较组间差异。主要采用描述性统计分析评定药物的安全性,发生率较高(>10%)的不良事件和不良反应的比较采用Fisher确切概率法,发生率较低的不良事件和不良反应仅用描述性统计。
结 果
一、一般资料
本研究5家中心共筛选254例,实际入组180例,试验组和对照组各90例。研究中因失访和不符合入组条件而脱落和剔除的病例共6例,其中试验组中因用药依从性差、超过访视时间窗1例、不符合入组条件(肝功能异常)1例;对照组中因用药依从性差、超过访视时间窗1例,失访1例,因ALT持续升高和妊娠各退出1例。两组性别、年龄、病期及疗前症状体征积分等差异均无统计学意义(均P>0.05),具备可比性。
二、疗效评估
全分析集(FAS)分析中,达 PASI50、PASI75、PASI90的患者随着疗程延长而增加(表1),用药后各随访期达PASI50、PASI75的患者比例两组间差异均无统计学意义。用药后2、6周时达PASI90的患者比例两组间差异均无统计学意义,疗程结束后试验组高于对照组(P<0.05)。
治疗12周,试验组和对照组DLQI总评分、VAS评分和SF-36总评分的改善值差异均无统计学意义(P>0.05)。治疗12周后试验组PGA几乎痊愈率(FAS)为 41.6%(37/89),对照组为 26.4%(23/87),两者差异有统计学意义(χ2=0.034,P < 0.05)。
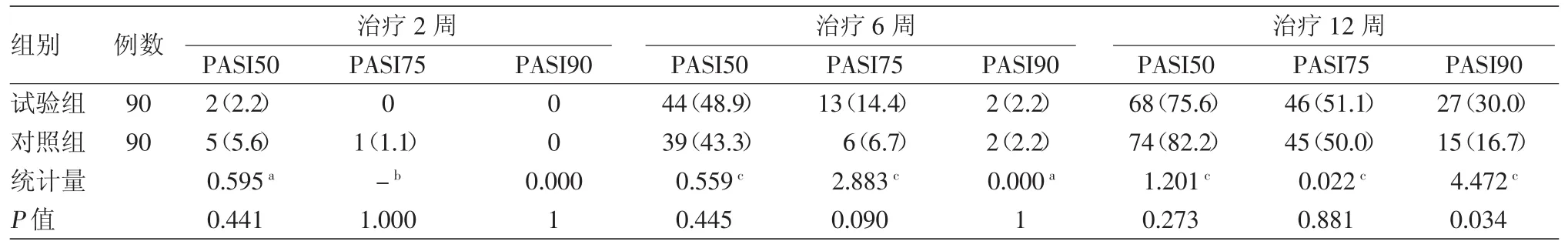
表1 重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度寻常性银屑病不同时间银屑病皮损面积和严重程度指数(PASI)50、PASI75、PASI90的患者比例全分析集)[例(%)]
三、安全性评估
试验过程中试验组有32例(35.6%)发生不良事件,其中15例(16.7%)为不良反应;对照组有25例(27.8%)发生不良事件,其中9例(10.0%)为不良反应,不良事件发生率两组差异无统计学意义(χ2=0.188,P>0.05)。两组不良反应程度较轻,未经处理或经相应治疗均能恢复正常。
与药物有关或可能有关的不良反应有:上呼吸道感染,试验组有1例,对照组3例。对照组1例2次头痛、心慌不良。试验组2例3次注射部位反应不良事件,对照组有1例。白细胞减少试验组有2例,对照组有1例。转氨酶升高试验组有5例,对照组有2例。PPD试验异常试验组2例,对照组2例;另外试验组还出现3例尿常规异常,1例血糖异常升高。试验过程中对照组有1例意外妊娠,与药物无关。尚有数例胃肠道反应、骨骼关节痛、皮肤系统相关不良事件,研究者判断与药物无关。
讨 论
目前,银屑病被认为是一种由遗传和环境因素相互作用所引起的主要由T淋巴细胞介导的自身免疫性疾病[7]。TNF-α是T细胞分泌的多种细胞因子之一,作为重要的早期炎症细胞因子,能够诱导角质形成细胞产生细胞间黏附分子(ICAM)-1、CD40及主要组织相容性抗原(MHC)类分子,激活JNK和核因子KB(NF-KB)信号通路,促进T淋巴细胞与角质形成细胞之间的相互作用,从而引起角质形成细胞内角质蛋白表达模式的改变,导致角质形成细胞增殖、角化不全、表皮突延长、颗粒层消失、炎症浸润及微血管形成[8-9]。基于对这种免疫机制的了解,人们研发了一系列针对TNF-α多种靶向性生物制剂[10]。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是由TNF-α受体P75胞外段二聚体和IgG1抗体Fc段组成的全人源性可溶性受体,可与TNF-α三聚体以1∶1的比例结合,使之丧失生物学活性,从而达到控制炎症、阻断病情进展的作用。1998年美国食品药品监督管理局(FDA)批准重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白用于治疗关节病性银屑病,后于2004年5月批准治疗中重度斑块状寻常性银屑病[11]。
本临床试验采用两种国产重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度斑块状寻常性银屑病。从疗效上看,两组均可从治疗第2周起迅速改善患者的病情,观察结束时,两组达PASI50、PASI75的比例差异无统计学意义,试验组达PASI90的比例显著高于对照组。
国外应用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(每周2次,每次25 mg,12周)治疗银屑病达 PASI75的比例为 30%~49%[12-15],本文中试验组和对照组分别为51.1%和50.0%,略高于国外,这可能与国内较少采取免疫抑制剂治疗、参与药物试验的患者对系统治疗的敏感性高以及国内患者体重较轻有关[16]。
安全性方面,试验组不良反应发生率为16.7%,对照组为10.0%,除1例出现严重不良事件(意外妊娠,与药物无关),两组不良反应多为轻度,大多未经治疗即自行恢复。荟萃分析显示,发生严重心血管意外或肿瘤的概率较低,与采用传统治疗的患者差异无统计学意义[17-18]。
国产重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度寻常性银屑病安全有效。尽管如此,短期临床试验不能发现罕见的远期不良反应,应对银屑病生物治疗的安全性进行持续监测。
[1] Maneiro JR,Salgado E,Gomez-Reino JJ.Immunogenicity of monoclonal antibodies against tumor necrosis factor used in chronic immune-mediated inflammatory conditions:systematic review and meta-analysis[J].JAMA Intern Med,2013,173(15):1416-1428.
[2]黄琼,杨勤萍,方栩,等.重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗寻常性银屑病多中心、随机、双盲试验[J].中华皮肤科杂志,2007,40(11):655-658.
[3]杨毅,王斯璐,张明慧,等.依那西普治疗银屑病的疗效[J].中华皮肤科杂志,2013,46(3):187-188.
[4] Feldman SR,Krueger GG.Psoriasis assessment tools in clinical trials[J].Ann Rheum Dis,2005,64 Suppl 2:ii65-73.
[5] van de Kerkhof PC,Kragballe K,Austad J,et al.Psoriasis:severity assessment in clinical practice.Conclusions from workshop discussions and a prospective multicentre survey of psoriasis severity[J].Eur J Dermatol,2006,16(2):167-171.
[6] Robinson A,Kardos M,Kimball AB.Physician Global Assessment(PGA)and Psoriasis Area and Severity Index (PASI):why do both?A systematic analysis of randomized controlled trials of biologic agents for moderate to severe plaque psoriasis[J].J Am Acad Dermatol,2012,66(3):369-375.
[7] Cai Y,Fleming C,Yan J.New insights of T cells in the pathogenesis of psoriasis [J].Cell Mol Immunol,2012,9(4):302-309.
[8] Haase I,Hobbs RM,Romero MR,et al.A role for mitogenactivated protein kinase activation by integrins in the pathogenesis of psoriasis[J].J Clin Invest,2001,108(4):527-536.
[9] Goldenstein-Schainberg C,Favarato MH,Ranza R.Current and relevant concepts in psoriatic arthritis[J].Rev Bras Reumatol,2012,52(1):98-106.
[10] Gottlieb AB,Bos JD.Recombinantly engineered human proteins:transforming the treatment of psoriasis[J].Clin Immunol,2002,105(2):105-116.
[11] Rich SJ,Bello-Quintero CE.Advancements in the treatment of psoriasis:role of biologic agents[J].J Manag Care Pharm,2004,10(4):318-325.
[12] Kim IH,West CE,Kwatra SG,et al.Comparative efficacy of biologics in psoriasis:a review[J].Am J Clin Dermatol,2012,13(6):365-374.
[13] Papp KA,Tyring S,Lahfa M,et al.A global phase III randomized controlled trial of etanercept in psoriasis:safety,efficacy,and effect of dose reduction[J].Br J Dermatol,2005,152(6):1304-1312.
[14] Gottlieb AB,Matheson RT,Lowe N,et al.A randomized trial of etanercept as monotherapy for psoriasis[J].Arch Dermatol,2003,139(12):1627-1632.
[15] Leonardi CL,Powers JL,Matheson RT,et al.Etanercept as monotherapy in patients with psoriasis[J].N Engl J Med,2003,349(21):2014-2022.
[16] Clark L,Lebwohl M.The effect of weight on the efficacy of biologic therapy in patients with psoriasis [J].J Am Acad Dermatol,2008,58(3):443-446.
[17] Ryan C,Leonardi CL,Krueger JG,et al.Association between biologic therapies for chronic plaque psoriasis and cardiovascular events:a meta-analysis of randomized controlled trials[J].JAMA,2011,306(8):864-871.
[18] Smith CH,Anstey AV,Barker JN,et al.British Association of Dermatologists′guidelines for biologic interventions for psoriasis 2009[J].Br J Dermatol,2009,161(5):987-1019.
皮肤科原料药等供应消息
西安大唐医药销售有限公司化工原料部常年供应皮肤性病科药用辅料、各种性病病原体检测试剂盒,最新医用图书、包装材料等,品种齐全,价格低廉。为了回馈新老客户对本公司的支持与关怀,定期举办制剂技术专业培训,常年免费技术咨询。顾伟程教授主编的《精编皮肤病学》一书,介绍我国常见皮肤病千余种,为适应临床医师需要详尽收录相关治疗方法,32开本携带方便,每册定价90元。欢迎来电、来函。电话:029-86265583,13991328466,地址:西安市北关正街33号,邮编710014,联系人:李永靖、罗广林,Email:lglzsj@163.com,QQ:406576437,778069730。
Recombinant human tumor necrosis factor receptor typeⅡ-IgG Fc fusion protein for the treatment of moderate to severe psoriasis vulgaris:a multicenter,randomized,parallel-group,controlled clinical trial
Li Chengrang*,Yang Xueyuan,Gu Jun,Hao Fei,Zheng Min,Guo Zaipei,Zheng Qingshan.*Hospital of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
ObjectiveTo evaluate the safety and efficacy of a domestic recombinant human tumor necrosis factor receptor typeⅡ-IgG Fc fusion protein (rhTNFR-Fc)for the treatment of moderate to severe psoriasis vulgaris.MethodsA multicenter,randomized,double blind,parallel-group,positive drug-controlled clinical trial was conducted.According to random numbers generated by a hierarchical segmentation method using the SAS 9.2 software,patients with moderate to severe psoriasis vulgaris were randomly divided into two groups to be injected with two kinds of domestic rhTNFR-Fc under the trade names of Anbainuo(test group)and Yisaipu(control group)respectively at a dose of 25 mg twice a week for 12 consecutive weeks.The primary endpoint was the proportion of patients achieving a 50%,75%and 90%reduction in psoriasis area and severity index(PASI50,PASI75 and PASI90)at week 2,6 and 12 after initiation of the treatment.Adverse reactions were also recorded.Statistical analysis was carried out by using the chi-square test,Fisher′s exact test,two-samplet-test,and noninferiority trials with the software SAS 9.2.ResultsA total of 180 patients were enrolled in this study from 5 centers,and 174 completed this trial,of whom,88 were assigned to the test group and 86 to the control group.Analysis of the full analysis set (FAS)revealed no significant differences in PASI50(75.6%(68/90)vs.82.2%(74/90),P > 0.05)or PASI75(51.1%(46/90)vs.50.0%(45/90),P > 0.05)between the test group and control group,but a significant increase in PASI90 in the test group compared with the control group (30.0% (27/90)vs.16.7% (15/90),χ2=4.472,P<0.05)at week 12.Drug-related adverse reactions included elevation of transaminases,leukopenia,upper respiratory infections,injection-site reactions,abnormalities in urine routine test and purified protein derivative(PPD)skin test results,etc.There was no significant difference between the two groups in the incidence rate of adverse reactions(χ2=0.188,P > 0.05),most of which were mild,and subsided spontaneously or after appropriate treatment.Conclusion The domestic rhTNFR-Fc(trade name:Anbainuo)25 mg twice a week for 12 weeks is effective and safe for the treatment of moderate to severe psoriasisvulgaris.
Psoriasis;Biological agents;Randomized controlled trials;Treatment outcome;Drug toxicity;Recombinant human tumor necrosis factor receptor typeⅡ-antibody fusion protein
Yang Xueyuan,Email:yangxueyuan@medmail.com.cn
作者单位:210042南京,中国医学科学院北京协和医学院皮肤病医院(李诚让、杨雪源);上海长海医院皮肤科(顾军);第三军医大学第一附属医院皮肤科(郝飞);浙江大学医学院附属第二医院皮肤科(郑敏);四川大学华西医院皮肤科(郭在培);上海中医药大学药物临床研究中心(郑青山)
10.3760/cma.j.issn.0412-4030.2015.08.007
杨雪源,Email:yangxueyuan@medmail.com.cn
2015-05-30)
(本文编辑:尚淑贤)

