建鲤和荷包红鲤肌肉脂肪、脂肪酸组成以及Apo-C-I转录水平的比较
朱双宁 朱辰娴 俞菊华, 李红霞 唐永凯 李建林于 凡 刘骏恂
(1. 南京农业大学无锡渔业学院, 无锡 214081;2. 中国水产科学研究院淡水渔业研究中心农业部淡水鱼类遗传育种重点实验室, 无锡 214081)
鱼类是人类 n-3高不饱和脂肪酸(High unsaturated fatty acids, HUFA)的动物源, 研究表明n-3HUFA中DHA和EPA在预防人类心血管疾病、脑神经发育等方面有着重要作用[1], 因此, 鱼类肌肉中 n-3PUFAs含量以及n-6/n-3PUFA的比值, 为评价鱼类营养价值的重要指标。联合国粮食农业组织(FAO)对于脂肪酸 n-6/n-3营养素推荐量比值为(5—10)︰1, 而在当今的饮食条件下, 人们对n-6PUFAs的摄入通常是过量的, n-3PUFAs相对不足。尽管海水鱼类具有丰富的 n-3PUFAs, 随着海洋捕捞渔业的停滞发展, 需要养殖鱼类来填补人类对n-3 HUFA日益增加的需求, 改良和培育n-3HUFA含量高、n-3/n-6PUFA比值合理的新型养殖品种已经受到重视。另一方面, 肌内脂肪 (Intramuscular fat, IMF)可增加肉质的柔嫩感并且是肉质香味的重要前提, 沉积在肌肉内的脂肪是肉类特征性香味的来源[2,3]。所以, 研究鱼类肌肉中FA组成、含量以及代谢相关的分子机制, 将为进一步筛选相关分子标记、选育有利于人类健康的养殖品种提供理论依据和实验基础。
载脂蛋白(apolipoprotein, Apo)主要由肝脏和肠合成并结合在脂质上, 在保持脂蛋白结构稳定性、调节酶的活性以及在循环系统中对脂质的转运、摄取过程扮演重要角色[4]。载脂蛋白CI (Apolipoprotein CI, Apo-C-I)是目前所发现的载脂蛋白家族中分子量最小的成员, 仅为 6.6 kD,主要分布于乳糜微粒(CM)、极低密度脂蛋白(VLDL)、高密度脂蛋白(HDL)的表面。有研究报道, Apo-C-I作用于脂质表面, 通过激活卵磷脂胆固醇酰基转移酶(Lecithincholesterol acyltransferase, LCAT)[5,6], 并抑制脂蛋白酯酶(Lipoprotein lipase, LPL)[7]及其他脂肪代谢酶的活性参与调节血浆脂蛋白代谢; 此外, Apo-C-I还可抑制肝脏胆固醇受体对富含甘油三酯脂蛋白的摄取, 使富含甘油三脂的脂蛋白延时清除[5,8]。可见, Apo-C-I在脂类代谢方面有着重要的调控作用。与哺乳动物不同, 鱼类利用糖类的能力很低, 主要以脂类作为能量来源, 因此脂质代谢和脂蛋白生理机能对于鱼类内环境稳定非常重要。目前鱼类Apo-C-I基因的研究不是很多, 已在GenBank中登录有斑马鱼(Danio rerio, XR_045030.4)、朝鲜(Hemibarbus mylodon, FJ170109.1)、稀有鲫(Gobiocypris rarus)[9]、斜带石斑鱼(Epinephelus coioides)[10]等。研究发现,Apo-C-I在斜带石斑鱼胚胎期和仔鱼早期的卵黄膜上高表达, 表明该基因在卵黄降解和卵黄营养转运方面有重要作用[10]; Nynca等[11]发现Apo-C-I是虹鳟(Rainbow trout)精液的重要成分, 并认为其与精子包膜的防护性有关。王春玲等[9]在稀有鲫的肝脏、脾脏、肌肉、肠等主要组织均检测到了Apo-C-I的表达, 并认为该基因可作为Cd 污染的分子指标。可见Apo-C-I有多种生理作用, 但鱼类中Apo-C-I与IMF、脂肪酸组成的关系还没见报道。
鲤(Cyprinus carpio)分布广, 产量高, 遗传多样性丰富, 仅我国就有 10多个地理种群, 经过地理种群间杂交培育的具有新特征的鲤品种也比较多。建鲤(Cyprinus carpio var. jian)是人工培育的体型长、生长快的养殖良种[12],而荷包红鲤(Cyprinus carpio var. wuyuanensis)则是在江西原有地理种群基础上, 经过多代选育, 具有肉质细嫩、红色体表、型如荷包的优质种群, 这两种鲤形态、肉质差异较大。由于鱼类的肌肉脂肪含量和脂肪酸组成与人类饮食营养密切相关, 所以筛选了影响这两个指标的基因, 阐明相关的分子机制, 将为选育相关性状的优良养殖品种奠定基础。由于对相同养殖品种肉质差异个体的选择难度较大, 因此选择养殖在同一池塘的建鲤和荷包红鲤进行比较分析。该研究结果再一次验证了鲤基因组中存在 2个重复基因[13], 首次报道了两鲤品种肌肉脂肪含量和脂肪酸组成方面存在明显差异, 最后, 通过比较 Apo-C-1s在两品种鲤的组织表达差异, 表明 Apo-C-1s对肌肉脂肪含量有影响, 可作为筛选相关分子标记的目标片段。本实验结果也可为研究其他动物的 Apo-C-1对脂肪代谢的影响及筛选肌肉脂肪相关分子标记提供借鉴。
1 材料与方法
1.1 实验鱼
实验用的建鲤和荷包红鲤繁殖于2012年4月, 饲养于中国水产科学研究院淡水渔业研究中心宜兴养殖基地,同池塘混养。于2013年3月27日取建鲤35尾, 平均体重(400.09±85.65) g; 荷包红鲤 26尾, 平均体重(361.8±68.3) g。
1.2 样品采集
使用丁香油麻醉实验鱼后, 从尾静脉采血, 取去除鳞片和表皮的背部肌肉(头后部、背鳍前、侧线上区域的白肌)(20—50) g, 用锡箔包好放入–20℃冰箱, 用于水分和粗脂肪测定, 另保存部分肌肉和肝脏入液氮中预冷,然后放入–80℃冰箱, 用于RNA抽提。并取6尾鲤的心脏、脑、肾脏、前肠、性腺等组织, 编号并放入液氮中冷冻后,转藏于–80℃冰箱中保存备用。
1.3 肌肉粗脂肪和脂肪酸的测定
将肌肉绞碎至肉糜状, 称重后置于预先洗净烘干称重的玻璃皿中, 置于烘箱中75℃烘20h, 然后, 105℃继续烘 3h后, 移入干燥器冷却并再次称重, 计算肌肉水分含量, 用研磨粉碎机(德国, IKA A11型)研磨肌肉至粉末状。105℃再次烘干3h后, 取干重为1 g左右的肌肉粉末进行粗脂肪含量测定, 仪器为 ANKOM XT15i型全自动脂肪分析仪, 操作步骤按照脂肪抽提仪推荐方法进行。
脂肪酸由江南大学食品科学技术国家重点实验室测定, 分析采用气相色谱-质谱方法, 条件如下: 分析仪器:GC-2010;Shimadzu, Kyoto, Japan; 色谱柱: VF-23ms,Varian, USA, 毛细柱, 规格: 30 m×0.25 mm×0.25 μm; 色谱条件: 氢火焰离子化检测器(FID)氢气流45 mL/min, 空气流量 500 mL/min, 氮气为载气, 其流量为 60 mL/min,尾吹45 mL/min。采取程序120 ℃ 3min, 10 ℃ /min 升温到190℃, 然后 2℃/min升温到 220℃, 保持 15min; 检测器和进样孔的温度为 250℃, 脂肪酸标样由 SIGMA公司提供。脂肪酸的百分含量计算采用面积归一化法。
1.4 RNA和DNA抽提
RNA抽提使用E.Z.N.A.TMHP Total RNA Kit (OMEGA)并按照其推荐方法进行, RNA使用紫外分光光度计(Eppendorf)测定浓度, A260/280介于1.9—2.0, 稀释RNA浓度为1 μg/μL于–80℃保存备用; DNA抽提使用酚-氯仿法,A260/2801.8左右。
1.5 CcApo-C-Is基因的克隆
使用NCBI网站中的Nucleotide数据库检索已有的斑马鱼 Apo-C-I (XR_045030.4), 在鲤肝脏转录组中筛选到斑马鱼 Apo-C-I同源序列, 根据此序列设计分离全长cDNA的引物ApoCI-TF和ApoCI-TR, 考虑到鲤染色体数是鲤科模式鱼类斑马鱼的 2倍, 通过挑选多个克隆并测序, 结果分离到两种 cDNA。根据已分离到的序列, 参照斑马鱼 Apo-C-I基因设计引物, 分段分离两 CcApo-C-Is的DNA序列, 并进行拼接。实验所用引物由上海铂尚生物技术有限公司合成, 具体信息见表1。
以2 μg肝脏总RNA为模板, 使用逆转录酶M-MLV(大连, TaKaRa), PolyT为引物, 在总体积为20 μL的体系进行RT反应, 合成cDNA第一链, 然后以2 μL RT液为模板, 进行聚合酶链式反应(PCR)扩增, PCR反应液依据Taq酶(天根生化科技有限公司)说明书要求, ApoC I-TF和ApoC I-TR为引物扩增CcApo-C-Is。PCR反应程序为94℃预变性2min; 94℃变性30s, (55—65)℃退火40s, 72℃延伸1min, 30个循环; 72℃延伸8min, 4℃保存, 其中退火温度根据引物Tm值确定, 延伸时间根据扩增片段大小确定。鲤ApoC-Is DNA序列分别使用引物对ApoC Ia -E1F/E3R、ApoC Ia -E2F/E4R以及ApoC I-TF /ApoC Ib -E2R、ApoC Ib-E2F/ ApoC I-TR获得, 建鲤和荷包红鲤基因组DNA模板100 μg, 反应液和反应条件如上。PCR扩增产物经1%的琼脂糖凝胶电泳检测、分离后, 切取所需条带, 用凝胶回收试剂盒(上海申能博彩生物有限公司)回收DNA。回收产物与pMD18-T载体(大连, TaKaRa)连接, 转化到大肠杆菌(E. coli) DH5α敏感态细胞中并在LB Amp+平板筛选阳性克隆, 抽提质粒, EcoRⅠ、HindⅢ双酶切检测后, 阳性克隆送至上海铂尚生物公司测序。

表1 分离CcApo-C-Is基因所使用的引物Tab. 1 Primers used in isolation of CcApo-C-Is gene
1.6 序列分析
使用 DNA star软件查找开放阅读框(ORF)并翻译成氨基酸序列, 运用 SignalP4.0 (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽位置, 用Clustal W方法与其他动物Apo-C-I氨基酸序列进行比较, 并用Mega5.0构建NJ系统进化树。
1.7 半定量RT-PCR检测CcApo-C-Is的表达水平
由于两CcApo-C-Is cDNA序列一致性很高, 推测功能差异不是很大, 此外特异定量引物的设计也有难度, 本实验设计了共用引物, 其中正向引物ApoCIs-DF设计在外显子1, 反向引物ApoCIs-DR设计在外显子2、3的交界处, 以排除DNA的干扰, 使用荧光定量PCR, 分析鲤CcApo-C-Is基因在肝脏和肌肉组织的表达。肝脏、肌肉样品来自肌肉脂肪酸C18:1含量低于20%的12个建鲤个体, 高于20%的12个荷包红鲤个体。以0.5 μg总RNA为模板, 根据M-MLV(大连, TaKaRa)进行RT反应。定量PCR反应体系为20 μL, 其中cDNA 2 μL, 引物各0.8 μL (10 μmol/L), 根据SYBR®Pemix Ex TaqTMⅡ(大连, TaKaRa)使用说明, 在TaKaRa TP800型实时荧光定量PCR仪上进行定量RT-PCR实验。反应程序:95℃预变性30s; 95℃变性5s, 60℃复性20s, 35个循环, 最后溶解曲线检测确定产物的特异性。参照Winner等方法[14],用2–DDCt法计算CcApo-C-Is基因的转录水平, 内标基因为EF-1 (elongation factor1)。
1.8 统计分析
建鲤和荷包红鲤肌肉脂肪含量、脂肪酸含量、荧光定量结果差异性比较采用SPSS 18.0中的独立样本T检验分析(Independent-samples T test), 差异显著水平为(P<0.05),差异极显著水平为(P<0.01), 数据采用平均值±标准误差(Mean±SEM)表示。
2 结果
2.1 建鲤和荷包红鲤肌肉含水量、粗脂肪及脂肪酸组成
同池混养的 1龄建鲤和荷包红鲤, 建鲤体重[(400.09±85.65) g]显著高于荷包红鲤[(355.75±63.97) g](P<0.05)。背部肌肉脂肪、水分含量测定结果显示, 建鲤肌肉粗脂肪显著低于荷包红鲤(P<0.01), 水分高于荷包红鲤(P<0.05)(表 2)。脂肪酸组成测定结果显示, 有19种脂肪酸(表2), 其中, 饱和脂肪酸(SFA)5种, 以棕榈酸(C16:0)和硬脂酸(C18:0)为主; 不饱和脂肪酸(UFA)13种, 单不饱和脂肪酸(MUFA)含量最多的为油酸(C18:1), 多不饱和脂肪酸(PUFA)主要为亚油酸(C18:2n-6)、花生四烯酸(C20:4n-6)、二十碳五烯酸(C20:5n-3,EPA)、二十二碳四烯酸(C22:4n-3)、二十二碳六烯酸(C22:6n-3, DHA)。
建鲤肌肉∑SFA占总脂肪酸的 26.99%, 高于荷包红鲤(25.62%)(P<0.01), ∑MUFA(19.97%)低于荷包红鲤(28.20%)(P<0.01), 而∑PUFA 恰恰相反, 建鲤(48.94%)显著高于荷包红鲤(43.38%)(P<0.01)。高不饱和脂肪酸(HUFA)中, 建鲤的DHA和EPA总量(13.16%)显著高于荷包红鲤(8.26%)(P<0.01), 建鲤、荷包红鲤的∑n-3PUFA/∑n-6PUFA比值分别为0.50、0.35, 差异显著(P<0.01)。
2.2 油酸(C18:1)与IMF含量及DHA(C22:6n-3)的关系
将建鲤、荷包红鲤所有测定样品中C18:1含量分别与IMF、DHA做散点图及线性回归分析, 结果显示 IMF与油酸(C18:1)呈正相关(R2=0.60), 回归关系显著(P<0.01) (图1A); DHA与C18:1呈负相关关系(R2=0.73), 回归关系同样显著(P<0.01) (图1B)。图中建鲤、荷包红鲤区分明显, 建鲤肌肉C18:1和脂肪含量低, DHA含量较高; 相反, 荷包红鲤肌肉C18:1和脂肪含量较高, DHA含量较低。
2.3 CcApo-C-Is序列分析及系统进化
建鲤、荷包红鲤中均获得两种CcApo-C-Is基因序列,长度分别为 1636、1576 bp, 记作CcApo-C-Ia(GenBank登录号: KJ011130)和 CcApo-C-Ib (GenBank登录号:KJ011131), 序列分析表明, 这两个基因与斑马鱼一样,由3个内含子和4个外显子组成,翻译起始密码子(ATG)位于外显子2, 终止密码子(TAA)位于外显子4; 两基因内含子序列和长度有较大差异, 阅读框(ORF)长度一致, 均为 255 bp, 一致性 90%, 编码氨基酸 84个,相似性为90%。CcApo-C-Is与斑马鱼Apo-C-I cDNA (XR_045030.4)相似性均在 80%左右, 氨基酸相似性分别为 86%、89%,建鲤和荷包红鲤序列一致。经分析, CcApo-C-Is中, 前20个氨基酸为信号肽, 后 64个氨基酸构成成熟肽, 分子量为7.6 kD, 理论等电点(PI)分别为4.61、5.08, 两种蛋白属不稳定型蛋白质且亲水性差。
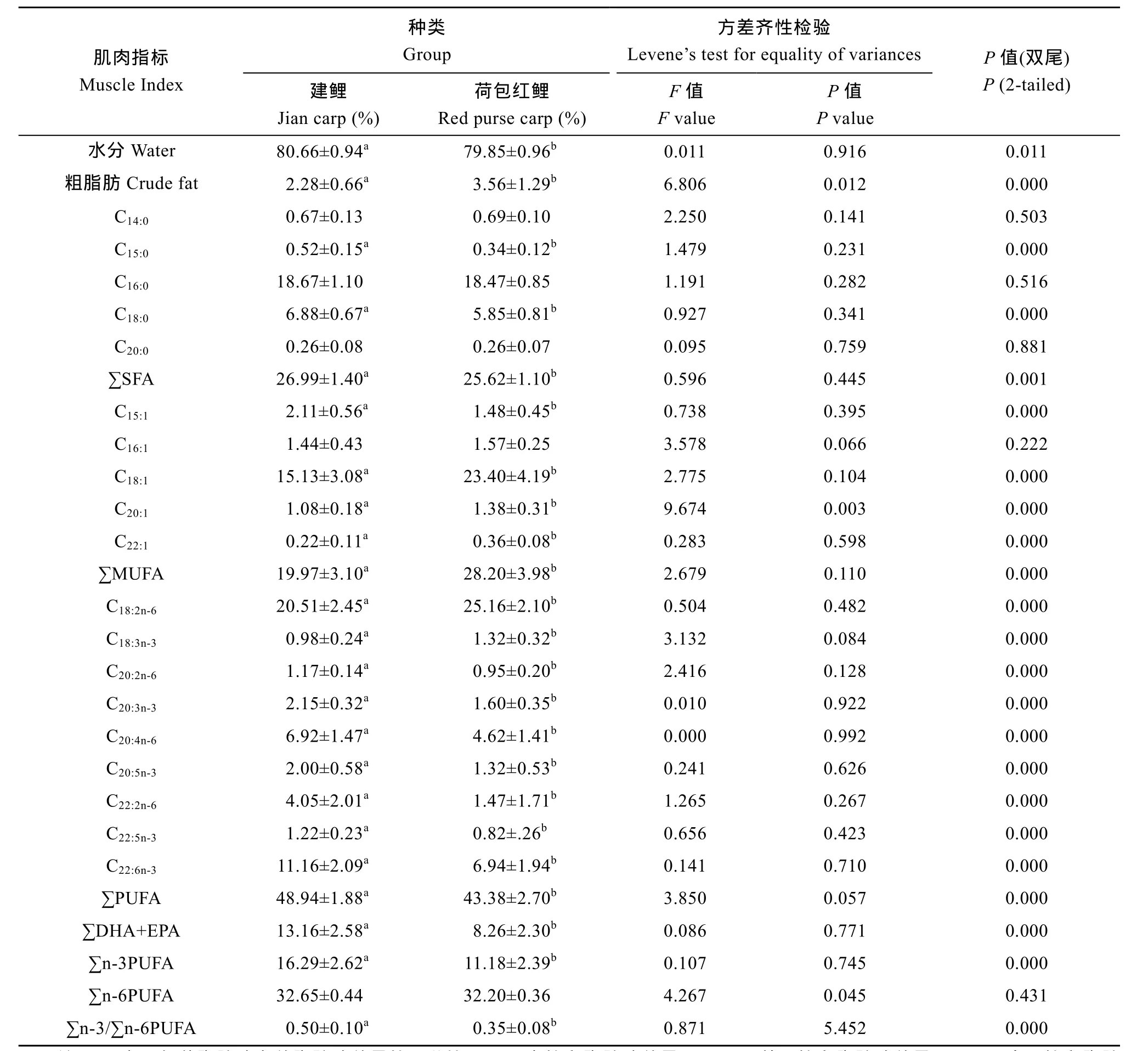
表2 建鲤、荷包红鲤肌肉水分、粗脂肪含量及脂肪酸组成(平均值±标准误)Tab. 2 Contents of water, crude fat and fatty acid profiles in muscle of jian carp and red purse carp (Mean±SE)
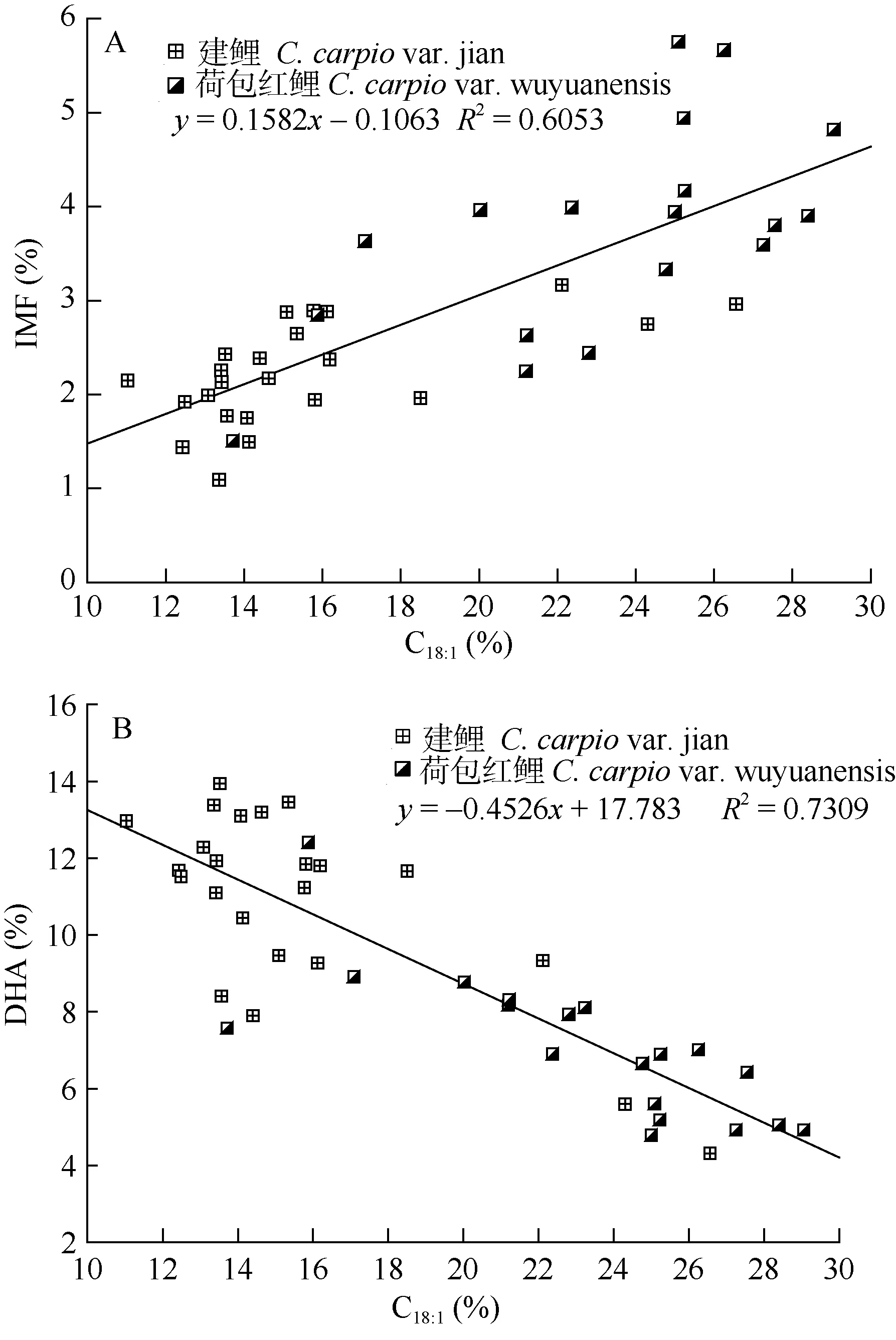
图1 油酸(C18:1)与IMF含量(A)、DHA含量(B)的关系Fig. 1 Relation of Oleic acid (C18:1) with content of intramuscular fat (A) and DHA (B)
CcApo-C-Is与鲤科鱼类斑马鱼、稀有 鲫、朝鲜 相似性 89%—92%, 与鲈形目的罗非鱼(Oreochromis niloticus)、金头雕(Sparus aurata)和鲑形目大西洋鲑(Salmo salar)的相似性均为 70%左右, 与两栖类的非洲爪蛙(Xenopus laevis)和哺乳动物小鼠(Mus musculus)、人(Homo sapiens)等的差异较大, 相似性在 50%—60%。对来自不同物种的Apo-C-I, 包括不同鱼类如鲤科的斑马鱼、稀有、朝鲜, 鲈形目的罗非鱼、金头雕、斜带石斑鱼, 鲑形目大西洋鲑, 鳉 鳉形目青 (Oryzias latipes), 两栖类的非洲爪蛙, 爬行类的扬子鳄(Alligator sinensis)、绿变色蜥(Anolis carolinensis), 以及哺乳类的鼠、人等的 Apo-C-I进行比对并构建系统进化树(图 2)。结果显示, 鱼类Apo-C-I独立形成一支, 其中鲤科鱼类先和鲑形目的大西洋鲑合成一小支, 然后再与鳉形目和鲈形目构成的一支合并, 鱼类与其他纲动物的遗传距离从近到远依次是两栖类、爬行类, 最后是哺乳类。相较于 CcApo-C-Ib,CcApo-C-Ia与朝鲜 、稀有 鲫亲缘关系更近。
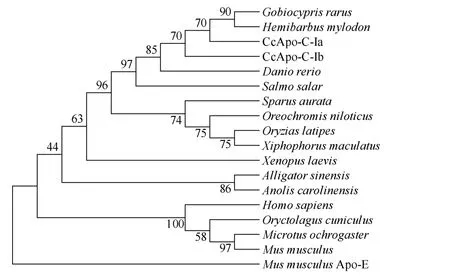
图2 Apo-C-I的NJ系统进化树Fig. 2 Phylogenetic tree of Apo-C-I
2.4 CcApo-C-Is mRNA的组织表达水平
实时荧光定量结果显示鲤CcApo-C-Is在建鲤和荷包红鲤脑、心脏、肾脏、肠、性腺等组织均能检测到, 但在肝脏表达量最高为脑的6倍, 其次是脑, 为心脏和精巢的4倍, 其他组织均微量表达, 表现出较明显的组织特异性(图 3)。
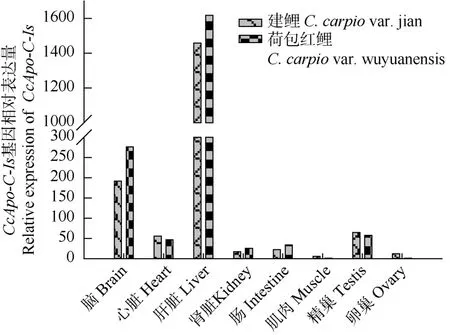
图3 CcApo-C-Is mRNA的组织表达Fig. 3 Tissues expression pattern of CcApo-C-Is mRNA
2.5 CcApo-C-Is在建鲤、红鲤肝脏和肌肉的表达及与C18:1的关系
建鲤、荷包红鲤肝脏和肌肉中Apo-C-Is基因表达比较, 由图4可以看出, 两品种鲤肝脏中Apo-C-Is的表达量均高于肌肉组织(P<0.01)。Apo-C-Is在荷包红鲤肝脏、肌肉中的表达量均高于建鲤, 其中肝脏 Apo-C-Is的表达量差异显著(P<0.05), 荷包红鲤是建鲤的 1.5倍(图 5)肝脏CcApo-C-Is表达量与 C18:1回归分析发现, 两者回归关系显著, 但相关系数不高 (P<0.01, R2=0.40)。
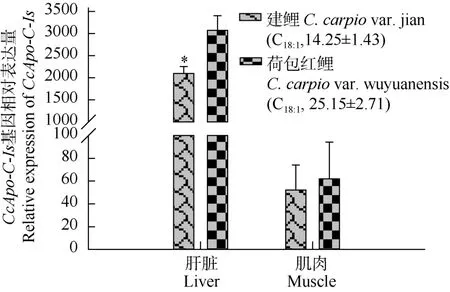
图4 建鲤、荷包红鲤肝脏和肌肉中CcApo-C-Is基因表达比较Fig. 4 Expression levels of Apo-C-Is in liver and muscle of C.carpio var. jian and C. carpio var. wuyuanensis
3 讨论
3.1 脂肪酸组成及肌内脂肪含量
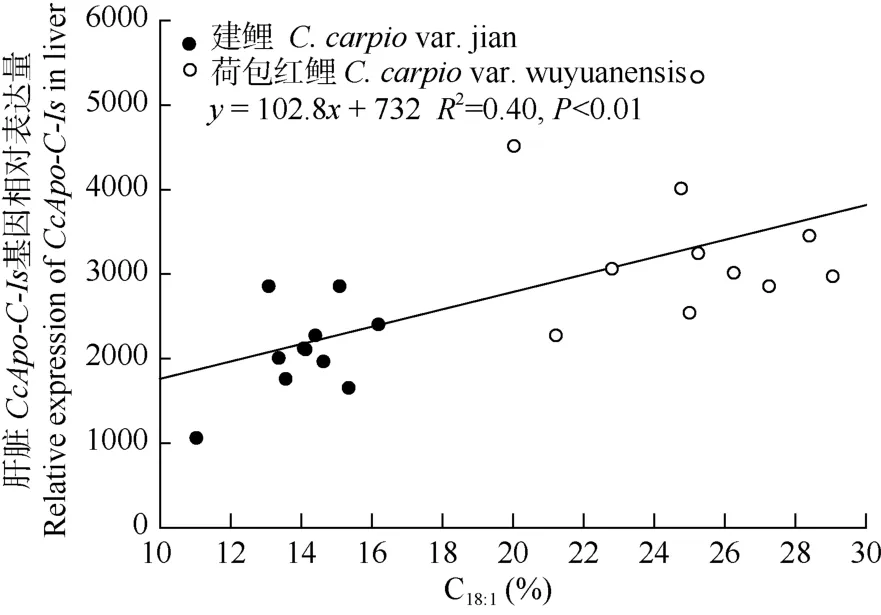
图5 肝脏CcApo-C-Is基因表达量与IMF C18:1的相关性分析Fig. 5 Correlation analysis of CcApo-C-Is expression level in liver with IMF C18:1
鱼类肌肉 IMF和脂肪酸组成具有种间差异性, 还受到饲养状况、季节因素、性腺发育程度等多种因素影响[15,16],本研究结果显示同池养殖的建鲤和荷包红鲤 IMF差异显著, 荷包红鲤 3.56%显著高于建鲤 2.28% (P<0.05), 由于养殖条件一致, 本研究认为差异来自建鲤和荷包红鲤的遗传差异。从养殖过程中发现, 荷包红鲤体型肥短, 活动迟缓, 生长明显比建鲤慢(从本文采集的样本重量可以看出), 这表明荷包红鲤活动和生长耗能会比建鲤少, 从而积累的脂肪比较多。本文测定的建鲤、荷包红鲤脂肪酸组成中∑MUFA(19.97%、28.20%, P<0.01)和∑PUFA(48.94%、43.38%, P<0.01), 分别与罗永康、徐如卫等[17,18]报道的鲤∑MUFA(38%—46%)、∑PUFA(25%—29%)差异比较明显,推测可能与鱼的品种、养殖所采用的饲料配方以及样品采集时间有关。如本次测定的鲤于初春采样, 经过越冬长期饥饿阶段, 鲤体内部分 MUFA被氧化用于能量供给, 所以∑MUFA 明显低。Zajic等[19,20]对鲤选择性氧化FA的研究表明, 在运动过程中或在饥饿开始阶段, 鱼类消耗脂肪酸时优先利用 MUFA来供应能量, 而将长链 PUFA保存下来, 导致 PUFA比例增加。而∑SFA (26.99%、25.62%, P<0.01)则和罗等报道的∑SFA (24%—28%)相差不大, 原因可能是SFA中95%左右的C16:0、C18:0是鱼类可以自身合成的脂肪酸, 虽然也受饲料中脂肪酸含量及其他因素的影响, 但差别不大[21]。
鲤肌肉脂肪酸(FA)组成和肌内脂肪(IMF)含量的关系分析, 可以发现 C18:1与 IMF含量正相关(R2=0.61), 已有分析显示, 鲤C18:1主要存在于三酰甘油(TAG)内, 且鲤肌肉脂肪中TAG的含量高达60%—80%[15,19], 这些和本文发现的C18:1与IMF的关系一致, 荷包红鲤IMF含量高于建鲤, C18:1的含量也比建鲤高。此外, 本研究首次显示鲤C18:1与DHA呈明显负相关(R2=0.73), 这与杜冰在破囊弧菌中的结果一致[22]。由于微生物体内多不饱和脂肪酸的合成机制与高等动物基本一致, 杜冰在破囊弧菌培养基中添加不同含量的C18:1, 结果发现, C18:1含量越高, DHA的合成越少, 并认为可能是油酸抑制了脱饱和酶的活性或阻碍了脱饱和酶的合成所致。本实验发现荷包红鲤与建鲤脂肪酸组成的差异主要在C18:1和DHA的比例。虽然建鲤IMF比荷包红鲤低, 但建鲤肌肉中DHA、EPA含量相对较高, n-3/n-6PUFA比值(0.50±0.10)也比荷包红鲤(0.35±0.08)高, 从对人体健康角度考虑, 建鲤具有更高的营养价值。
3.2 CcApo-C-Is基因序列和组织表达
Apo-C-1在脂质运输和摄取过程中起着重要作用,本实验在鲤肝脏中分离到了两种 CcApo-C-Is基因, 与斑马鱼同源基因有较高的相似性, 两者ORF序列相似性较高,但内含子序列和长度差异明显, 可判定是来自两个不同位点。这再一次证明了鲤基因组中存在两种重复基因,这与已有的鲤功能基因研究结果一致, 是鲤特有的基因加倍事件[13]。荷包红鲤和建鲤 CcApo-C-Is的序列一致,特别是阅读框部分, 因此, 从基因序列上不能反映出鲤品种的分化。Apo-C-I进化树较好地反映了动物由水生到陆生进化过程, 可作为系统分类的分子标记。此外CcApo-C-Ia和CcApo-C-Ib与稀有 鲫、朝鲜 、斑马鱼Apo-C-I的遗传距离不完全一致, 推测是两基因本身起源存在差异, 或者进化过程中所受的选择压力不同。荧光定量结果表明CcApo-C-Is在建鲤、荷包红鲤主要组织包括肝脏、脑、心脏、肠、性腺、肌肉等中均能检测到有表达, 其中肝脏丰度最高, 脑次之, 心脏、肾脏、肌肉、肠、性腺等其他组织表达量较低, 这与人[23]和稀有 鲫[9]的Apo-C-I mRNA主要在肝脏表达的结果一致, 也反映了Apo-C-I功能的保守性。
3.3 CcApo-C-Is mRNA的表达对IMF、肌肉脂肪酸组成的影响
肝脏、肌肉以及腹腔肠系膜组织是鱼类主要的脂肪蓄积部位, IMF均匀地分布于肌肉组织中, 其含量是脂肪合成、脂肪酸转运和降解三个方面综合作用的结果, 机体可以通过控制相关酶的活性来调节体脂的沉积。本实验结果表明 CcApo-C-Is在荷包红鲤肝脏、肌肉的表达水平均高于建鲤, 其中肝脏差异显著(P<0.05)。
肝脏是脂肪酸 β-氧化的重要部位, 也是鱼类改变脂肪蓄积的主要调节性贮脂器官[24], 鱼类肝脏拥有较哺乳动物肝脏更有效的脂质摄取能力, 其摄取 TAG脂蛋白的途径受到限制或其内脂肪分解酶的活性受到调控, 都会不同程度影响脂肪代谢。肝脏摄取TAG脂蛋白残粒依赖于 Apo-E, Weisgraher等[5]研究认为, Apo-C-I能够置换β-VLDL中的 Apo-E或改变、掩盖其结构而抑制 Apo-E介导的β-VLDL与LDL受体相关蛋白(LRP)结合, 结果降低了肝脏对富含 TAG脂蛋白的摄取能力, 从而, 增加了外周组织获得 TAG脂蛋白的机会。此外, 已有的研究表明Apo-C-I是LPL的一种有效抑制剂[5,7], LPL作为鱼类肝脏内的一种主要脂肪分解酶, 可水解未被其他组织利用的过量乳糜微粒和 VLDL中的 TAG, 为肝脏提供游离脂肪酸(FFA)[25], 而 Apo-C-I能够抑制其介导的VLDL-TAG脂解产生FFA过程[26]。Apo-C-I还可与已产生的FFA结合从而降低了FFA的反应活性, 减少了细胞对其的利用[27]。肝脏中 CcApo-C-Is表达量过高, 致使肝脏分解代谢脂肪酸受到一定程度的限制。因此, CcApo-C-Is在荷包红鲤肝脏内高表达, 一方面与 Apo-E竞争减少了肝脏TAG的摄取, 另一方面通过抑制LPL酶的活性,减少了肝脏对TAG的分解利用, 结果有更多的TAG脂蛋白通过血液运输到外周组织。在对虎河豚(Fugu ocellatus)、牙鲆(Paralichthys olivaceus)、真鲷(Pagrosomus major)等[28]鱼类研究中表明, 肝脏、肠通过分泌TAG脂蛋白(主要是VLDL-TAG)的方式将吸收或合成的脂质通过血液运输到外周组织, 如在脂肪组织储存或在肌肉组织氧化。肌细胞摄取VLDL中的TAG同样需要LPL的参与, 为其提供非酯化的FA。荷包红鲤肌肉中CcApo-C-Is的高表达也可通过抑制LPL酶活及与FFA结合而降低肌肉组织对脂肪酸的β-氧化水平, 从而使更多的TAG转至肌内脂肪组织被重新酯化储存, 但CcApo-C-Is在肌肉和肝脏的表达水平差异显示, CcApo-C-Is在脂蛋白转运方面的作用更大。
综上所述, CcApo-C-Is的高表达导致了荷包红鲤IMF中TAG相对于建鲤增多, 而C18:1在鲤肌肉TAG中的含量较高[14], 由此推测, CcApo-C-Is的高表达可能是导致C18:1在荷包红鲤肌肉比建鲤肌肉中含量高的原因之一。相关性分析表明, CcApo-C-Is与 C18:1之间存在相关性(P<0.01),由于影响肌肉C18:1的因子不止CcApo-C-Is一个, 因此相关系数不高(R2=0.40)。以上分析表明 CcApo-C-Is的表达水平对肌肉 C18:1有影响, 但要全面了解荷包红鲤和建鲤肌肉C18:1差异的机制, 需要挖掘更多的基因。
4 小结
本文比较了建鲤与荷包红鲤IMF和肌肉脂肪酸组成,发现建鲤DHA、EPA含量优于荷包红鲤, n-3/n-6PUFA的值比荷包红鲤高, 因此从人类饮食营养方面考虑, 建鲤的脂肪酸组成对人体健康更有益。本文分离了鲤的CcApo-C-Is基因, 并确定其在鲤肝脏表达最丰富。建鲤、荷包红鲤肝脏 CcApo-C-Is的转录水平比较发现荷包红鲤的表达量明显偏高, 鉴于Apo-C-I与ApoE的竞争性、抑制LPL酶的能力和可与游离FFA结合的特征, 推测建鲤、荷包红鲤肝脏和肌肉 CcApo-C-Is的差异是导致两者肌肉C18:1差异的原因之一。

