1-MCP处理对苦瓜果实贮藏品质和采后生理的影响
王 波,潘永贵,赵 宇,袁梦麒,李艺筱,苏金晶(海南大学食品学院,海南海口570228)
1-MCP处理对苦瓜果实贮藏品质和采后生理的影响
王波,潘永贵*,赵宇,袁梦麒,李艺筱,苏金晶
(海南大学食品学院,海南海口570228)
研究了1-甲基环丙烯(1-MCP)处理对苦瓜果实贮藏品质和采后生理的影响。苦瓜果实采后用0.5、1.0、1.5 μL/L 1-MCP处理12 h后,在20℃下贮藏。贮藏期间测定果实腐烂率、硬度、色差、可溶性固形物和可滴定酸含量、抗坏血酸含量、H2O2含量、超氧阴离子产生速率、果实的过氧化氢酶及过氧化物酶活性等指标的变化。结果表明:与对照组果实相比,1-MCP处理能有效延缓苦瓜果实硬度的下降,保持较高的抗坏血酸、可滴定酸和可溶性固形物含量,抑制果实中H2O2、O2-·含量的上升;且在整个贮藏期间,能够有效增加处理组果实过氧化物酶和过氧化氢酶的活性。另外,1-MCP还可以抑制果实的腐烂,但是过高浓度反而会增加果实的腐烂。研究认为,0.5 μL/L 1-MCP处理可延缓采后苦瓜果实成熟衰老和贮藏品质下降,在20℃下延长贮藏时间达4 d以上。
苦瓜,1-MCP,贮藏品质,采后生理
苦瓜(Momordica charantia L.)是一种重要蔬菜,大量种植于亚洲,在中国又被称为君子菜、癫葡萄、凉瓜等。苦瓜含有大量的人体必需氨基酸、类胡萝卜素、叶酸、抗坏血酸和酚类化合物等,而且包含许多生物活性化合物,如苦瓜蛋白Ⅰ、苦瓜素Ⅰ和Ⅱ等[1]。还有研究表明,苦瓜含有多糖,具有抗糖尿病的作用,可以有效地降低血液中葡萄糖含量[2]。除此之外,苦瓜还具有改善人体免疫力的作用[3]。因此,苦瓜越来越受到消费者的喜爱。但是,苦瓜果实采收后,常温下易发生黄化,种皮转红,失去食用价值[4-5]。1-甲基环丙烯(1-MCP)是一种乙烯作用抑制剂,可以竞争性结合乙烯受体,抑制因乙烯导致的果实软化和组织的成熟衰老[6]。近年来,大量研究发现1-MCP可降低跃变型果实呼吸强度,并推迟乙烯高峰的出现,能延缓苹果、香蕉、梨、猕猴桃等跃变型果实的品质下降,显著延长果蔬的贮藏期和货架期[7]。苦瓜是一种跃变型蔬菜,已有1-MCP处理对采后苦瓜果实贮藏品质影响的研究报道,但是比较少,且通过研究得出的结论不一。Anbarasan等[8]研究了1-MCP处理时长对苦瓜理化品质的影响,得出使用1-MCP处理12 h能够有效延缓苦瓜果实硬度,并增加pH;李晓辉等[9]和Han等[10]都研究了不同浓度1-MCP对苦瓜采后生理和贮藏品质的作用,但是二者研究结果不同,前者认为1.0 μL/L 1-MCP处理苦瓜保鲜效果最优,而后者认为是5.0 μL/L 1-MCP处理。本研究设置0.5、1.0、1.5 μL/L三个浓度梯度1-MCP处理,在20℃贮藏条件下研究1-MCP处理对海南苦瓜采后果实生理生化品质的影响,旨在探讨苦瓜保鲜的最适1-MCP处理浓度,以期为海南苦瓜果实的贮运保鲜提供理论基础。
1 材料与方法
1.1材料与仪器
苦瓜品种为“槟城”,2014年12月9日采于海南乐东佛罗镇一果园,选取瓜形一致、长度约(22±1)cm、大小均匀、表皮青绿色,无病虫害、机械损伤的果实(留果柄),装于果蔬用塑料筐中,当天运至实验室,并置于5℃冷库中预冷2 h;1-甲基环丙烯(聪明鲜)美国罗斯哈门公司,含量0.014%;咪鲜胺锰盐(施保功)德国拜耳,含量50%;Triton X-100、乙二胺四乙酸(EDTA)、3,5-二硝基水杨酸试剂、聚半乳糖醛酸、α-萘胺、聚乙烯吡咯烷酮(PVP)、聚乙二醇6000、愈创木酚、盐酸羟胺、对氨基苯磺酸、四氯化钛、1-苯丙氨酸、三氯乙醇(TCA) 以上试剂均为分析纯;β-巯基乙醇、2-硫代巴比妥酸BR化学试剂。
JM-B 20002电子天平诸暨市超详衡量设备有限公司;GY-1型硬度计牡丹江市机械研究所;PAL-1型手持折光仪日本ATAGO公司;PL 303电子天平梅勒特-托利多仪器(上海)有限公司;RH Basic 1磁力加热搅拌器德国IKA公司;HH-4数显恒温水浴锅常州奥华仪器有限公司;TGL.16G台式高速离心机上海安亭科学仪器厂;TU-1901紫外可见分光光度计北京普析通用仪器有限公司;722型可见分光光度计上海欣茂仪器有限公司。
1.2实验方法
1.2.1处理方法将预冷后的苦瓜经过清洗晾干后,随机分成三个处理组:0.5、1.0、1.5 μL/L 1-MCP,以不使用1-MCP处理作为对照(CK),各组果实均分别放入485 mm×320 mm×220 mm的泡沫箱内,在20℃下密闭处理12 h。处理完毕后,分别用聚乙烯保鲜袋(30 cm×40 cm,厚度为0.025 mm)包装,每袋4个果实,贮藏于20℃。贮藏期间,每隔3 d取样测定各组指标,当苦瓜橙黄开裂或腐烂率严重时贮藏结束。
1.2.2腐烂率将病斑占苦瓜表面的面积分级划分为四级:0级,无腐烂;1级,腐烂面积小于5%;2级,腐烂面积5%~15%;3级,腐烂面积大于15%。按下式计算腐烂率:腐烂率=Σ(腐烂级别×该级果数)/总果实数。
1.2.3硬度每个处理随机取5个果实,小刀削去苦瓜腰部的肉刺,使用硬度计测定。
1.2.4色差使用Antunes等[11]的方法,测定果皮的L*、a*、b*值,L*值表示亮度,色度(H*)=180°+arctan(b*/a*),变动区间从180°(绿色)到90°(黄色)。
1.2.5可溶性固形物(TSS)使用手持折光仪法[12]。1.2.6可滴定酸(TA)采用酸碱滴定法[12]。
1.2.7抗坏血酸(AsA)采用2,6-二氯酚靛酚滴定法[12]。
1.2.8超氧阴离子(O2-·)产生速率参照曹建康[12]的方法,略作修改。取1 g果肉加入3 mL预冷的0.1 mol/L pH7.8磷酸缓冲液 [含1 mmol/L EDTA、0.3%(w/v)Triton X-100、1%(w/v)聚乙烯吡咯烷酮(PVPP)],在冰浴条件下研磨成匀浆,于4℃、11000 r/min离心20 min,取上清液,低温保存备用。取1.0 mL上清液加入1.0 mL 50 mmol/L、pH 7.8磷酸缓冲液和1.0 mL 1 mmol/L盐酸羟胺溶液,摇匀后在25℃下保温1 h,然后加入1.0 mL 0.017 mol/L对氨基苯磺酸和1 mL 7 mmol/L α-萘胺,再于25℃下反应20 min,按照与制作标准曲线相同的方法立即测定显色液530 nm处的光吸收,结果以nmol·g-1·min-1表示。
1.2.9过氧化氢(H2O2)参照Sergiev等[13]的方法,略作修改。取1 g果肉置于研钵中,加入5 mL预冷的丙酮并在冰浴下研磨成匀浆,4℃下11000 r/min离心20 min后提取l mL上清液,混合0.1 mL 20%的四氯化钛(TiCl4)的浓盐酸(V/V)溶液和0.2 mL浓氨水进行反应,反应完毕后生成的钛过氧化物的复合物在14000 r/min离心10 min,使用丙酮对离心所获取的沉淀物反复洗涤2~3次,直到除去色素,向沉淀中加入3 mL 1 mol/L的H2SO4溶液,待完全溶解后于410 nm波长下测定吸光值。以标准H2O2溶液制作标准曲线。H2O2含量以μmol·g-1表示。样品重复测3次。
1.2.10过氧化氢酶(CAT)参照曹建康[12]的方法,略作修改。取果肉1 g,在研钵中加入经预冷的3 mL 0.05 mol/L pH7.5磷酸缓冲液与样品混合并在冰浴中研磨成匀浆,4℃下11000 r/min离心20 min,获取上清液,并于-20℃下保存备用。酶促反应体系包括由0.1 mL酶提取液 [5 mmol/L TSS、5%(w/v)PVP]、2.9 mL 0.02 mol/L的双氧水。以蒸馏水为参比空白,在反应15 s时开始记录反应体系在波长240 nm处吸光度值,作为初始值,然后每隔15 s记录一次。CAT酶活性以每分钟吸光值减少0.01为一个过氧化氢酶活性单位(U)。
1.2.11过氧化物酶(POD) 参照愈创木酚比色法[12],略作修改。取果肉1 g置于预冷研钵中,加入3 mL 0.1 mol/L pH5.5的乙酸-乙酸钠缓冲液[含4%(w/v)PVPP,1%(v/v)TritonX-100,1 mmol/L PEG],冰浴研磨成匀浆,于4℃下11000 r/min离心20 min,获取上清液,低温保存备用。测定时,取0.5 mL酶提取液和3.0 mL 0.025 mol/L愈创木酚溶液、加入200 μL 0.5 mol/L过氧化氢,混合后倒入比色杯中进行比色。以蒸馏水为参比,在反应15 s时开始记录反应体系在波长470 nm处吸光度值,每隔15 s记录一次,连续测定至少六次,重复三次。以每分钟吸光度变化0.01为1个活性单位(U)。
1.3数据处理
数据使用Excel 2010和SigmaPlot 10.0软件进行处理,使用SPSS 19.0数据分析软件在LSD分析方法下进行差异显著性分析。
2 结果与讨论
2.11-MCP处理对苦瓜贮藏过程中腐烂率的影响
如图1所示,贮藏前3 d各组果实均无腐烂出现,贮藏至第7 d,除了0.5 μL/L 1-MCP处理组果实,对照组和其他处理组苦瓜果实开始出现不同程度的腐烂,其中,对照组和1.5 μL/L 1-MCP处理组果实腐烂率上升幅度最大;贮藏至第19 d时,两组果实均全部腐烂。而0.5 μL/L 1-MCP处理组苦瓜果实在第11 d才开始出现腐烂,在整个贮藏过程中腐烂率均较低,至贮藏末期,其腐烂率为60.0%;1.0 μL/L 1-MCP处理组果实腐烂率仅次于0.5 μL/L 1-MCP处理组果实,为62.5%。由此可见1-MCP处理可以降低苦瓜果实的腐烂率,但较高浓度1-MCP处理反而会加速苦瓜果实的腐烂,这与Han等[10]在苦瓜上的研究结果一致,表明低浓度1-MCP抑制果实腐烂,在高浓度时反而促进果实腐烂,这可能是高浓度1-MCP刺激了果实的生理过程,造成生理紊乱[14],但是具体原因有待进一步研究。
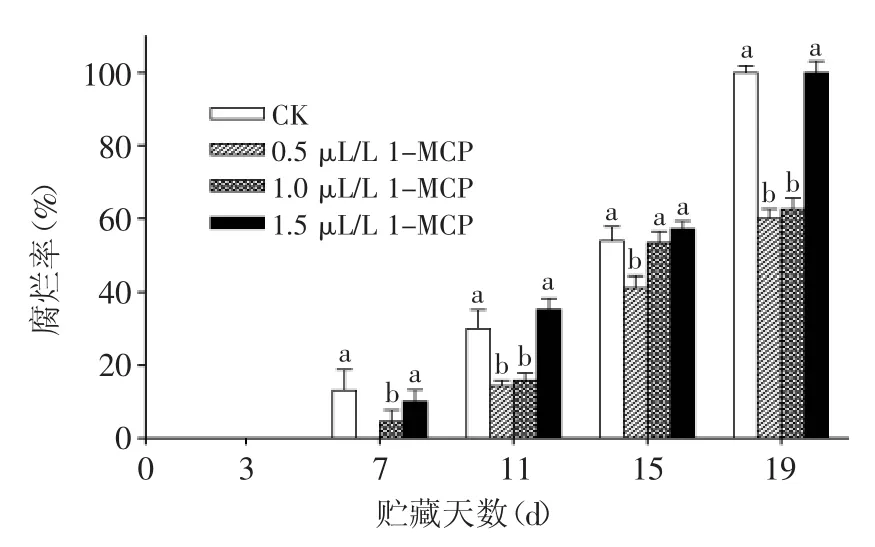
图1 1-MCP处理对苦瓜果实在20℃贮藏期间腐烂率的影响Fig.1 Effect of 1-MCP treatment on decay rate of bitter gourd during storage at 20℃
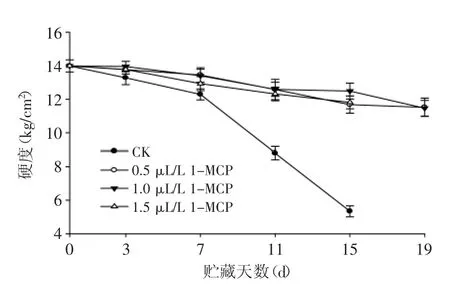
图2 1-MCP处理对苦瓜果实在20℃贮藏期间硬度的影响Fig.2 Effect of 1-MCP treatment on firmness of bitter gourd during storage at 20℃
2.21-MCP处理对苦瓜贮藏过程中硬度的影响
由图2可知,苦瓜果实硬度均随着贮藏时间延长呈下降趋势。前7 d各组硬度下降较缓慢,对照组苦瓜果实自贮藏第7 d开始,硬度快速下降,贮藏至第15 d,仅为初始值的38.2%。经1-MCP处理的苦瓜果实,在整个贮藏期间,果实硬度下降较为平缓,各处理组间无显著性差异,但是在贮藏后期均极显著高于对照组果实(p<0.01)。这说明了1-MCP处理可显著延缓苦瓜果实硬度的下降,其原因可能是乙烯调节软化相关代谢酶的活性被1-MCP抑制而导致[10]。
2.31-MCP处理对苦瓜贮藏过程中果皮颜色的影响
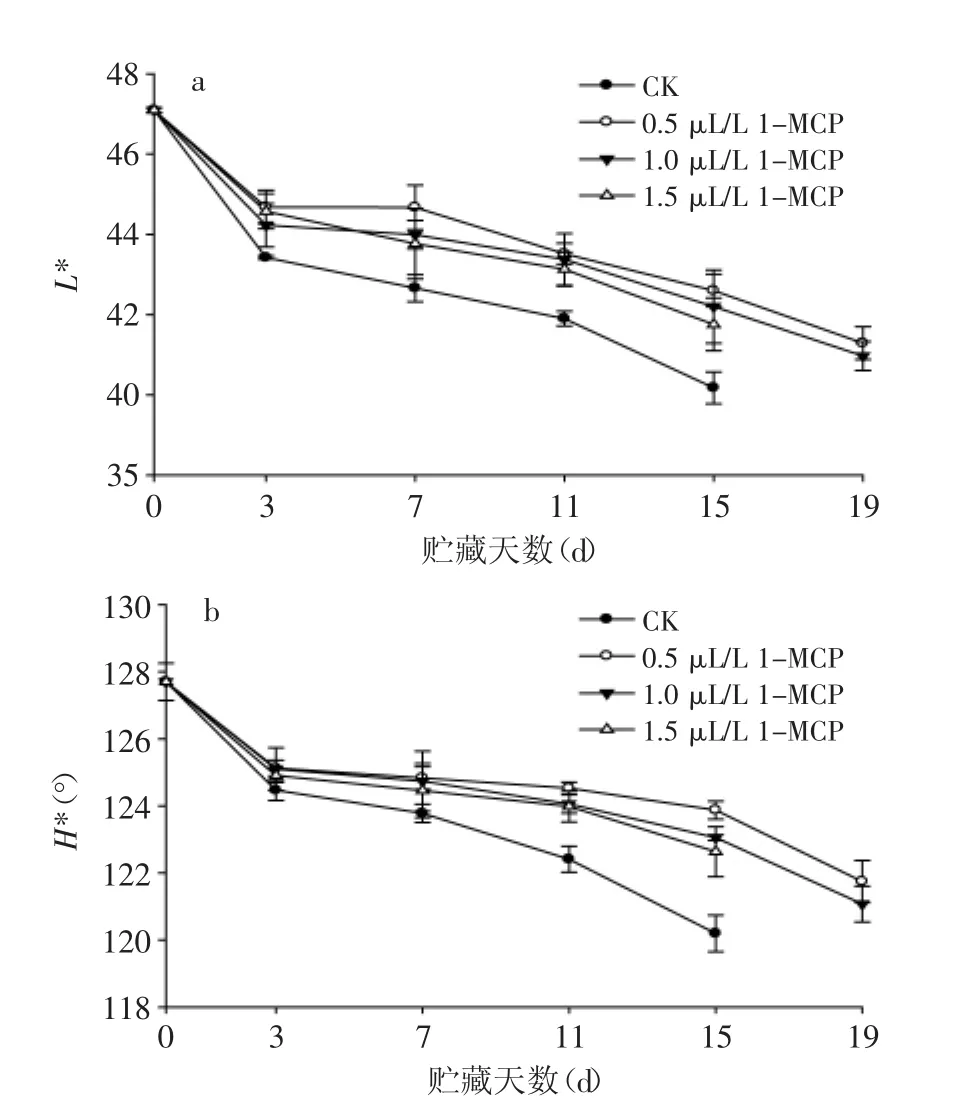
图3 1-MCP处理对苦瓜果实在20℃贮藏期间果皮颜色的影响Fig.3 Effect of 1-MCP treatment on color change of bitter gourd peel during storage at 20℃
如图3a所示,随着贮藏时间延长,苦瓜果实L*值均呈下降趋势,且前3 d下降较快,后面下降较缓。贮藏过程中,处理组果实L*值始终高于对照组,其中0.5和1.0 μL/L 1-MCP处理组之间无显著性差异(p>0.05);贮藏至第15 d时,对照组果实L*值比初始值下降了18.6%,显著低于1-MCP处理组果实。整个贮藏期间,H*值表现出和L*值相同的下降趋势(图3b),从第3 d开始,对照组和处理组差异逐渐增大;至贮藏第15 d,对照组H*值为114.90°,表明果实黄化较严重(180°>H*>90°),而处理组果实H*值之间虽无显著性差异,但相比于对照组,距初始值下降幅度较小,说明1-MCP较好的保持了贮藏期间苦瓜果实的颜色,与在黄秋葵[15]上的研究结果相同。但是,研究表明苦瓜果实颜色的改变和1-MCP处理浓度无显著关系,虽然研究对象均为苦瓜,但这与李晓辉等[9]的研究结果不同,其认为1-MCP浓度越高,延缓苦瓜果实颜色改变的效果越好。这可能与研究所用的苦瓜品种和产地均有所不同所致,李晓辉等[9]使用的苦瓜品种是大肉2号,产自郑州,而本研究采用海南槟城苦瓜。但是,导致差异的具体原因还需要进一步的研究认证。
2.41-MCP处理对苦瓜贮藏过程中TSS和TA含量的影响
随着贮藏时间延长,不同1-MCP处理的苦瓜果实中TSS含量均表现为先上升,后下降的趋势(图4a),但是对照组变化波动较大,快速上升,然后快速下降,而1-MCP处理组果实变化相对缓慢,变化幅度也较小,并且,在贮藏后期,1-MCP处理组果实TSS含量均显著高于对照组果实(p<0.05),说明1-MCP处理能够抑制果实TSS含量的变化。如图4b所示,苦瓜果实中TA含量变化与TSS含量变化趋势相同,总体呈下降趋势。贮藏前期,对照组果实TA含量上升,在第3 d达到高峰,峰值较1-MCP处理组果实提前出现;而0.5 μL/L和1.0 μL/L 1-MCP处理果实在第7 d出现峰值,说明1-MCP可以延缓果实TA的上升。贮藏后期,处理组果实TSS和TA含量均显著高于对照组果实(p<0.05),其中0.5 μL/L 1-MCP处理的果实TSS含量最高,至第19 d时,果实TSS和TA含量距初始值仅分别下降了0.97%和1.57%。TSS和TA含量是果实内部品质指标,可以用来粗略衡量果实的呼吸基质和潜在货架寿命[16]。TSS含量的浮动变化,是因为可溶有机酸含量的上升或者细胞壁中多糖物质的分解所致[17];TA含量下降,则与有机酸作为呼吸基质被消耗有关[18],均与果实的呼吸衰老有关;而1-MCP能够主要通过竞争性地与乙烯受体结合,不同程度地延迟果蔬体内乙稀和呼吸峰的出现[19],从而延缓苦瓜体内TSS和TA含量的下降,延缓了苦瓜的后熟衰老。
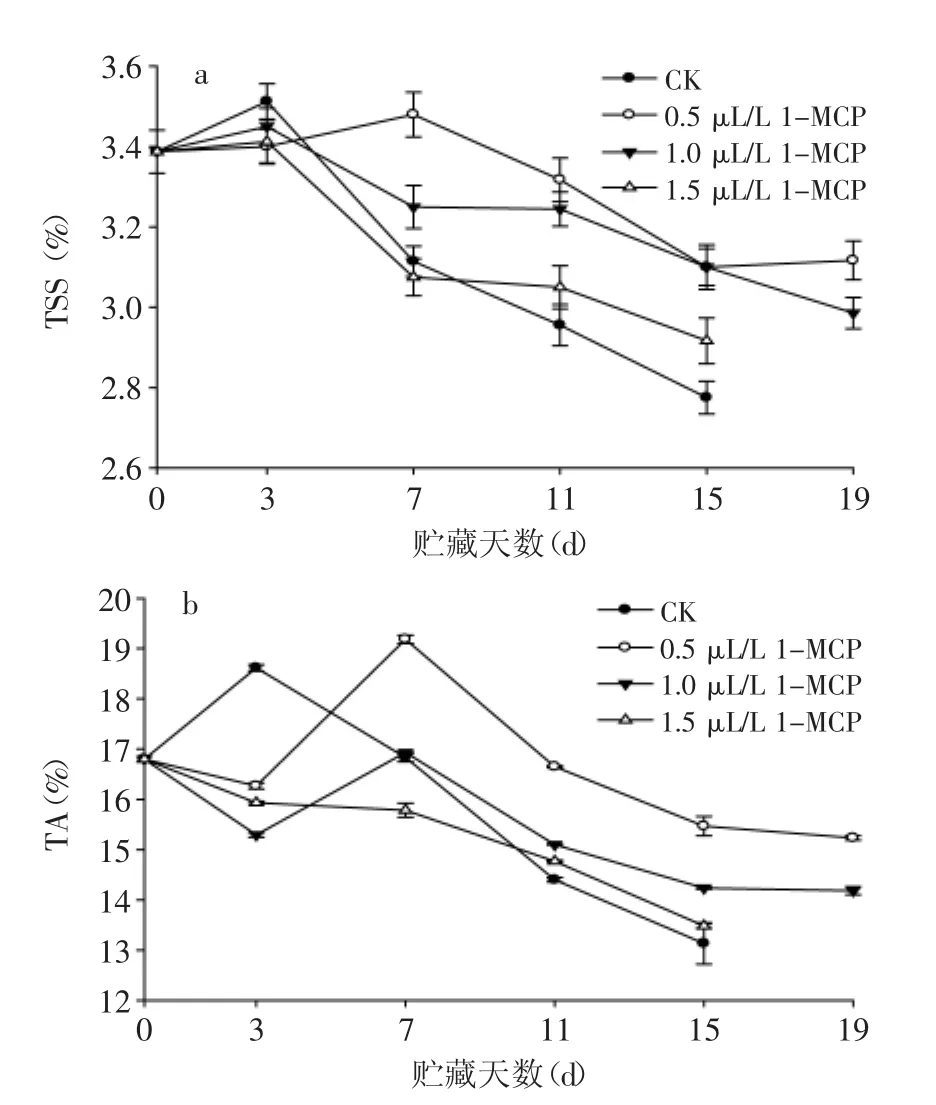
图4 1-MCP处理对苦瓜果实在20℃贮藏期间TSS和TA含量的影响Fig.4 Effect of 1-MCP treatment on TSS and TA content of bitter gourd during storage at 20℃
2.51-MCP处理对苦瓜贮藏过程中抗坏血酸(AsA)含量的影响
由图5可知,在贮藏初期,随着苦瓜果实后熟程度的增加,各组AsA含量呈上升趋势,第3 d出现高峰,随后各组AsA含量快速下降,第7 d后,对照组果实和1-MCP处理组果实出现显著性差异(p<0.05),而处理组之间无显著差异。1-MCP处理组果实AsA含量下降相对较缓,且贮藏至第19 d,仍能维持较高的含量,说明1-MCP处理能够延缓苦瓜果实贮藏期间AsA含量的下降,但是不同于在黑樱桃果实[20]和皇冠梨[21]上的研究结果,他们研究表明,1-MCP处理几乎不会影响果实AsA含量的变化,而造成不同结果的原因可能与研究所用的果蔬种类、研究条件以及1-MCP的浓度有关。
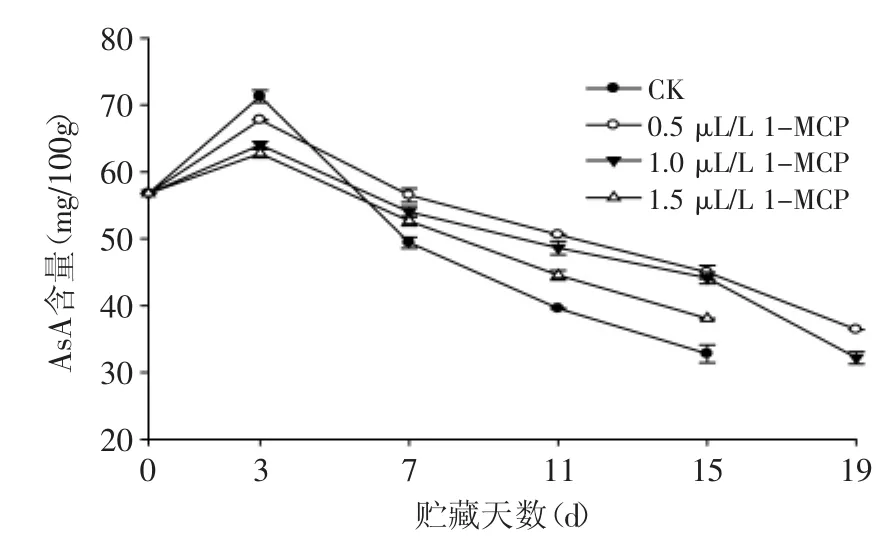
图5 1-MCP处理对苦瓜果实在20℃贮藏期间AsA含量的影响Fig.5 Effect of 1-MCP treatment on AsA content of bitter gourd during storage at 20℃
2.61-MCP处理对苦瓜贮藏过程中O2-·产生速率和H2O2含量的影响
由图6a可知,果实在贮藏过程中,各组果实O2-·的产生速率均随着时间的延长而升高,但对照组果实的O2-·变化幅度较大,且在后期急剧上升,显著高于处理组果实(p<0.05)。1-MCP处理组果实O2-·在前7 d上升较快,随后缓慢上升,但均低于对照组果实。贮藏至第15 d时,对照组果实中的O2-·产生速率是贮藏初始值的2.2倍;整个贮藏过程中,0.5 μL/L 1-MCP处理组果实O2-·产生速率始终最低,并在贮藏后期与其他组差异显著(p<0.05)。H2O2含量变化和O2-·产生速率变化趋势一致,均随着贮藏时间延长,逐渐上升(图6b),但对照组果实H2O2含量上升速度较快。1.5 μL/L 1-MCP处理果实H2O2含量从第7 d开始上升速度加快,至第15 d,其上升幅度是初始值的2.09倍,且其果实H2O2含量显著高于其他处理组果实(p<0.05),而0.5 μL/L 1-MCP处理组果实H2O2含量始终最低。由此可以说明,1-MCP可降低果实贮藏过程中O2-·的产生速率和H2O2含量的积累,且处理效果与1-MCP处理浓度关系密切。O2-·和H2O2等活性氧会随着贮藏时间的延长,在果实内部逐渐产生累积,并对果实细胞膜造成损伤,并导致果实软化衰老[22]。而1-MCP能够调节抗氧化酶系统,增加清除自由基相关酶的活性,减少细胞内积累的活性氧,从而延缓果实衰老[23]。
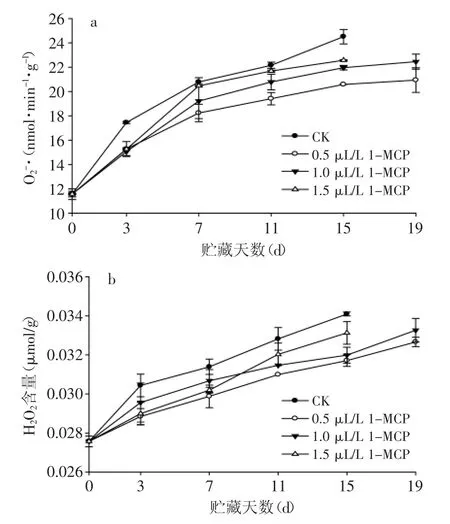
图6 1-MCP处理对苦瓜果实在20℃贮藏期间超氧阴离子(O2-·)产生速率和过氧化氢(H2O2)含量的影响Fig.6 Effect of 1-MCP treatment on superoxide anion(O2-·)activity and H2O2content of bitter gourd during storage at 20℃
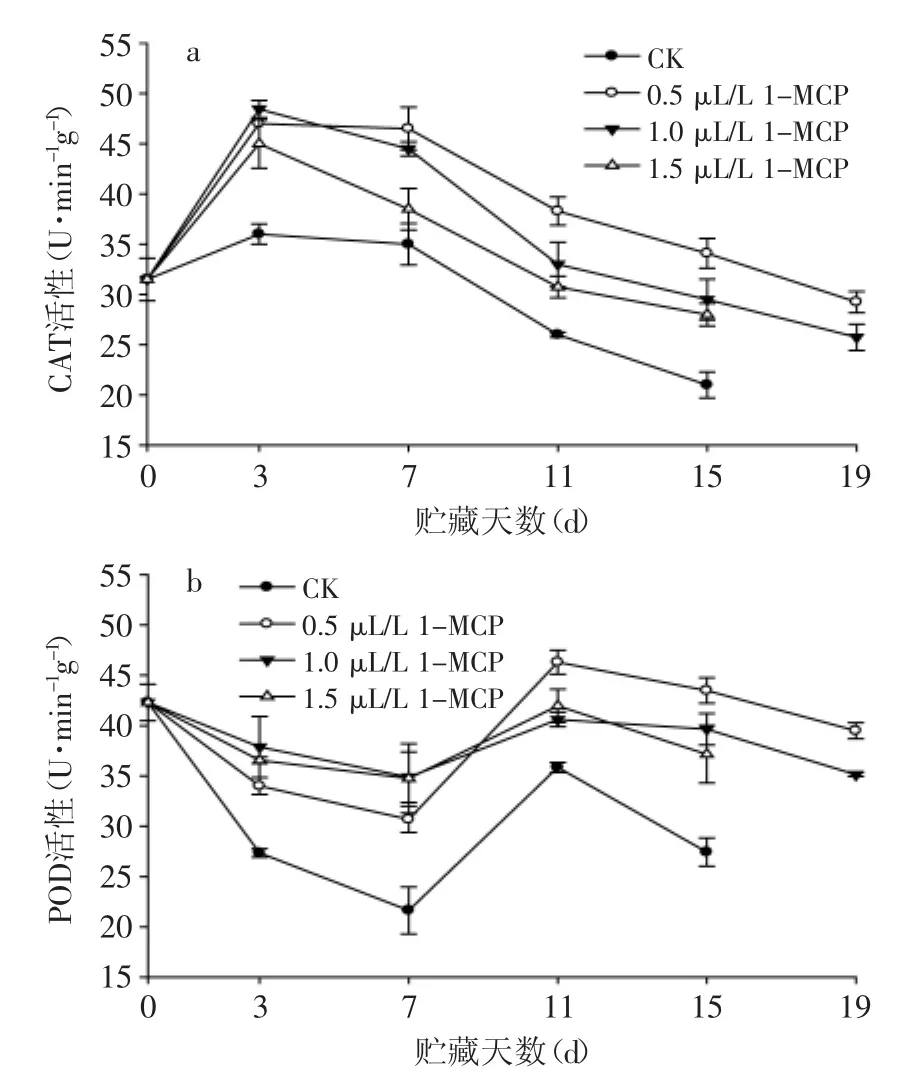
图7 1-MCP处理对苦瓜果实在20℃贮藏期间过氧化氢酶(CAT)和过氧化物酶(POD)活性的影响Fig.7 Effect of 1-MCP treatment on catalase(CAT)and peroxidase(POD)activity of bitter gourd during storage at 20℃
2.71-MCP处理对苦瓜贮藏过程中CAT和POD活性的影响
CAT、POD是植物体内普遍存在的氧化还原酶,它们可将H2O2分解为水,从而使机体免受过氧化物的毒害,维持细胞的正常代谢[10]。由图7a可以看出,各组果实CAT活性在前3 d均上升,随后开始下降,其中,处理组果实CAT活性始终高于对照组果实,且在第3 d后达到显著性差异(p<0.05)。POD酶活总体变化呈先下降后上升,然后又下降的趋势(图7b)。贮藏第11 d,各组POD酶活均达到峰值,其中,0.5 μL/L 1-MCP处理果实的酶活值最高,为46.3 U·min-1·g-1,高出对照组20.4%;在贮藏后期酶活下降过程中,处理组果实酶活下降较缓,且显著高于对照组果实(p<0.05)。整个贮藏过程中,0.5 μL/L 1-MCP处理苦瓜果实的CAT和POD酶活性始终最高,处理效果最优。O2-·和H2O2等活性自由基会在果蔬成熟过程中积累,而CAT和POD酶作为植物体内活性离子的清除剂,其活性会随着自由基的诱导而上升,并因清除活性自由基消耗而导致酶活最终下降(图7a、图7b)。本研究中,O2-·和H2O2等活性氧含量不断上升,而CAT和POD酶活性总体呈下降趋势,说明果实的衰老可能是活性氧和活性氧清除酶活性的不平衡导致的[24]。而1-MCP处理的苦瓜果实中O2-·和H2O2的水平显著低于对照组(图6a、图6b),说明1-MCP能够调节抗氧化酶系统,增加了CAT和POD等酶的活性,加强清除活性氧的能力,从而延缓果实衰老[25]。
3 结论
研究结果表明,1-MCP可使可溶性固形物和可滴定酸降解得到抑制,有效降低果实硬度的下降速度和果实黄化速率,推迟了果实劣变的进程,明显抑制苦瓜果实在贮藏期间MDA和H2O2含量的积累和O2-·产生速率,同时使CAT和POD在贮藏期间保持相对较高的活性。但是,1-MCP处理效果与其浓度不成正相关,相反,较高浓度的1-MCP处理反而会增加果实的腐烂和衰老。所以本研究认为,在20℃贮藏温度下,0.5 μL/L 1-MCP处理可以延缓海南苦瓜果实的衰老果实,且最佳贮藏时间为11 d,延长贮藏时间达4 d以上。
[1]Habicht S D,Kind V,Rudloff S,et al.Quantification of antidiabetic extracts and compounds in bitter gourd varieties[J]. Food Chemistry,2011,126(1):172-176.
[2]Zhou R,Tu N Y,Cong M,et al.Purification and hepatoprotective effect of Momordica Charantia polysaccharides[J].Food Science and Technology,2013,38(2):173-176.
[3]Nerurkar P,Ray R B.Bitter melon:Antagonist to cancer[J]. Pharmacal Research,2010,27:1049-1053.
[4]Zong Ru-jing,Morris L,Cantwell M.Postharvest physiology and quality of bitter melon(Momordica charantia L.)[J].Postharvest Biology and Technology,1995,1-2(6):65-72.
[5]Grover J K,Yadaf S P.Pharmacological actions and potential usesofMomordicaCharantia:Areview[J].Journalof Ethnopharmacology,2004,93:123-132.
[6]Sisler E C,Serek M.Inhibitors of ethylene responses in plants at the receptor level:Recent developments[J].Physiology Plant,1997,100:577-582.
[7]陈金印,刘康.1-甲基环丙烯(1-MCP)在果蔬贮藏保鲜上的应用研究进展[J].江西农业大学学报,2008,30:215-219.
[8]Anbarasan A,Tamilmani C.Effect of 1-methylcyclopropene(1-MCP)on the physiochemical changes during ripening of bitter gourd fruit(Momordica charantia L Var.Co-1)[J]. International Journal of Food Agriculture,2013,3:39-43.
[9]李晓辉,李鹏鹤,李楠楠,等.1-MCP对贮藏苦瓜生理及品质特性的影响[J].中国瓜菜,2014,27(3):43-45.
[10]Han C,Zuo J H,Wang Q,et al.Effects of 1-MCP on Postharvest Physiology and Quality of Bitter Melon(Momordica charantia L.)[J].Scientia Horticulturae,2015,180:86-91.
[11]Antunes M D C,Dandlen S,Cavaco A M,et al.Effects of postharvest application of 1-MCP and postcutting dip treatment on the quality and nutritional properties of fresh-cut kiwifruit[J]. Journal Agriculture Food Chemistry,2010,58:6173-6181.
[12]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
[13]Sergiev I,Alexieva V,Karanov E.Effect of spermine,at razine and combination between them on some endogenous protective systems and stress markers in plants[J].Comptes Rendus de l’Academie Bulgare Sciences,1997,51:121-124.
[14]任亚梅,唐远冒,李光辉,等.猕猴桃贮藏保鲜过程中1-MCP处理临界浓度的研究[J].中国食品学报,2013,13(1):107-111.
[15]Huang S L,Li T T,Jiang G X,et al.1-methylcyclopropene reduces chilling injury of harvested okra(Hibiscus esculentus L.)pods[J].Scientia Horticulturae,2012,141:42-46.
[16]Acedo A Jr,Thanh C D,Van L T S,et al.Tomato precooling using simple hydrocooler and fruit quality changes during ambient and cold storage[J].Acta Horticulturae(ISHS),2009,37:135-140.
[17]Fenemma O R.Food chemistry[M].New York:Marcel Dekker,1985:857-911.
[18]陈文恒,郜海燕,房祥军,等.快速预冷对杨梅采后生理和品质的影响[J].中国食品学报,2010(4):169-174.
[19]Jiang Y,Joyce D C,Macnish A J.Responses of banana fruit to treatment with 1-MCP[J].Plant Growth Regulation,1999(28):77-82.
[20]Gutierrez M S,Trinchero G D,Cerri A M,et al.Different responses of goldenberry fruit treated at four maturity stages with the ethylene antagonist 1-methylcyclopropene[J].Postharvest Biology and Technology,2008,48:199-205.
[21]龚新明,关军锋,张继澍.黄冠梨采后1-MCP和CaCl2处理对品质和果皮褐斑发生的影响[J].园艺学报,2010,37(3):375-382.
[22]张刚,李里特,丹阳.果蔬成熟衰老中的活性氧代谢[J].食品科学,2004(S1):227-232.
[23]Yuan G F,Sun B,Yuan J,et al.Effect of 1-methylcyclopropene on shelf life,visual quality,antioxidant enzymes and healthpromoting compounds in broccoli florets[J].Food Chemistry,2010,118:774-781.
[24]张敏,廖新福,王爱玲,等.1-MCP对甜瓜黄醉仙果实采后衰老的影响[J].果树学报,2014,31(2):308-312.
[25]陈志远,韩志平,张海霞,等.1-MCP在果蔬贮藏保鲜中的应用[J].黑龙江农业科学,2013(10):104-106.
Effect of 1-methylcyclopropene(1-MCP)treatment on storage quality and postharvest physiology of bitter gourd
WANG Bo,PAN Yong-gui*,ZHAO Yu,YUAN Meng-qi,LI Yi-xiao,SU Jin-jing
(College of Food Science,Hainan University,Haikou 570228,China)
Effects of 1-methylcyclopropene(1-MCP)on storage quality and postharvest physiology of bitter gourd fruit were investigated.The harvested bitter gourd fruits were treated with 0.5,1.0 and 1.5 μL/L 1-MCP for 12 h,then the fruit were stored at 20℃.During storage,the changes of decay rate,flesh firmness,color,total soluble solids(TSS)and titratable acid(TA)content,ascorbic acid(AsA)content,accumulation of superoxide anion(O2-·),hydrogen peroxide(H2O2),activity of catalase(CAT)and peroxidase(POD)were determined.The results showed that compared with the control fruit,1-MCP treatment suppressed fruit softening,maintained the high levels of AsA and TA content and increased TSS content.And the CAT and POD activity of treatments were increased and significantly higher than the control during storage.In addition,1-MCP treatment could suppress the decay rate of fruit,whereas the higher concentration increased the decay rate.Therefore,0.5 μL/L 1-MCP treatment could delay ripening and senescence of harvested bitter gourd fruit and maintain storage quality,prolonging the storage time for above 4 days under 20℃.
bitter gourd;1-methylcyclopropene;storage quality;postharvest physiology
TS201.1
A
1002-0306(2015)20-0348-06
10.13386/j.issn1002-0306.2015.20.063
2015-03-20
王波(1989-),男,在读硕士研究生,研究方向:果蔬贮藏保鲜及加工,E-mail:windygo@126.com。
潘永贵(1970-),男,博士,教授,研究方向:热带果蔬采后生理与保鲜技术,E-mail:yongui123@126.com。
“十二五”农村领域国家科技计划课题(2013BAD19B00);海南大学研究生优秀硕士论文培育计划。

