用于RNA干扰研究的大肠杆菌表达系统的条件优化
姚琼,董易之,徐淑,徐海明,陈炳旭
(广东省农业科学院植物保护研究所,广东广州510640)
1998年 Fire等[1]将体外转录得到的单链 RNA(正义RNA(sense RNA)和反义RNA(anti-sense RNA))注射到线虫Caenorhabditis elegans体内,发现两者都能够特异性阻断相应基因的表达,诱导了特异性的基因沉默(gene silencing),该小组将此现象称为RNA干涉(RNA interference,简称RNAi)。目前,RNAi技术已在多种模式生物如线虫(Caenorhabditis elegans)、果蝇 (Drosophila melanogaster)、小鼠(moth)等体内实现,通常是用dsRNA(double-stranded RNA)介导基因沉默作用,dsRNA作为RNAi作用的前导物质,对于干扰作用的发生起着决定性作用[2-4]。以dsRNA为基点研究基因沉默的分子机制成为热点[5]。
在线虫C.elegans中,只需导入少量的dsRNA即可实现高效的RNAi效果,但哺乳动物和果蝇中不存在RNAi的放大机制,即导入dsRNA后产生的RNAi作用不持久,具有瞬时性[6-7]。为了克服此缺点,研究者发展了基于DNA载体在动植物体内表达dsRNA的技术。这种载体可以是质粒,也可以是病毒,甚至可以是DNA片段[8-9]。先在体外构建能表达dsRNA的载体,再将载体转到细胞内合成dsRNA,不但能增加有效转染细胞的种类,而且在长期稳定表达载体的细胞株中,dsRNA能够长期稳定表达,省时省力且高效[10-11]。因此,应用合适的表达载体表达dsRNA,对于采取喂食法和注射法实现的RNAi试验起着至关重要的作用。
由于质粒L4440作为表达载体具有含有双向T7强启动子,载体本身具有氨苄抗性,便于筛选等优点,目前已成功用于多种RNAi试验所需dsRNA的表达[12-13]。在干扰载体构建完成后克隆至大肠杆菌HT115(DE3)中,该菌含有T7 RNA聚合酶基因(λDE3 lysogen),它可在T7启动子的控制下进行基因转录,产生T7 RNA聚合酶。而且该菌有一个rnc基因突变,它是编码特异性降解dsRNA的内切酶RNaseⅢ的基因,有利于dsRNA的生成,这样在IPTG诱导下在E.coli内很容易产生dsRNA,另外,该菌为四环素抗性,转入载体后具有双抗性,便于筛选[14-15]。因此,该表达系统的成功构建,可以快速经济地利用喂食法或注射法RNAi进行生物体某个基因功能的研究。
dsRNA作为RNAi作用的前体分子,在生物体中合适量的dsRNA对RNAi的效果起到了很重要的作用,而大肠杆菌又是用于表达外源基因的较好载体[12]。因此,利用大肠杆菌大量表达RNAi试验所需的dsRNA并进一步优化其表达条件是必要的。笔者利用带有空载质粒L4440及重组质粒LSA3的表达工程菌HT115(DE3),借助正交试验设计优化其表达dsRNA的条件(例如诱导温度、时间等),便于后续的以喂食法或注射法介导的RNAi在靶标生物体内的实现。
1 材料与方法
1.1 载体与菌株 菌株:HT115(DE3),美国斯坦福大学Fire教授赠送(美国国家线虫遗传学研究中心提供)。
质粒L4440:美国斯坦福大学Fire教授赠送(美国麻省Addgene机构提供)。
有外源基因插入的质粒LSA3:在空载质粒L4440中插入甜菜夜蛾(spodoptera exigua)几丁质合成酶A的一段长度为450 bp基因片段,该重构质粒由中山大学有害生物控制与资源利用国家重点实验室提供。
1.2 试剂 蛋白胨(peptone)、酵母粉(yeast extract)购自Oxoid公司产品;氨苄青霉素(ampcillin)、四环素(Tetracycline)购自广州威佳科技有限公司;DNA markerIII购自NEB公司;IPTG购自Merck公司;DEPC购自AMRESCO公司;Trizol购自天根生化科技(北京)有限公司;氯仿、异丙醇、乙醇及其他常用的化学试剂购自广州化学试剂厂。
1.3 试验方法
1.3.1 目的基因在工程菌中的诱导表达。
1.3.1.1 正交试验设计。大肠杆菌经诱导表达外源基因的主要影响因素为诱导时间、诱导温度及诱导剂浓度,采用L9(34)正交试验表(表1)。

表1 正交试验因素水平
1.3.1.2 目的基因的诱导表达。在2块分别含LSA3、L4440质粒的大肠杆菌平板上,用无菌牙签挑取一些白色菌落,分别接种到 3 ml LB液体培养基(含100 μg/ml Amp、12.5 μg/ml Tet)中,37 ℃、250 r/min振荡培养12~14 h,活化。然后以1∶50转接至2×YT培养基中,37℃、250 r/min振荡培养至OD600=0.4左右时,按试验号加入相应浓度IPTG,并根据各试验号所需的条件诱导相应的时间及温度。
1.3.2 菌体RNA的提取及检测。菌体RNA抽提采用传统的Trizol提取法,并在该方法上稍作调整。
RNA质量检测手段包括琼脂糖凝胶电泳检测和分光光度计测定。称取0.2 g Agrose溶于1×TAE缓冲液中,定容至20 ml,制成1%的电泳胶。将5 μl RNA样品与1 μl 6×Loading Buffer充分混合后电泳检测。将2 μl RNA样品与498 μl DEPC水混匀(放大250倍),利用分光光度计检测,记录样品的OD260、OD260/OD280及RNA浓度。
2 结果与分析
2.1 工程菌富集量直观对比 试验组与对照组组间对比:根据3次重复中菌液富集量情况,LSA3组与L4440组菌量无明显差异。试验组与对照组组内对比:直观上看,L4440组与LSA3组都存在一个现象,即25℃培养条件下富集得到的菌量普遍比30℃、37℃这2种培养条件下的菌量少,但30℃与37℃条件下培养所得到的菌液浓度无明显差异。
2.2 菌体RNA的提取及RNA纯度检测 对3次重复所抽提的菌体RNA利用分光光度计检测其纯度,结果显示,3次重复中所抽提的RNA纯度较好,2个组OD260/OD280在1.7~2.00的样品比例都为88.9%,说明样品很少蛋白污染,且没有RNA水解成单核苷酸的现象。
2.3 正交试验结果 由表2可知,3个因素对结果的影响大小依次为A、B、C。即对于大肠肝菌HT115(DE3)生长诱导时间的作用最大,其次是诱导温度,最后是诱导剂IPTG的浓度。
方差分析结果表明,3个因素对于试验结果的影响并不显著,诱导时间对于试验结果有一定影响,而另外2个因素诱导时间与诱导剂浓度对试验结果影响不明显。
最佳组合为A3B2C3,即诱导时间8 h,诱导温度30℃,诱导剂浓度10.0 mmol/L。
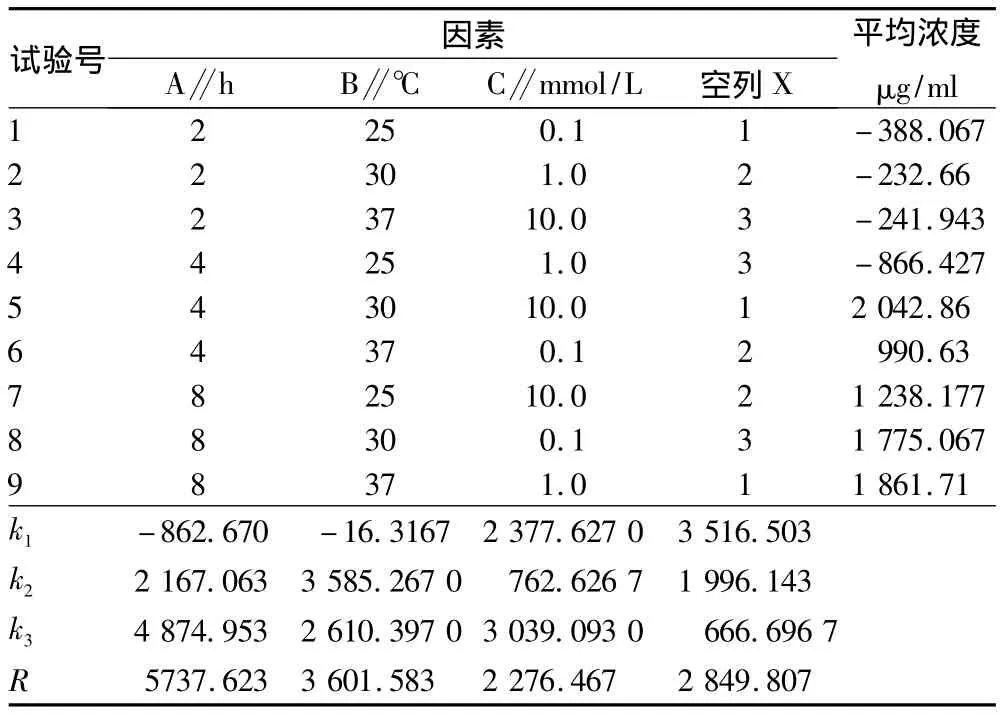
表2 正交试验结果
3 结论与讨论
先在体外构建能表达dsRNA的载体,再将载体转到细胞内合成dsRNA,可保证在细胞株中长期稳定表达dsRNA,有效发挥RNAi阻断基因的效应[15-16]。该试验选用E.coliHT115(DE3)(具有四环素抗性)作为材料,转入含对应目标片段dsRNA的cDNA载体L4440(具有氨苄抗性)后具有双抗性,便于筛选,这在IPTG诱导下在E.coli内很容易产生dsRNA。
大肠肝菌表达外源基因的影响因素很多,该试验选用影响较大的几项:诱导剂IPTG浓度、诱导温度、诱导时间。因为工程菌表达外源基因的条件因基因不同也相应不同,因此设定了这3个影响因素的3个水平以期得到E.coliHT115(DE3)表达目的基因的最优条件。而试验组LSA3收菌量略小于空白对照组L4440,可能的原因是:外源基因的存在对菌体的生长有一定影响。25℃培养条件下富集得到的菌量普遍比30℃、37℃这2种培养温度下的菌量少,但30℃与37℃温度下培养得到的菌量差别不大,造成这一现象可能的原因是工程菌E.coliHT115(DE3)的生长受温度影响较大,25℃并不是其适宜生长温度,其生长最适温度是30~37℃。
正交试验设计是一种解决多因素优化问题的卓有成效的方法[17-20]。该试验采用正交试验设计研究了dsRNA在HT115(DE3)内的最优表达条件。结果表明,最适合工程菌E.coliHT115(DE3)生长并表达dsRNA的最佳组合为A3B2C3,即诱导时间8 h、诱导温度30℃,诱导剂浓度10.0 mmol/L。
[1]FIRE A,XU S Q,MONTGOMERY M K,et al.Potent and specific genetic interference by double-stranded RNA inCaenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[2] GRISHOK A.RNAi mechanisms inCaenorhabditis elegans[J].FEBS Letters,2005,579(26):5932-5939.
[3]徐俊,毛颖,苗荻,等.RNA干扰技术的研究进展[J].生物技术世界,2012,12(3):15-17.
[4]TIMMONS L,FIRE A.Specific interference by ingested dsRNA[J].Nature,1998,395(6705):853-854.
[5]FELLMANN C,LOWE S W.Stable RNA interference rules for silencing
[J].Nat Cell Biol,2014,16(1):8-10.
[6]AHMET M D,HANNON G J.RNAi:An ever-growing puzzle[J].Biochemical Sciences,2003,28(4):196-201.
[7]FIRE A.RNA-triggered gene silencing[J].Trends Genet,1999,15(9):358-363.
[8]RAVI S K,MARTINEZ-CAMPOS M,ZIPPERLEN P,et al.Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA inCaenorhabditis elegans[J].Genome Biology,2000,2(1):1-10.
[9]PHILLIP A N,PETER W R,FRANCESC C,et al.Ingestion of bacterially expressed double-stranded RNA inhibits gene expression in planarians[J].PNAS,2003,100(1):861-865.
[10]颜怀城.RNA干扰的研究进展[J].中国药业,2006,15(16):4-6.
[11]FRASER A G,KAMATH R S.Functional genomic analysis ofC.eleganschromosome I by systematic RNA interference[J].Nature,2000,408(10):325-330.
[12]TIMMONS L,COURT D L,FIRE A.Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference inCaenorhabditis elegans[J].Gene,2001,263(1/2):103-112.
[13]CARTHEW R W.Gene silencing by double-stranded RNA[J].Curr Opin Cell Biol,2001,13(2):244-248.
[14]HAMMOND S M,CAUDY A A.Post-transcriptional gene silencing by double-stranded RNA[J].Nat Rev Genet,2001,2(2):110-119.
[15]TENLLADO F,MARTINEZ-GARCIA B,VARGAS M,et al.Crude extracts of bacterially expressed dsRNA can be used to protect plants against virus infections[J].BMC Biotechnology,2003,3(3):1472-1570.
[16]G·J·汉农.RNAi——基因沉默指南[M].北京:化学工业出版社,2004:1-104.
[17]王怀亮,赵海水.用正交实验法选择制备黄腐酸的最佳条件[J].腐植酸,1999,1(2):28-40.
[18]唐春红,蔡绍皙.一种在生物医学工程科研中有实用价值的实验设计方法-均匀设计与正交实验设计联用的实验设计方法[J].生物医学工程学杂志,2006,23(6):28-31.
[19]李皓,唐新军.逐次正交设计优化法[J].长江科学院院报,1996,9(13):37-39.
[20]杜荣骞.生物统计学[M].北京:高等教育出版社,2003:241-286.

