硫酸钙在高温盐溶液中的溶解度
朱佳兵,钟 辉,刘善东,徐文轩
(成都理工大学材料与化学化工学院,四川 成都 610059)
硫酸钙在高温盐溶液中的溶解度
朱佳兵,钟 辉,刘善东,徐文轩
(成都理工大学材料与化学化工学院,四川 成都 610059)
常压盐溶液法制备α型半水石膏中,硫酸钙的溶解度对产物的结构和形貌有重要影响。采用溶解平衡法测定了不同温度下硫酸钙在不同浓度NaCl单盐溶液中和NaCl-Na2SO4混合盐溶液中的溶解度,并分析了其溶解度的变化规律,以此作为工艺条件的参考。结果表明,硫酸钙溶解度随着盐浓度的增加先增大后减小,在盐浓度为15%左右出现极大值。同离子效应对硫酸钙溶解度的影响大而温度对硫酸钙溶解度的影响较小。
硫酸 钙;高温盐溶液;溶解度
α型半水石膏因其性能优良而广泛应用于新型建筑材料工业、陶瓷工业、精密仪器模具工业。常压盐溶液法是将二水石膏配制成盐溶液体系,在常压下转化生成α型半水石膏。硫酸钙溶解度对产物的形貌有重要影响,从而影响产物的性能。采用常压盐溶液法制备α型半水石膏会导致液相中硫酸钙溶解度的变化[1]。常压盐溶液法制备α型半水石膏工艺中,反应温度在85℃以上,虽然前人对硫酸钙在盐溶液中的溶解度已经做了大量工作[2],但硫酸钙在85℃以上的溶解度报道较少。本研究利用溶解平衡法测定不同温度下硫酸钙在不同浓度NaCl-Na2SO4-H2O体系中的溶解度,掌握原料二水石膏晶体转化过程中液相硫酸钙溶解度的变化规律,有助于优化α型半水石膏生产过程的工艺条件。
1 实验部分
1.1实验药品与仪器
药品:二水硫酸钙(AR),氯化钠(AR),硫酸钠(AR),乙二胺四乙酸二钠(AR),氢氧化钠(AR);去离子水等。
仪器:电热恒温水浴锅,电子天平,滴定装置等。
1.2实验方法
首先配制不同浓度的NaCl-Na2SO4盐溶液,然后向其中加入过量的二水硫酸钙,密封并置于恒温水浴锅中。分别设定不同的水浴温度,保温12h,期间不断摇动,使硫酸钙在溶液中达到溶解平衡。然后在该温度下保温静置0.5h左右,取上清液,用0.45μm的水系膜过滤,用标定好的EDTA溶液滴定滤液中的Ca2+(重复滴定3次取平均值),计算得到硫酸钙(以二水硫酸钙计)的溶解度。
2 结果与讨论
2.1硫酸钙在NaCl溶液中的溶解度变化
测定了不同温度和不同NaCl浓度盐溶液条件下的硫酸钙溶解度,结果如图1所示。
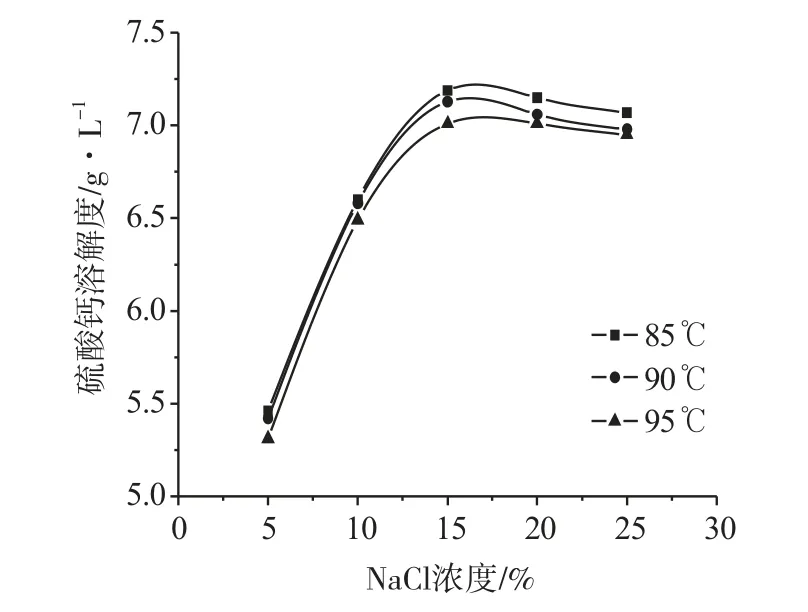
图1 NaCl浓度对硫酸钙溶解度的影响
由图1可知,硫酸钙溶解度随着NaCl浓度的增大,先增大后小幅度减小,在NaCl浓度为15%左右出现极大值,约为7.15g·L-1。温度对硫酸钙溶解度的影响并不明显。NaCl是一种强对称电解质,在NaCl溶液中,硫酸钙的溶解行为可以用德拜-休克尔理论推导。低浓度下,离子强度随着盐浓度增大而增大,活度系数随之减小,因此硫酸钙溶解度增大。高浓度下,硫酸钙形成离子对,短程静电相互作用增强,活度系数随之增大,导致硫酸钙溶解度降低[3]。由于温度对NaCl溶液活度系数影响较小,所以温度对硫酸钙溶解度的影响不明显[4]。
2.2硫酸钙在混合盐溶液中溶解度的变化
测定了不同温度和不同混合盐浓度条件下的硫酸钙溶解度,混合盐为NaCl和Na2SO4,质量比为4∶1,测定结果如图2所示。
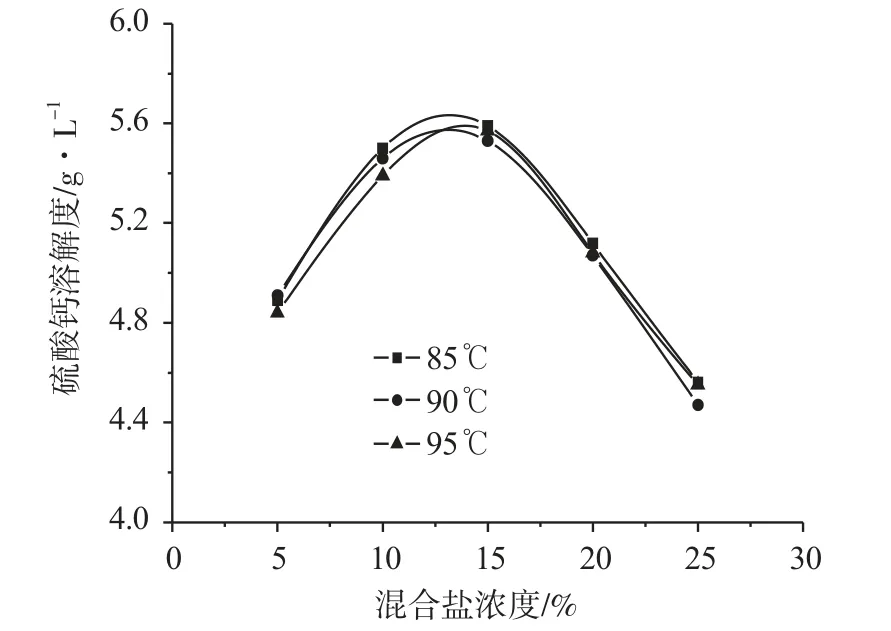
图2 混合盐浓度对硫酸钙溶解度的影响
由图2可知,硫酸钙溶解度随着混合盐浓度的增大先增大后减小,在混合盐浓度为15%左右出现极大值,约为5.55g·L-1。由图3可知,硫酸钙在NaCl溶液中的溶解度大于相同浓度的混合盐溶液。在混合盐溶液中,既存在盐效应又存在SO42-的同离子效应,硫酸钙的溶解度是两者综合作用的结果,随着SO4
2-浓度增大,同离子效应显著增强。

图3 不同体系盐溶液对硫酸钙溶解度的影响
3 结论
1)在NaCl溶液中,硫酸钙溶解度随NaCl浓度增加先增加后降低,在NaCl浓度为15%左右出现极大值,约为7.15g·L-1。
2)在NaCl-Na2SO4混合盐溶液中,硫酸钙的溶解度趋势与在NaCl单盐溶液中相同,随着SO42-浓度增大,同离子效应显著增强。
3)温度对硫酸钙溶解度的影响较小。
[1] 何伟,吴晓琴,刘芳.硫酸钙在Ca-Mg-K-Cl-H2O体系转化过程中溶解度研究[J].环境科学与技术,2010,33(5):35-38.
[2] Wollmann G, Voigt W. Solubility of Gypsum in MSO4Solutions (M=Mg, Mn, Co, Ni, Cu, Zn) at 298.15 K and 313.15 K [J]. J. Chem. Eng. Data, 2008, 53(6): 1375-1380.
[3] 尹忠,等.硫酸钙在盐酸和氯化钠水溶液中的溶解度[J].油田化学,1994,11(4):345-347.
[4] 黄子卿.电解质溶液理论导论[M].北京:科学出版社,1983:118-235.
Solubility of Calcium Sulfate in Hot Salt Solution
ZHU Jia-bing, ZHONG Hui, LIU Shan-dong, XU Wen-xuan
(College of Materials and Chemistry &Chemical Engineering, Chengdu University of Technology, Chengdu 610059, China)
Calcium sulfate dehydrate could transform to calcium sulfate hemihydrate in salt solution at atmospheric pressure. Its structure and morphology were profoundly affected by the solubility of calcium sulfate. The solubility of calcium sulfate in different concentration of NaCl solution and NaCl-Na2SO4mixed solution was determined by dissolved balance method at different temperature. The law of solubility was studied as an important parameter in technological conditions. Experimental results showed that the solubility of calcium sulfate increased fi rstly and then decreased with the increase of the concentration of salt. The solubility appeared a maximum value when the concentration of salt was 15%. The same ion effect had a signifi cant effect however the effect of temperature was small.
calcium sulfate; hot salt solution; solubility
O 614.23+1
A
1671-9905(2015)12-0013-02
2015-10-16

