鸡传染性法氏囊病血清抗体间接ELISA检测方法的建立
张 华,南文龙,巩明霞,张悦勇,3,彭大新,陈义平
(1. 中国动物卫生与流行病学中心,山东青岛 266032;
2. 扬州大学兽医学院,农业部畜禽传染病重点开放实验室,江苏扬州 225009;3.青岛农业大学,山东青岛 266109)
鸡传染性法氏囊病血清抗体间接ELISA检测方法的建立
张华1,2,南文龙1,巩明霞1,张悦勇1,3,彭大新2,陈义平1
(1. 中国动物卫生与流行病学中心,山东青岛266032;
2. 扬州大学兽医学院,农业部畜禽传染病重点开放实验室,江苏扬州225009;3.青岛农业大学,山东青岛266109)
为建立可检测鸡传染性法氏囊病血清抗体的间接ELISA检测方法,本研究经RT-PCR扩增IBDV VP2(1nt-708nt)基因片段,并应用pET28a载体进行原核表达,亲和层析纯化重组蛋白作为包被抗原,建立检测IBDV血清抗体的间接ELISA方法。应用所建方法和IDEXX试剂盒,对采自不同地区的156份鸡血清样品进行平行检测和比较。结果表明,RT-PCR扩增获得708bp的VP2基因片段;含重组表达质粒pET28a-VP2的大肠杆菌BL21经IPTG诱导后,表达了约27kDa的VP2重组蛋白,表达量约占菌体蛋白的30.1%;建立的间接ELISA检测方法与IDEXX试剂盒比较,其特异性、敏感性和符合率分别达到90.24%、95.65%和94.23%。由此可见,本研究所建立的间接ELISA方法敏感、特异,适用于IBDV血清抗体的检测。
传染性法氏囊病;VP2;原核表达;间接ELISA
传染性法氏囊病(infectious bursal disease,IBD)是由传染性法氏囊病毒(IBDV)引起的鸡的一种急性高度接触性传染病[1]。IBDV主要侵害法氏囊B淋巴细胞,导致免疫损伤,并诱发多种疫病以及疫苗免疫失败[2]。准确诊断和监测是防控该病的关键,IBDV血清抗体检测方法主要有琼脂扩散和ELISA方法。琼脂扩散试验存在灵敏度较低、耗时长并且无法实现高通量检测等缺陷。ELISA方法特异、敏感,并可实现高通量检测,是IBDV血清抗体理想的检测方法[3]。
VP2是IBDV的主要结构蛋白,是构成病毒衣壳的主要成分,也是主要的宿主保护性抗原[4]。VP2基因全长约为1.4kb,有关研究显示VP2蛋白的212~214和248~252 位氨基酸的两个亲水区分别与IBDV抗原结构的稳定性和毒力大小有关[5]。本研究拟对VP2基因上半段进行原核表达,并以纯化的重组蛋白作为检测用抗原,建立检测IBDV血清抗体的间接ELISA方法。
1 材料
1.1毒株及血清样品
IBDV B87株及其阳性血清由青岛易邦生物工程有限公司提供;H5、H7、H9亚型禽流感病毒阳性血清、新城疫病毒阳性血清均由本室免疫SPF鸡制备;SPF鸡血清为本室采集保存;156份临床鸡血清样品采自山东和江苏的部分鸡场(其中121份经IBDV疫苗免疫,35份未免IBDV疫苗 )。
1.2主要试剂
Taq DNA聚合酶、AMV逆转录酶、内切酶、病毒RNA提取试剂盒、pMD18-T克隆载体购自大连宝生物(TaKaRa)公司;pET-28a表达载体购自Life公司;Ni SepharoseTM 6 Fast Flow购自GE Healthcare公司;山羊抗鸡IgG-HRP购自美国BETHYL公司;酶标板购自美国康宁公司。
2 方法
2.1IBDV VP2基因扩增
按试剂盒说明方法,提取IBDV B87株基因组RNA,Oligo(dt)常规方法逆转录获得cDNA模板。根据GeneBenk发表的IBDV VP2全基因序列,设计一对引物,P1:5'-TCGAATTCATGACAAACCTGCAAGATC-3';P2:5'-GCTCTCGAGGGCATCGATATTAGCTG-3',其中引物P1和P2的5'端分别引入EcoR I和Xho I酶切位点,扩增VP2基因1nt~708nt位置基因片段。引物由大连宝生物公司合成。反应条件:94℃预变性4min;94℃变性40s,57℃退火40s,72℃延伸75s,共30个循环;72℃延伸10min。PCR 反应结束后用1.5%琼脂糖凝胶电泳分析结果,PCR 产物送宝生物工程(大连)有限公司测序。
2.2重组表达质粒的构建
回收VP2目的基因,连接pMD18-T载体,构建阳性克隆质粒pMD18-T-VP2。EcoR I、Xho I双酶切pMD18-T-VP2和pET-28a载体,连接VP2基因与pET-28a载体,构建重组表达质粒pET-28a-VP2[6]。
2.3重组蛋白的表达及纯化
将重组表达质粒pET-28a-VP2转化至大肠杆菌BL21中,以终浓度为1mg/mL的IPTG 37℃诱导表达5h,12%SDS-PAGE凝胶电泳分析表达产物。常规方法回收包涵体蛋白,并经镍柱亲和层析法纯化,Qubit 2.0仪器测定重组蛋白浓度,Westernblot分析重组蛋白的免疫反应性。
2.4间接ELISA方法的建立及条件优化
以纯化的VP2重组蛋白作为包被抗原,用0.05 M pH 9.6的碳酸盐包被缓冲液进行倍比稀释(浓度范围8000ng/mL~250ng/mL),每孔加入100μL,4℃包被过夜。同时,将SPF鸡阴性血清和IBDV阳性血清分别进行50倍、100倍、200倍和400倍稀释,羊抗鸡IgG-HRP酶标二抗按1∶5000稀释,进行方阵测定,确定抗原最佳包被浓度和血清最佳稀释度。然后再对各反应时间以及酶标二抗工作浓度等条件逐一优化。
2.5交叉反应的检测
用建立好的间接ELISA检测方法对H5、H7、H9亚型禽流感病毒阳性血清以及新城疫病毒阳性血清进行检测,观察是否发生交叉反应。
2.6血清样品检测
用建立的间接ELISA方法检测156份鸡血清样品,并用美国IDEXX公司的IBDV抗体ELISA检测试剂盒平行检测,比较分析检测结果。
3 结果与分析
3.1IBDV VP2基因的扩增结果
IBDV VP2基因的RT-PCR扩增结果如图1,扩增获得708bp的VP2基因片段。
3.2重组克隆和表达质粒的双酶切鉴定
将构建的重组克隆质粒pMD18-T-VP2和表达质粒pET-28a-VP2经EcoR I和Xho I双酶切,鉴定结果分别如图2和图3,两者经酶切均出现VP2目的基因条带和载体条带,大小同预期一致。
3.3IBDV VP2蛋白的表达以及抗原性分析
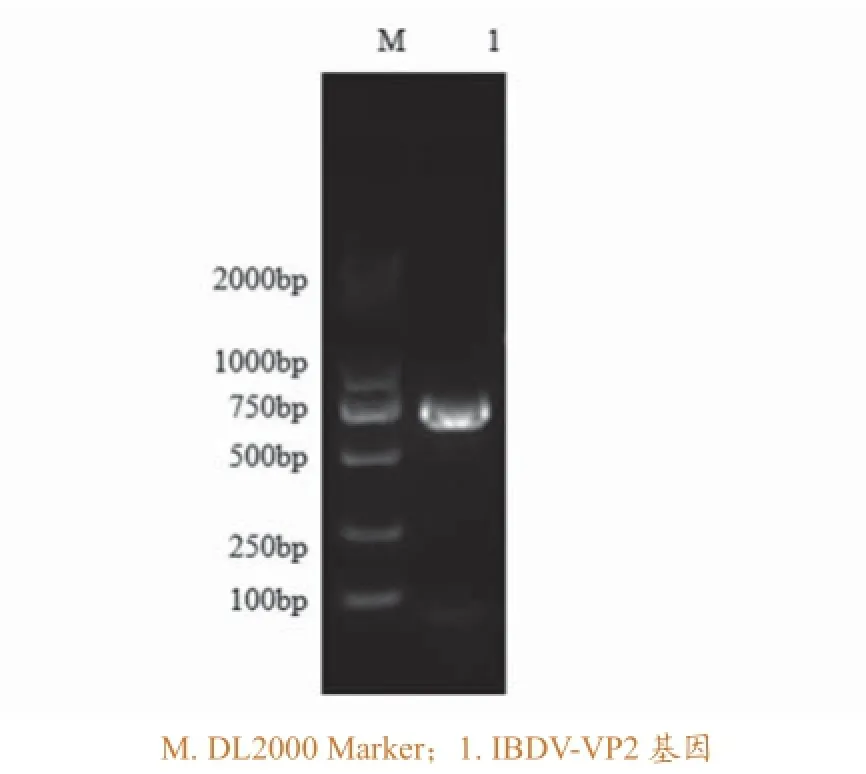
图1 IBDV VP2基因RT-PCR 扩增结果
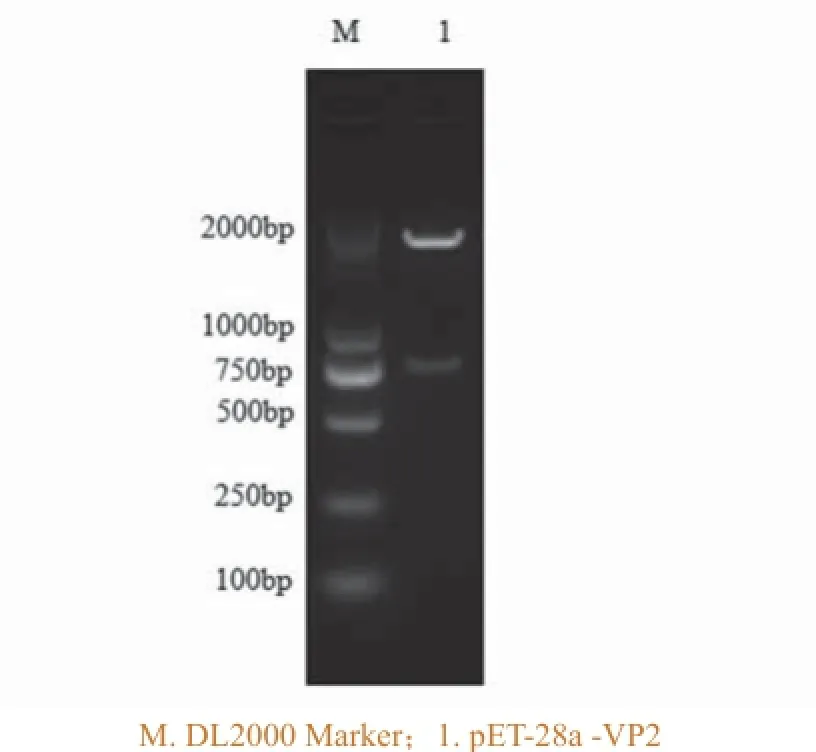
图2 克隆载体pMD18-T-VP2双酶切鉴定结果
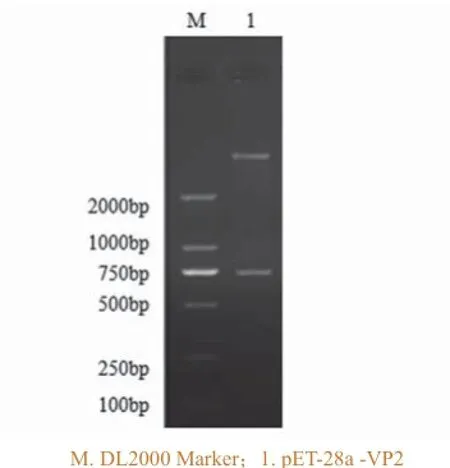
图3 表达载体pET-28a -VP2双酶切鉴定结果
用BandScan软件对SDS-PAGE结果(图4)进行分析,结果表明在约27kDa处出现VP2重组蛋白表达,表达量约占大肠杆菌的30.1%。经Qubit 2.0测定,纯化后的VP2重组蛋白浓度为2.5mg/mL。Western-blot结果(图5)显示,VP2重组蛋白能与IBDV阳性血清发生特异性反应,表达的VP2 蛋白具有良好的免疫反应性。
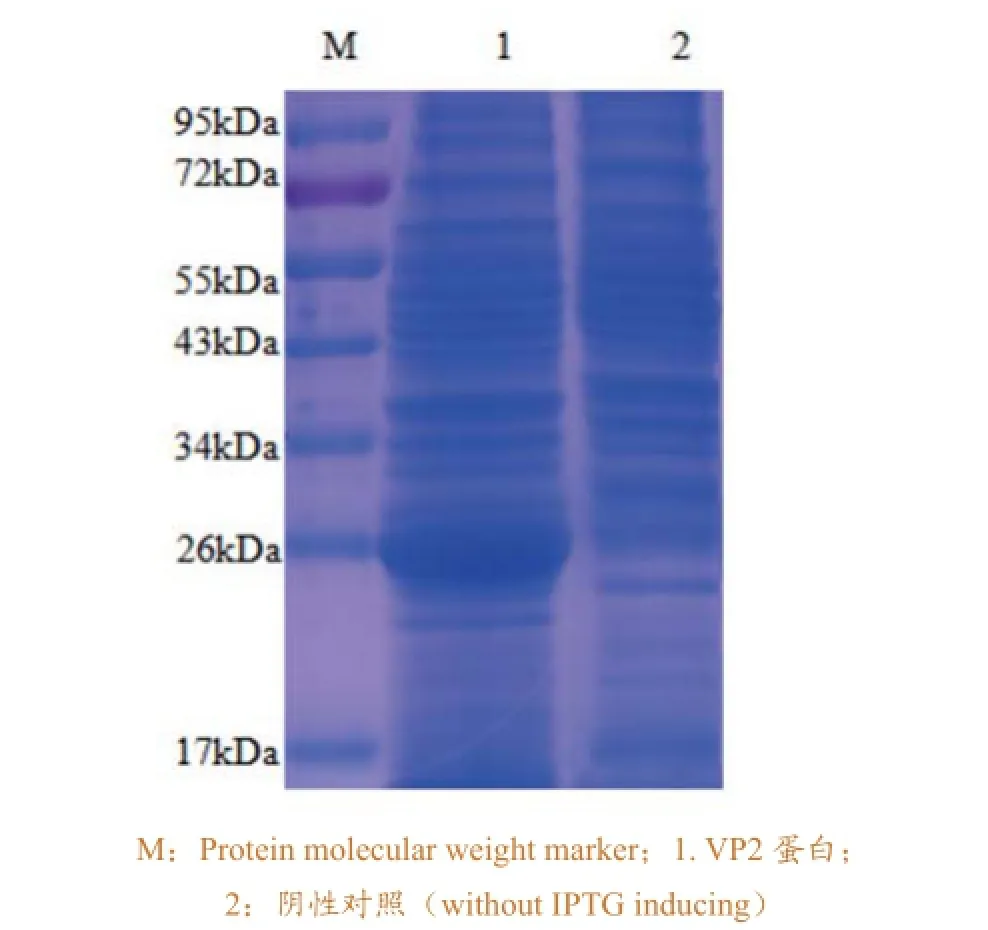
图4 重组蛋白的SDS-PAGE 分析结果
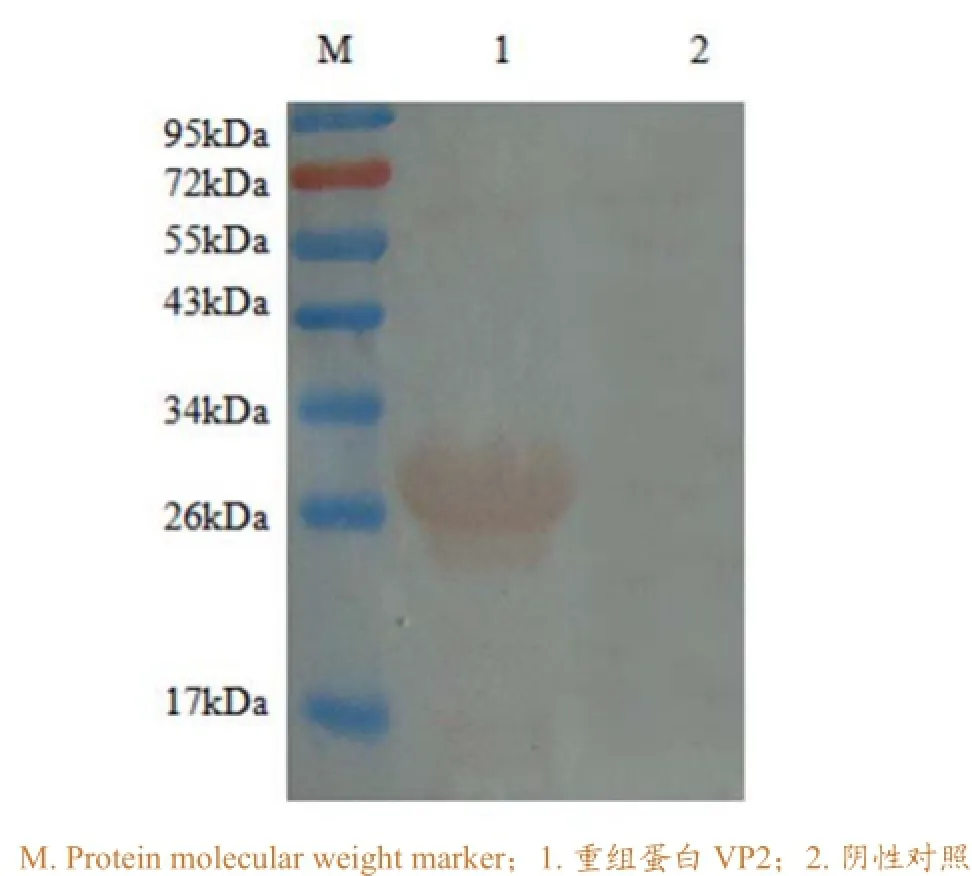
图5 重组蛋白Western-blot鉴定结果
3.4检测IBDV血清抗体间接ELISA方法的建立方阵试验结果见图6,当抗原工作浓度为250ng/ mL和血清50倍稀释时,P/N值虽然较大,但由于此时抗原浓度较小,所有样品OD值总体偏低,会影响本方法的灵敏度。当抗原工作浓度为1000ng/ mL和血清100倍稀释时,P/N值较为理想,易于分辨阴、阳性结果,选择作为抗原最佳包被浓度和血清最佳稀释度。
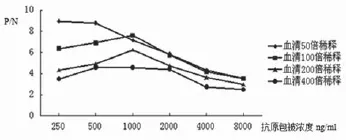
图6 方阵试验结果
进一步对反应时间及酶标二抗工作浓度等条件进行优化,最终确定的ELISA反应程序:将纯化的VP2 重组蛋白用用0.05mol/L pH 9.6的碳酸盐包被缓冲液稀释至1000ng/mL,100 μL/孔包被酶标板,4℃包被过夜;PBST洗涤3 次,然后每孔加300μL 2% BSA封闭液,37℃封闭2h;PBST洗涤3次,分别加入100倍稀释的待检血清、阳性对照血清(2 个)和阴性对照血清(2个),每孔100μL,37℃孵育30min;PBST洗涤3 次,再每孔加入100μL 2500 倍稀释的山羊抗鸡IgGHRP,37℃孵育30 min;PBST洗涤3次,每孔加入100μL新配置的TMB显色液,37℃显色10 min;最后,每孔加入50μL 2mol/L H2SO4终止反应。测定OD450值。分别计算出阳性对照平均值ODP和阴性对照平均值ODN,待检血清样品OD450>0.6×ODP+0.4×ODN判定为阳性;待检样品OD450 ≤0.6×ODP+0.4×ODN判定为阴性。
3.5交叉反应的检测
交叉反应检测结果显示,H5亚型禽流感病毒阳性血清、H7亚型禽流感病毒阳性血清、H9亚型禽流感病毒和新城疫病毒阳性血清经检测均为阴性,表明所建立的间接ELISA方法与禽流感、新城疫等常见病毒病阳性血清无交叉反应。
3.6156份鸡血清样品检测结果
利用所建立的间接ELISA方法(VP2-ELISA)与IDEXX ELISA检测试剂盒平行检测156份临床血清样品(表1)。VP2-ELISA检测出114份阳性和42份阴性;IDEXX ELISA试剂盒检测出115份阳性和41份阴性。但是,在IDEXX ELISA试剂盒检测为阴性的41份样品中,有4份样品VP2-ELISA检测为阳性;在IDEXX ELISA试剂盒检测为阳性的115份样品中,有5份样品VP2-ELISA检测为阴性。与IDEXX ELISA试剂盒相比, VP2-ELISA方法的特异性、敏感性和符合率分别为90.24%(37/41)、95.65%(110/115)和 94.23%(147/156)。
4 讨论
Marquardt[6]于1980年首次将ELISA检测技术应用到IBD的诊断中,并成功地从临床鸡血清样品中检测出IBDV特异性抗体。2010年,Niraj[7]等将大肠杆菌中表达的IBDV VP3蛋白和酵母菌中表达的VP2蛋白以及疫苗株全病毒抗原进行包板,分别建立了检测IBD血清抗体的间接ELISA方法:VP3-ELISA 、VP2-ELISA和W-ELISA,比较发现VP3-ELISA和VP2-ELISA检测结果相似,而W-ELISA的特异性和敏感性相对较差。其中,VP2-ELISA与病毒中和试验相比,其符合率、特异性和敏感性达到95%、95.9%和96.1%,效果与IDEXX ELISA试剂盒相当。国内也有相关的研究报道,马秀丽等[8]建立了全病毒作为检测抗原建立了间接ELISA方法,与进口试剂盒相比,符合率达到86.7%;宋军等[9]也报道了VP2间接ELISA方法,并证明该方法具有良好的特异性。为了提高表达量及获得理想的检测效果,研究过程中我们曾分段表达了VP2基因,包括上半段(1nt-708nt)、下半段(652nt-1353nt)和全长(1nt-1353nt)。结果显示,VP2上半段基因基因表达效果较好。而且,我们还将VP2上半段基因、下半段基因以及全基因重组蛋白均作为检测抗原,包被酶标板,比较了三者ELISA方法的检测效果。结果表明,应用VP2上半段基因建立的ELISA方法,检测时阴性样品背景值较低,阳性样品OD值较高,P/N值大,更易于阴、阳性结果的分辨。因此,本研究最终选择以VP2上半段基因重组蛋白作为检测抗原,优化建立了检测IBDV血清抗体的间接ELISA方法。与IDEXX ELISA试剂盒相比,本方法符合率94.23%、特异性90.24%、敏感性95.65%,检测效果较为理想,可用于临床IBDV血清抗体的检测。
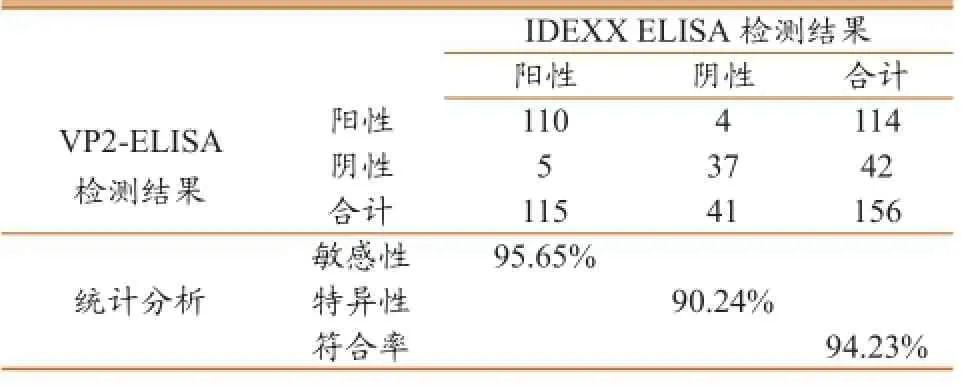
表1 VP2-ELISA和INDEXX ELISA试剂盒检测结果比较
[1] Hair-Bejo M,Ng M K,Ng H.Y. Day Old Vaccination Against Infectious Bursal Disease in Broiler Chickens[J]. International Journal of Poultry Science,2004,3(2):124-128.
[2] Martínez-Torrecuadrada J L,Lázaro B,Rodriguez J F,et al. VPX and VP3 Infectious Bursal Disease Virus Proteins Potential of Baculovirus-Expressed Antigenic Properties and Diagnostic[J]. Clinical and Vaccine Immunology,2000,7(4):645- 651.
[3] 陈义平,邓珣,彭长凌,等.PRRSV血清抗体间接ELISA检测方法的建立[J].扬州大学学报,2006,27(4):1-4.
[4] Zanetti F A,Del Médico Zajac M P,Taboga O A,et al. Evaluation of modifi ed vaccinia virus Ankara expressing VP2 protein of infectious bursal disease virus as an immunogen in chickens[J]. Journal of Veterinary Science,2012, 13(2):199-201.
[5] Bayliss C D,Spies U,Shaw K,et a1. A comparison of segment A of four infectious bursal disease virus strains and identification of a variable region in VP2 [J]. Journal of General Virology,1990,71(6):1303-1312.
[6] 周洁,陈义平,楚电峰,等.猪细小病毒结构蛋白VP2主要抗原表位区基因的克隆及原核表达[J].中国动物检疫,2009,26(2):42-44.
[7] Singh N K,Dey S,Madhan Mohan C, et al. Evaluation of four enzyme linked immunosorbent assays for the detection of antibodies to infectious bursal disease in chickens[J]. Journal of Virological Methods,2010,65(2):277-282.
[8] 马秀丽,崔言顺,张秀美,等.鸡传染性法氏囊病间接ELISA诊断试剂盒的研制及初步应用[J].中国兽医学报,2003,23(5):424-426.
[9] 宋军,黄成斌,单雪芹,等.传染性法氏囊病毒VP2蛋白的表达及间接ELlSA抗体检测方法的建立[J]. 安徽农业大学学报,2011,38(4):633-636.
(责任编辑:胡藕祥)
Development of an Indirect ELISA for the Detection of Antibodies against Infectious Bursal Disease Virus in Chickens
Zhang Hua1,2,Nan Wenlong1,Gong Mingxia1,Zhang Yueyong1,3,Peng Daxin2,Chen Yiping1
(1.China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Key Laboratory of Animal Infectious Diseases, Ministry of Agriculture,College of Veterinary Medicine,Yangzhou University,Yangzhou,Jiangsu 225009;3. Qingdao Agricultural University,Qingdao,Shangdong 266109)
In order to develop an indirect ELISA for the detection of antibodies against IBDV, VP2 gene(1nt~708nt)was amplifi ed by RT-PCR and expressed using the pET-28a vector in Escherichia coli BL21. The recombinant protein was purifi ed through Ni-chelating affi nity chromatography and based on it,an indirect ELISA was developed. To verify the performance of this assay, 156 clinical serum samples were detected by the assay and IDEXX ELISA kit in parallel. The results showed that VP2 gene was successfully amplifi ed by RT-PCR and expressed in E.coli BL21 with IPTG induction. Compared to IDEXX ELISA kit, the specifi city,sensitivity,and coincidence rate of the developed indirect ELISA were 90.24%,95.65% and 94.23% respectively.The results demonstrated the assay was sensitive and specifi c,and could be used to detect antibodies against IBDV in chicken sera.
IBDV;VP2;prokaryotic expression;indirect ELISA
S852.65+7
A
1005-944X(2015)09-0072-05
陈义平

