超声波辅助提取对麦胚蛋白性质的影响研究
孙艳平,任宇鹏
(河南化工职业学院,河南郑州450042)
超声波辅助提取对麦胚蛋白性质的影响研究
孙艳平,任宇鹏
(河南化工职业学院,河南郑州450042)
研究超声波预处理对麦胚蛋白提取率、纯度、结构和功能特性的影响。结果表明超声波对分离蛋白提取率有一定影响,超声功率为80 W时,提取率最高达到了75.88%。超声功率为140 W时,麦胚蛋白的纯度最高为94.12%。超声波改变了蛋白质二级结构,超声140 W处理时蛋白表面疏水性最强。超声波处理降低了蛋白起泡性,增强了起泡稳定性;蛋白质乳化性随超声波功率增加先降低后升高,乳化稳定性都有所下降。
超声波;麦胚蛋白;纯度;乳化性
小麦胚蛋白是从小麦加工的副产品——小麦胚中提取出来的一种新型蛋白质资源。小麦胚的蛋白质含量为30%左右,仅次于大豆,分别是大米、小麦粉的4.9倍和3.2倍,是瘦牛肉、瘦猪肉及鸡蛋的1.5倍、1.8倍和2.1倍。麦胚蛋白氨基酸的构成比例与FAO/WHO颁布的模式值以及大豆、牛肉、鸡蛋的氨基酸构成比例基本接近,其必需氨基酸构成种类齐全,比例合适,数量充足,是一种完全蛋白质,被营养学家誉为“人类天然的营养宝库”[1]。
关于麦胚蛋白的提取工艺已有相关报道。杨立树[2]利用正交试验确定麦胚蛋白碱性提取的最佳工艺条件,其蛋白质得率为66.7%。辛志红等[3]采用碱溶酸沉与淀粉酶复合法,用淀粉酶水解麦胚蛋白提取液中的淀粉,使麦胚蛋白含量和得率均较碱溶酸沉法明显提高,分别达到94.5%和81.36%。吴素萍[4]应用微波加热辅助碱提取麦胚蛋白质,在最优条件下得到麦胚蛋白的提取率为71.1%。从文献报道可知不同研究得出的结果均有所差异。本文拟通过超声波辅助碱提酸沉法提取麦胚蛋白,并对麦胚蛋白的部分结构和性质进行了研究。
1材料和方法
1.1材料与仪器
小麦胚芽[水分:(12.80±0.03)%,粗脂肪:(9.07± 0.03)%,粗蛋白:(24.83±1.80)%]:市售;其他试剂均为分析纯。
722型可见光分光光度计:上海精密科学仪器有限公司;FA2104N分析天平:上海菁海仪器有限公司;TG-16型高速离心机:巩义市予华仪器有限责任公司;FJ200-S高速分散均质机:上海恒磁电子科技有限公司;970CRT荧光分光光度计:上海精密科学仪器有限公司;T650CTZ多功能恒温超声提取机:上海比郎仪器有限公司。
1.2实验方法
1.2.1碱溶酸沉法制备麦胚分离蛋白工艺路线
麦胚→筛选→脱脂→粉碎→加水→调节pH→超声波处理→振荡碱提→离心→调节pH→静置→离心→真空冷冻干燥
1.2.2不同的超声波功率对分离蛋白提取率和纯度的影响
称取预处理过的脱脂麦胚粉50 g,放入1 000 mL的烧杯中,加水750 mL,用玻璃棒搅拌均匀,调节pH至9.5,放入超声波清洗器中,分别用0、80、140、200 W,处理20 min。摇匀转入锥形瓶中,用保鲜膜密封,放入50℃的恒温水浴振荡器中振荡1 h。冷却至室温后,以4 000 r/min的转速离心分离10 min。将上清液转移至1 000 mL烧杯中,调节pH至4.0,静置30 min,以4 000 r/min的转速离心分离10 min。将上述沉淀物转移至1 000 mL烧杯中,然后用组织捣碎机粉碎,用量筒量取蛋白液体积,均匀取40 mL于三角瓶中密封冷藏(取10 mL蛋白液用凯氏定氮法测定得率,每份样品做两个平行样,取平均值。)剩余蛋白液,以4 000 r/min的转速离心分离10 min。将沉淀物转移至真空冷冻干燥盘中干燥。

1.2.3碱溶pH对蛋白提取率、分离蛋白提取率和纯度的影响
称取预处理过的脱脂麦胚粉50 g,放入1 000 mL的烧杯中,加水750 mL,用玻璃棒搅拌均匀,分别将pH调节至9.5、10.0、10.5和11.0,使用超声波处理。摇匀转入锥形瓶中,用保鲜膜密封,放入50℃的恒温水浴振荡器中振荡1 h。冷却至室温后,以4 000 r/min的转速离心分离10 min。将上清液转移至1 000 mL烧杯中,调节pH至4.0,静置30 min,以4 000 r/min的转速离心分离10 min。将沉淀物转移至1 000 mL烧杯中,然后用组织捣碎机粉碎,用量筒量取蛋白液体积,用小量筒均匀取40 mL,测水分,每份样品做两个平行样,取平均值。均匀取上述干燥物0.12g,用凯氏定氮法测定得率和纯度,每份样品做两个平行样,取平均值。
2.2.4蛋白质荧光光谱测定
参考赵冠里[5]测定内源荧光光谱的方法,有所改动。先配制pH9.0的硼酸-硼砂缓冲液,通过加NaOH,pH调至9.5,用pH计测定。准确称取原料0.10 g,溶解于pH9.5缓冲溶液中,用pH9.5缓冲溶液定容到100 mL,配制成1 mg/mL溶液。用荧光分光光度计,测激发光285 nm,发射波长范围285 nm~900 nm光谱。
1.2.5蛋白质表面疏水性测定
参考王辰[6]测定表面疏水性的方法,有所改动。先配制pH9.0的硼酸-硼砂缓冲液,通过加NaOH,pH调至9.5,用pH计测定。称取0.120 g ANS,用pH9.5缓冲溶液定容为50 mL。准确称取原料0.10g,溶解于pH9.5缓冲溶液中,用pH9.5缓冲溶液定容到100 mL,配制成1 mg/mL溶液。然后每个样分别配成0.2、0.4、0.6、0.8、1.0 mg/mL溶液。吸取溶液5 mL于比色皿中,在激发波长390 nm,发射波长470 nm条件下,测强度。然后每个样加入50 μL ANS混匀,再测荧光强度。
1.2.6起泡性及泡沫稳定性
在室温条件下,准确称量0.5 g干燥的蛋白样品溶于100 mL,pH9.0硼砂—硼酸缓冲液中,配制成0.5%的蛋白溶液。静置30 min使蛋白样品充分浸润。取20 mL用FJ200-S数显高速分散均质机以18 000 r/min搅拌2 min,转移到量筒测定泡沫体积,按下式计算:

式中:V0为蛋白溶液搅拌前的体积,mL;Vt为搅拌停止时泡沫及液体的体积,mL。
泡沫稳定性的测定:将上述发泡性测定后的泡沫静置,经过10 min静置后的泡沫总体积Vt。泡沫稳定性是通过测定搅打停止后,不同时刻的泡沫体积占刚搅打结束时泡沫体积的百分数来进行反映(将0时刻的泡沫体积记为100%)。
1.2.7乳化活性及乳化稳定性
参考Chelulei[7]测定蛋白质乳化活性的方法,有所改动。称取一定量的蛋白样品溶于pH为9.0的硼砂-硼酸缓冲液中,配置浓度为0.2%的蛋白质溶液。取30 mL该溶液加入10 mL大豆色拉油,室温条件下,用FJ200-S数显高速分散均质机以18 000 r/min下均质1 min,用微量注射器迅速从底部吸取乳化液50 μL稀释于装有5 mL的0.1%SDS溶液的比色管中,以0.1% SDS溶液为空白参比,立即用分光光度计在500 nm下测定吸光值(A0),10 min后再取样测吸光值(A10)。乳化活性(EA)用吸光值表示。乳化稳定性按照下式计算:
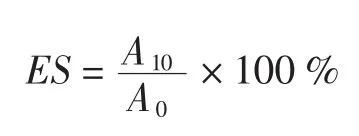
式中:A0为搅打后立即测定的吸光值;A10为10 min后测定的吸光值。
1.2.8数据处理
试验结果最少测2次,试验结果以平均值±标准偏差表示。
2结果与讨论
2.1不同超声波功率对麦胚蛋白提取率的影响
超声波功率对酸沉蛋白提取率的影响见表1。

表1 不同超声波功率对酸沉蛋白提取率的影响Table 1Effect of different ultrasonic power for protein extraction rate of acid precipitation
由表1可知,超声波对蛋白质提取率有一定影响,在80 W时提取率达到了75.88%。随着功率的增加,蛋白提取率有所下降。这有可能是超声功率的增加改变了蛋白质的溶解性所致。
2.2不同超声波功率对分离蛋白纯度的影响
超声波功率对分离蛋白纯度的影响见图1。

图1 不同超声波功率对分离蛋白纯度的影响Fig.1Effect of ultrasonic power on the purity of isolated proteins
由图1可知,超声波功率140 W时,分离蛋白的纯度最高,达到了94.12%。说明使用一定功率的超声波处理可使麦胚中非蛋白成分的溶解性降低,相应提高麦胚蛋白纯度,但同时麦胚蛋白的提取率也较低(见表1)。
2.3不同超声波功率对蛋白质结构影响
2.3.1超声波预处理提取的分离蛋白荧光光谱
超声对分离蛋白荧光光谱的影响见表2和图2。

表2 不同超声波功率对分离蛋白质荧光发射光谱最大发射峰峰位置影响Table 2Ultrasonic power emission maximum peak position of influence on the separation of protein fluorescence emission spectra

图2 超声波功率对分离蛋白主峰强度影响Fig.2Effect of ultrasonic power protein isolate peak intensity
由表2和图2可以看出,超声波处理基本没有改变蛋白溶液的荧光最大发射峰峰位,但强度发生了较大变化。在80 W时,荧光强度上升,原因是蛋白分子经过一定强度和时间的超声处理后,其分子伸展,暴露出不同的生色基团,从而荧光强度增强。在140 W时,荧光强度降低,是因为超声波处理强度过大或时间过长,蛋白质发生荧光猝灭现象。在200 W时,荧光强度增强,可能是由于蛋白分子伸展,生色基团暴露。
2.3.2不同超声功率提取蛋白质的表面疏水性
超声功率对提取蛋白的表面疏水性影响见图3。

图3 不同超声波功率对分离蛋白质表面疏水性影响Fig.3Different ultrasonic power on the separation of protein surface hydrophobicity
由图3可以看出,在超声波作用下,蛋白质表面疏水性发生了改变,蛋白质表面疏水性提高,表明其分子伸展,暴露出疏水基,然而超声强度过大或时间过长,则蛋白会发生卷曲、折叠,又会使原本已经外露的疏水基团内包于蛋白分子内部,疏水性降低。
2.4不同超声波功率对麦胚蛋白起泡性和起泡稳定性的影响
超声波功率对麦胚蛋白起泡性和起泡稳定性的影响见图4。
由图4可以看出,超声波处理后的分离蛋白的起泡性都有所下降,起泡稳定性都有所上升。这可能与超声波改变了蛋白质结构有关,导致蛋白质溶解性、黏度和分子间相互作用发生了变化。
2.5不同超声波功率对分离蛋白乳化性和乳化稳定性的影响
超声波功率对分离蛋白乳化性和乳化稳定性的影响见图5。
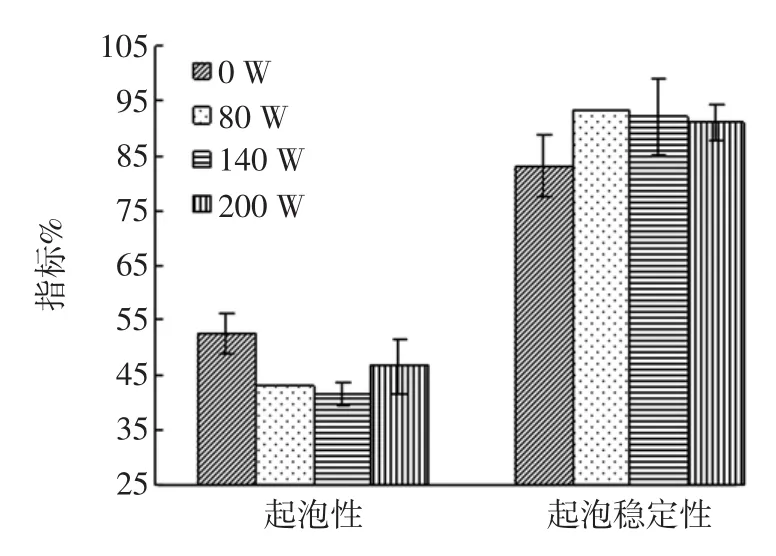
图4 不同超声波功率对分离蛋白起泡性和起泡稳定性的影响Fig.4Ultrasonic power influence on the separation of different protein foaming and foaming stability

图5 不同超声波功率对分离蛋白乳化稳定性和乳化稳定性的影响Fig.5Influence of ultrasonic power on the separation of different protein emulsion stability and emulsion stability
由图5可以看出,乳化性在超声波作用下先降低后升高,乳化稳定性都有所下降,在140 W时最低。这可能与超声波作用于蛋白质结构有关,不同功率下使蛋白质亲水基团或疏水基团发生暴露、卷曲或折叠所致。而在140 W时,表面疏水性最高(图3),表明蛋白质乳化性与疏水性并不是正相关。
3结论
超声波处理对麦胚蛋白提取率有一定影响,超声功率为80 W时,提取率最高达到了75.88%。超声功率为140 W时,麦胚蛋白的纯度最高为94.12%。超声140 W处理时得到蛋白表面疏水性最强。超声波处理降低了蛋白起泡性,增强了起泡稳定性;蛋白质乳化性随超声波功率增加先降低后升高,乳化稳定性都有所下降。
[1]连彩霞,朱科学,周惠明.小麦胚芽的研究进展[J].粮食加工,2009,34(9):50-53
[2]朱建华,钟瑞敏,邹秀容.超声波辅助酶法提取碎米中蛋白的研究[J].食品研究与开发,2014,35(11):15-19
[3]辛志红,吴守一,马海乐,等.淀粉酶法制备小麦胚芽蛋白的研究[J].食品科技,2003(6):11-13
[4]张晓云,谢玲燕,季明敏,等.超声波辅助碱法提取芡实蛋白工艺[J].食品研究与开发,2012,33(11):96-99
[5]赵冠里.酶解与多糖接枝改性花生蛋白及其构效机理研究[D].广州:华南理工大学,2011:15-40
[6]王辰,江连洲,魏冬旭等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学,2012,33(9):54-57
[7]Chelulei CS,王璋,许时婴.大孔吸附树脂提取苦味乳清蛋白水解物及其功能性质和生物活性的研究[J].食品科学,2006,27(8): 103-107
Study on the Effect of Ultrasound-assisted Extraction on the Properties of Wheat Germ Protein
SUN Yan-ping,REN Yu-peng
(Henan Vocational College of Chemical Technology,Zhengzhou 450042,Henan,China)
The ultrasonic-assist extraction of wheat germ protein was studied,including the protein yield,purity,structural and functional properties.The results showed that ultrasonic had certain influence to the extraction yield of protein.When ultrasonic power was 80 W,extraction rate reached 75.88%.When the ultrasonic power was 140 W,the purity of wheat germ protein was as high as 94.12%.Ultrasound changed protein secondary structure.When the ultrasonic power was 140 W the protein surface hydrophobicity was the strongest.Ultrasonic treatment reduced the protein foaming ability,but enhanced the foam stability.Protein emulsifying activity rised with the increase of ultrasonic power but emulsifying stability was reduced.
ultrasonic;wheat germ protein;purity;emulsifying activity
10.3969/j.issn.1005-6521.2015.16.016
2014-11-13
孙艳平(1977—),女(汉),讲师,硕士,主要从事化工工艺研究与产品开发。

