大米镉结合蛋白的分离及理化特性
刘珊珊,陈季旺,2,*,陈 露,丁文平,2,吴永宁,3
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中 心,湖北 武汉 430023;3.国家食品安全风 险评估中心,北京 100021)
大米镉结合蛋白的分离及理化特性
刘珊珊1,陈季旺1,2,*,陈露1,丁文平1,2,吴永宁1,3
(1.武汉轻工大学食品科学与工程学院,湖北 武汉430023;2.农产品加工湖北省协同创新中 心,湖北 武汉430023;3.国家食品安全风 险评估中心,北京100021)
本实验选用一种镉含量较高的大米为原料,采用碱法提取大米蛋白(alkali-extractable protein,AP),依次用热变性和乙醇沉淀分离AP,制备大米镉结合蛋白(rice Cd-binding protein,RCBP),并分析了RCBP的紫外吸收特征、氨基酸组成、分子质量及二级结构。结果显示:AP、热变性蛋白(thermally denaturated protein,TP)和乙醇沉淀蛋白(ethanol-precipitated protein,EP)均在210 nm波长处有最大吸收峰,氨基酸组成类似;热变性去除了分子质量为94 kD的蛋白质,分子质量为5 094 kD的蛋白质含量减少,乙醇沉淀进一步减少了分子质量分别为50 kD和14 kD的蛋白质。AP的二级结构主要为α-螺旋和β-转角,有少量β-折叠;TP的二级结构只含有β-折叠和β-转角,且以β-折叠为主;EP的二级结构主要为β-折叠和β-转角,还含有少量α-螺旋和无规卷曲。表明热变性和乙醇沉淀使得AP中的镉结合蛋白得到分离,可以作为一种分离RCBP的方法。
大米镉结合蛋白;热变性;乙醇沉淀;理化性质
镉(Cd)具有极大的毒性和致突变性,为环境污染物,由于其易在人体内蓄积且半衰期长达10~30 a,已被美国毒物管理委员会列为第6位危及人类健康的有毒物质[1]。镉污染的食物、水、空气,经消化道和呼吸道进入人体并积累,引起慢性中毒,引起肾机能衰退、骨质疏松[2]。镉的生物有效性[3-5]及在生物体的暴露与积累[6-7]等已受到国内外的普遍关注。大米作为我国大部分地区主要主食之一,应作为重点监测对象,需严格控制其镉含量[8]。因此,研究大米中重金属镉具有重要意义。
国内外对金属镉与不同来源的蛋白质结合形成的镉结合蛋白[9-14]已有很多研究,大部分研究集中于含有丰富的巯基、能螯合大量金属离子[15]的金属硫蛋白。特别是有关海洋动物[16-19]、昆虫[20]、小鼠[21]以及植物亚麻籽[22]等中的金属硫蛋白的报道较多,其研究方法已比较成熟。但有关大米镉结合蛋白(rice Cd-binding protein,RCBP)的研究报道较少。杨居荣等[23]对污染区稻、麦籽实中镉的存在形态进行了相关分析,指出在稻、麦籽实主要营养成分中,以镉与蛋白质相结合的形态为主,同时镉更易与这2 种谷物的球蛋白和清蛋白结合。该研究只报道了镉分布位置,尚未明确分析镉与大米蛋白的结合机制及镉结合蛋白的理化性质。为了研究RCBP的相关理化性质及结合机理,首先需要研究一套提取分离RCBP的方法。并且,有关RCBP分离、理化性质及形成机理等的研究还未见报道,因此研究RCBP的分离及理化性质具有现实意义。
本实验选用一种镉含量较高的大米为原料,采用碱法提取大米蛋白(alkali-extractable protein,AP)、热变性和乙醇沉淀依次分离AP制备RCBP,并分析RCBP的紫外吸收特征、氨基酸组成、分子质量分布及二级结构,初步判断大米镉结合蛋白的类型,为进一步研究RCBP的形成机理奠定基础。
1 材料与方法
1.1材料与试剂
籼米X9(镉含量157 μg/kg,蛋白质含量6.86 g/100 g,水分含量14.55 g/100 g,以湿质量计)购于武汉市武商量贩常青花园店。
镉标准储备液国家有色金属及电子材料分析测试中心;β-巯基乙醇成都科龙化工试剂厂;蛋白质分子质量标准品武汉楚诚正茂科技工程有限公司;十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfonate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶配制试剂盒武汉市碧云天生物科技研究所;硝酸、双氧水、硫酸、三羟甲基氨基甲 烷(Tris)、SDS、溴酚蓝、考马斯亮蓝R-250、无水乙醇国药集团化学试剂有限公司;硝酸、硫酸、高氯酸为优级纯,其余试剂均为分析纯。
1.2仪器与设备
TAS-990原子吸收分光光谱仪(配GFH-990石墨炉)、镉空心阴极灯北京普析通用仪器有限公司;DELTA 320 pH计梅特勒-托利多仪器(上海)有限公司;RE-52C 型旋转蒸发仪巩义市英峪予华仪器厂;SHB-Ⅲ循环水式多用真空泵郑州长城科工贸公司;TGL-16C高速离心机上海安亭科学仪器有限公司;PerkinElmer Lambda 25紫外可见分光光度计美国珀金埃尔默公司;Bio-Rad Mini-PROTEAN-3电泳仪(配电泳槽)美国Bio-rad公司;NEXUS 670型傅里叶变换红外光谱仪美国尼高力仪器公司。
1.3方法
1.3.1碱法提取大米蛋白
参考陈季旺等[24]的方法并加以改进。大米样品经超微粉碎机粉碎,过80 目筛。称取20 g大米粉于500 mL的烧杯中,加入120 mL 质量分数1%的NaOH溶液,搅拌混匀,常温浸提1 h,然后用质量分数1%的NaOH调pH值至11,40 ℃磁力搅拌水浴锅中浸提2 h(搅拌速率为120 r/min),提取液4 000 r/min离心10 min,得上清液(AP)100 mL。
1.3.2RCBP分离
参考徐振彪等[25]提取玉米金属硫蛋白的方法。取100 mL AP于100 ℃水浴加热5 min,4 ℃、7 000 r/min离心15 min,弃去沉淀,得到上清液即热变性蛋白(thermally denaturated protein,TP);TP中加入3 倍体积预冷的无水乙醇,搅拌混匀后置于-20 ℃过夜沉淀,4 ℃ 7 000 r/min离心15 min,弃去沉淀,40 ℃条件下旋转蒸发上清液除去变性剂乙醇,得乙醇沉淀蛋白(ethanolprecipitated protein,EP)。
1.3.3镉含量测定
参考袁秀金等[8]的方法。将1 g待测大米和样品(AP、TP、EP)经硝酸、过氧化氢和3~5 滴硫酸消化后用石墨炉原子吸收分光光谱仪测定其中镉的含量。
1.3.4蛋白质含量测定
采用GB5009.5—2010《食品中蛋白质的测定》中的半微量凯氏定氮法,转换系数F为5.95。
1.3.5RCBP紫外扫描
采用硼砂-氢氧化钠缓冲溶液(pH 10)配制质量浓度为1 mg/mL的AP、TP、EP各1 mL,备用。开机预热10 min,扫描的波长范围为190~450 nm,以硼砂-氢氧化钠缓冲溶液(pH 10)为空白校正液,加入样品,关上暗箱,点击“扫描”;扫描完成后,加入下一个样品。
1.3.6氨基酸组成分析
分别量取一定体积的AP、TP、EP(相当于1 g大米)于玻璃试管中,加入15 mL 6 mol/L HCl,试管抽真空,充氮气封管,置于108 ℃恒温干燥箱内水解24 h,待冷却后,过滤,定容至100 mL,吸取滤液20 μL于40 ℃真空干燥器中进行干燥,用0.2 mol/L HCl定容至1 mL。采用氨基酸分析仪测定各样品中氨基酸含量。
1.3.7SDS-PAGE分析
取蛋白质质量浓度均为6.78 mg/mL的AP、TP、EP各80 μL分别于1.5 mL离心管中,加入5×SDS的上样缓冲液20 μL,混匀,沸水浴10 min。采用质量分数12%分离胶、质量分数5%浓缩胶、1×Tris-甘氨酸电泳缓冲液(pH 8.3),将10 μL样品注入样品池,电压先调到60 V,40 min后改为110 V,待指示剂溴酚蓝跑至胶边缘时停止电泳。剥胶,用0.1%考马斯亮蓝R-250染色4 h,用10%醋酸-5%乙醇洗脱液脱色,直至蛋白条带清晰[26]。
1.3.8傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)分析
参考Ferreira等[27]的方法并加以改进。用脱脂棉蘸取无水酒精将研钵、镊子、压片等用具擦试干净,放在红外灯下照射以使酒精快速挥发干燥。在研钵中加入适量KBr粉末,按照约1∶100的质量比例加入样品,充分研磨混匀,压片,压片尽量薄而透明,以保证较高的透光率。用傅里叶变换红外光谱仪测定红外吸收光谱图,以KBr粉末作为空白背景,设定分辨率4 cm-1,扫描次数为16 次,进行全波长(4 000~500 cm-1)扫描。
2 结果与分析
2.1AP、TP、EP中蛋白质和镉含量及损失率
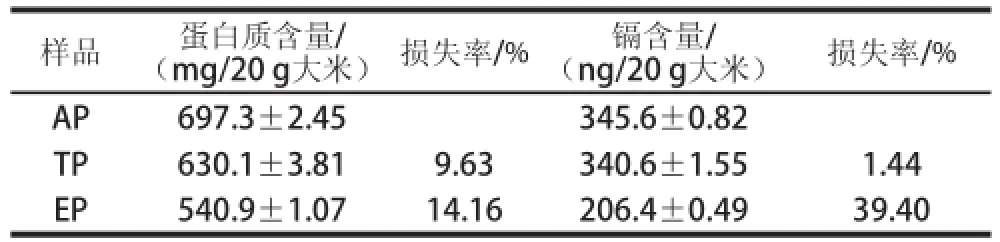
表1 AP、TP和EP中蛋白质和镉含量及损失率Table 1 Contents of protein and Cd, and loss rates of AP, TP, and EP
由表1可知,碱法提取的AP依次进行加热变性、乙醇沉淀处理后,TP、EP中的蛋白质和镉含量均逐渐减少,但减少的幅度不同。热变性处理后蛋白质损失率为9.63%,镉损失仅有1.44%,说明热变性去除了不耐热的杂蛋白,使得目标蛋白的纯度得到初步提高;另外,高速离心过程也能起到去除一些非蛋白类物质(如少量不溶性淀粉等)。TP经乙醇沉淀后蛋白质损失14.16%,镉则损失39.40%,这可能是由于乙醇沉淀去除杂蛋白的同时对镉结合蛋白的结构也有一定的破坏,使得部分镉从镉结合蛋白上脱落,造成较大程度的损失,但大部分镉(60.6%)仍存在于EP中。因此,采用热变性和乙醇沉淀依次分离碱法提取AP中的结合蛋白,能实现镉结合蛋白的富集,可以作为分离RCBP的一种方法。
2.2AP、TP、EP中蛋白溶液的紫外扫描图
对AP、TP、EP溶液进行紫外扫描实验,观察3 种蛋白质在紫外光区光吸收值的变化,结果见图1。扫描AP、TP、EP溶液得到的吸收峰均分布在200~220 nm之间,其中,AP在210 nm波长左右吸收峰最高,TP、EP峰值依次降低,峰型依次变弱。这与2.1节中蛋白质含量逐渐降低的结果一致,进一步说明依次热变性和乙醇沉淀去除了AP中的杂蛋白,镉结合蛋白得到了分离。
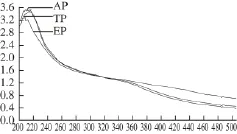
图1 AP、TP和EP的紫外光谱扫描曲线Fig.1 UV ab sorption spectra of AP, TP and EP
2.3氨基酸组成分析结果
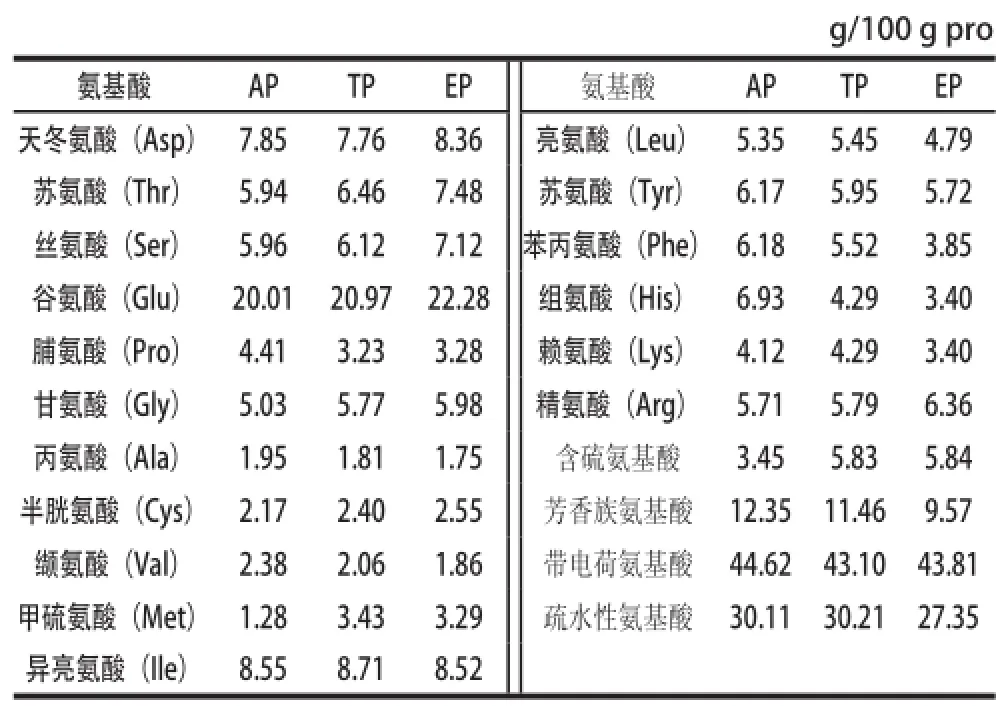
表2 AP、TP和EP的氨基酸组成Table 2 Amino acid composition of AP, TP and EP
由表2可知,与AP相比,TP中甘氨酸、丝氨酸、甲硫氨酸、半胱氨酸、苏氨酸、亮氨酸、异亮氨酸、赖氨酸、精氨酸和谷氨酸含量增加,而苯丙氨酸、丙氨酸、缬氨酸、酪氨酸、组氨酸和脯氨酸含量减少,含硫氨基酸含量增加2.38 g/100 g pro,芳香族氨基酸含量减少0.89 g/100 g pro,带电荷氨基酸含量减少1.52 g/100 g pro,疏水性氨基酸含量增加0.10%;与TP相比,EP中天冬氨酸、丙氨酸、苏氨酸、丝氨酸、脯氨酸、甘氨酸、精氨酸、谷氨酸、半胱氨酸含量增加,苯丙氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸、酪氨酸、赖氨酸、组氨酸、甲硫氨酸含量减少。含硫氨基酸含量增加0.01 g/100 g pro,芳香族氨基酸含量减少1.89 g/100 g pro,带电荷氨基酸含量增加0.71 g/100 g pro,疏水性氨基酸含量减少2.86 g/100 g pro;与AP相比,EP中含硫氨基酸含量增加2.39 g/100 g pro,芳香族氨基酸含量减少2.78 g/100 g pro,带电荷氨基酸含量减少0.81 g/100 g pro,疏水性氨基酸含量减少2.76 g/100 g pro。由表2还可知,AP、TP、EP带电荷氨基酸含量最高,大于43 g/100 g pro,疏水性氨基酸次之,约为30 g/100 g pro,芳香族氨基酸为10 g/100 g pro左右,含硫氨基酸约占5 g/100 g pro。
AP经热变性和乙醇沉淀处理后,半胱氨酸和甲硫氨酸含量有少许增加,但含量很低(2%)。然而,AP、TP、EP中带电荷氨基酸和疏水性氨基酸含量均较高,初步推断RCBP可能是一类富含带电荷氨基酸或疏水性氨基酸的镉结合蛋白。
2.4SDS-PAGE分析结果
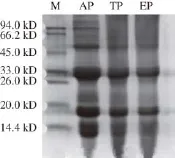
图2 AP、TP和EP的SDS-PAGEE图谱Fig.2 SDS-PAGE patterns of AP, TP and EP
由图2可知,AP的分子质量分布在94、50、32、16 、14 kD处,TP的分子质量分布在50、32、16 、14 kD处,EP的分子质量分布在32 kD和16 kD处。从AP、TP到EP,蛋白质条带数量逐渐减少、条带颜色变浅,热变性去除了分子质量为94 kD的蛋白质、减少了分子质量为50 kD的蛋白质,乙醇沉淀进一步去除了部分分子质量为50 kD和14 kD的蛋白质。EP中只有2 个条带,可能是2 种不同分子质量的蛋白质或1 种含有两个亚基的蛋白质。
由于大米中清蛋白和球蛋白的分子质量较低,因此,推断镉是与大米中低分子质量的清蛋白或球蛋白结合形成镉结合蛋白,这与杨居荣等[23]的结果类似。
2.5FTIR分析结果
采用FTIR分析AP、TP、EP的二级结构,结果见图3。采用软件Omnic 8.0对FTIR光谱图去卷积处理,再用软件Peakfit v4.1对去卷积曲线进行拟合、积分,得拟合峰面积,结果见表3。

图3 AP、TP、EP傅里叶变换红外光谱Fig.3 FTIR spectra of AP, TP and EP
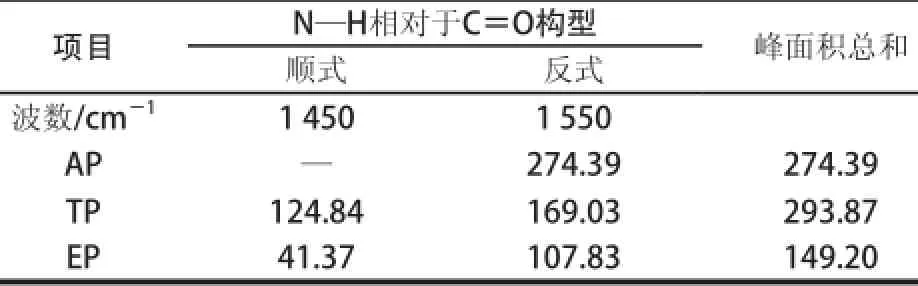
表3 AP、TP和EP中N—H相对于C=O构型峰面积Table 3 Peak area of N-H relative to C=O in AP, TP and EP from FTIR spectra
由表3及图3可知,AP在波数1 545.31 cm-1处有吸收峰,峰面积为274.39;TP在波数1 555.00 cm-1及1 446.95 cm-1处有吸收峰,峰面积分别为169.03和124.84;EP在波数1 560.96 cm-1及1 440.51 cm-1处有吸收峰,峰面积分别为107.83和41.37。AP中N—H相对于C=O只以反式构型形式存在,TP和EP中N—H相对于C=O主要以反式构型形式存在,且TP中N—H相对于C=O反式构型和顺式构型的含量均高于EP。说明热变性使得AP中部分N—H相对于C=O的反式构型转变成顺式构型,乙醇沉淀则破坏了TP中部分N—H相对于C=O构型。

表4 AP、TP、EP在不同红外光谱波数区间的二级结构峰面积Table 4 Peak areas of secondary structures of AP, TP and EP from FTIR spectra tra
采用软件Omnic 8.0对FTIR光谱图去卷积处理,再用软件Peakfit v4.1对去卷积曲线进行拟合、积分,得二级结构的峰面积见表4。AP中α-螺旋的峰面积为326.36,β-折叠的峰面积为99.28,β-转角的峰面积为224.35;TP中β-折叠的峰面积为192.31,β-转角的峰面积为99.94;EP中α-螺旋的峰面积为32.28,β-折叠的峰面积为234.76,β-转角的峰面积为298.93,无规卷曲的峰面积为44.96。说明AP的二级结构以α-螺旋和β-转角为主,还含有少量β-折叠;T P的二级结构只含有β-折叠和β-转角,且以β-折叠为主;EP的二级结构则以β-折叠和β-转角为主,还含有少量α-螺旋和无规卷曲。
与AP相比,TP中的α-螺旋和β-转角含量减少,β-折叠增加;与TP相比,EP中α-螺旋、β-折叠和β-转角含量均增加,其中β-转角含量增加最多,另有少量的无规卷曲形成。因此,热变性破坏了部分α-螺旋,增加了β-折叠,即热变性使部分α-螺旋转变成β-折叠,这与Xie Ling等[28]研究热变性 影响葡萄球菌核酸酶结构的结论类似;α-螺旋和β-折叠是蛋白质中具有高度稳定性的二级结构,是2 种有序的蛋白质二级结构;而β-转角和无规卷曲则是2 种无序的蛋白质二级结构[29],乙醇沉淀使得TP中某些被热变性破坏的二级结构重新形成,但形成的主要是不稳定的无序的二级结构。
3 结 论
采用热变性和乙醇沉淀去除了AP中的大部分杂蛋白及非蛋白物质,达到了富集镉结合蛋白的目的,可以作为分离RCBP的一种方法。
经热变性和乙醇沉淀分离得到的RCBP可能是一类富含带电荷氨基酸或疏水性氨基酸的镉结合蛋白,分子质量主要分布在32 kD和16 kD左右。
热变性使AP中部分α-螺旋转变成β-折叠,而乙醇沉淀使得TP中某些 被热变性破坏的二级结构重新形成,但形成的主要是不稳定的无序的二级结构。
[1]李学鹏, 段青源, 励建荣. 我国贝类产品中重金属镉的危害及污染分析[J]. 食品科学, 2010, 31(17): 457-461.
[2]叶瑞洪, 陈孝堪. 食品中镉的测定方法研究[J]. 福建师大福清分校学报, 2009(2): 21-25.
[3]PHILIP G R, RUFUS L C. Bioavailability as an issue in risk assessment and management of food cadmium: a review[J]. Science of the Total Environment, 2008, 398(1/3): 13-19.
[4]李裕, 张强, 王润元, 等. 镉的致癌性与食品中镉的生物有效性[J].生命科学, 2010, 22(2): 179-184.
[5]李裕, 张强, 王润元, 等. 食品中镉的生物有效性与影响因素[C]// 第27届中国气象学会年会干旱半干旱区地气相互作用分会场论文集.北京: 中国气象学会. 2010.
[6]HALLENBECK W H. Human health effects of exposure to cadmium[J]. Experientia, 1984, 40(2): 136-142.
[7]HISPARD F, de VAUFLEURY A, MARTIN H, et al. Effects of subchronic digestive exposure to organic or inorganic cadmium on biomarkers in rat tissues[J]. Ecotoxicology and Environmental Safety,2008, 70(3): 490-498.
[8]袁秀金, 黄宏志, 罗勇, 等. 湿式消解法石墨炉原子吸收光谱法测定大米中镉含量[J]. 广东农业科学, 2010, 37(8): 240-241.
[9]MARIJANA E, ANDERS R, KRISTIAN I, et al. Cadmium accumulation and Cd-binding proteins in marine invertebrates: a radiotracer study[J]. Chemosphere, 2005, 61(11): 1651-1664.
[10] SERRA R, CARPENE E, MARCANTONIO A C, et al. Cadmium accumulation and Cd-binding proteins in the bivalve Scapharca inaequivalvis[J]. Comparative Biochemistry and Physiology. Part C:Pharmacology, Toxicology and Endocrinology, 1995, 111(2): 165-174.
[11] PEDERSEN S A, KRISTIANSEN E, ANDERSEN R A, et al. Cadmium is deposited in the gut content of larvae of the beetle Tenebrio molitor and involves a Cd-binding protein of the low cysteine type[J]. Comparative Biochemistry and Physiology. Part C: Pharmacology, Toxicology and Endocrinology, 2008, 148(3): 217-222.
[12] PEDERSEN S A, KRISTIANSEN E, ANDERSEN R A, et al. Isolation and preliminary characterization of a Cd-binding protein from tenebrio molitor (Coleoptera)[J]. Comparative Biochemistry and Physiology. Part C: Pharmacology, Toxicology and Endocrinology,2007, 145(3): 457-463.
[13] NEJMEDDINE A, SAUTIERE P, DHAINAUT-COURTOIS N, et al. Isolation and characterization of a Cd-Binding prorein from Allolobophor caliginoas (Annelida, Oligochaeta) distinction from merallothioneins[J]. Comparative Biochemistry and Physiology. Part C: Pharmacology,Toxicology and Endocrinology, 1992, 101(3): 601-605.
[14] HIDALGO J, TORT L, FLOS R. Cd-, Zn-, Cu-binding protein in the elasmobranch Scyliorhinus canicula[J]. Comparative Biochemistry and Physiology. Part C:Pharmacology, Toxicology and Endocrinology,1985, 81(1): 159-165.
[15] 赵新民, 江冠群, 龙立平, 等. 金属硫蛋白[M]. 长沙: 中南大学出版社, 2006: 26-52.
[16] BERNTSSEN M H G, ASPHOLM O ., HYLLAND K, et al. Tissue metallothionein, apoptosis and cell proliferation responses in Atlantic salmon (Salmo salar L.) parr fed elevated dietary cadmium[J]. Comparative Biochemistry and Physiology. Part C: Pharmacology,Toxicology and Endocrinology, 2001, 128: 229-310.
[17] SCHUWERACK P M M, LEWIS J W, JONES P, et al. The dynamics of protein and metal metabolism in acclimated and Cdexposed freshwater crabs (Potamonautes warreni)[J]. Ecotoxicology Environmental Safety, 2009, 72(4): 1220-1227.
[18] CHAFFAI A H, COSSON R P, TRIQUET C A, et al. Physicochemical forms of storage of metals (Cd, Cu and Zn) and metallothionein-like proteins in gills and liver of marine fish from the Tunisian coast ecotoxicological consequences[J]. Comparative Biochemistry and Physiology. Part C: Pharmacology, Toxicology and Endocrinology, 1995, 2: 329-341.
[19] LIU Fengjie, WANG Wenxiong. Metallothionein-like proteins turnover, Cd and Zn biokinetics in the dietary Cd-exposed scallop Chlamys nobilis[J]. Aquatic Toxicology, 2011, 105(3/4): 361-368.
[20] HENSHERGEN P J, van VELZEN M J M, NUGROHO R A, et al. Metallothionein-bound cadmium in the gut of the insect Orchesella cincta (Collembola) in relation to dietary cadmium exposure[J]. Comparative Biochemistry and Physiology. Part C: Pharmacology,Toxicology and Endocrinology, 2000, 125(1): 17-24.
[21] WINGE D R RAJAGOPALAN K V. Purification and some properties of Cd-binding protein from rat liver[J]. Archives of Biochemistry and Biophysics, 1972, 153(2): 755-762.
[22] OOMAH B D, BEREKOFF B, LI-CHAN E C Y, et al. Cadmiumbinding protein components of flaxseed influence of cultivar and location[J]. Food Chemistry, 2007, 100(1): 318-325.
[23] 杨居荣, 何孟常, 查燕, 等. 稻、麦籽实中Cd的结合形态[J]. 中国环境科学, 2000, 20(5): 404-408.
[24] 陈季旺, 孙庆杰, 夏文水, 等. 碱酶两步法制备大米蛋白的研究[J].农业工程学报, 2006, 22(5): 169-172.
[25] 徐振彪, 王平翠, 孙永乐, 等. 植物金属硫蛋白的提取及检测[J]. 山东农业大学学报: 自然科学版, 2010, 41(1): 87-88.
[26] 尚宏丽, 孟鑫, 张挺. 薏米蛋白提取及其SDS-PAGE电泳分析[J]. 中国农学通报, 2012, 28(18): 260-265.
[27] FERREIRA C O, NUNES C A, DELGADILLO I, et al. Characterization of chitosan-whey protein films at acid pH[J]. Food Research International, 2009, 42(7): 807-813.
[28] XIE Ling, JING Guozhong, ZHOU Junmei. Reversible thermal denaturation of staphylococcal nuclease: a fourier transformed infrared spectrum study[J]. Archives of Biochemistryand Biophysics, 1996,328(1): 122-128.
[29] 蔡联辉, 曾虹燕, 蔡西玲, 等. 莲子蛋白组分二级结构的研究[J]. 光谱学与光谱分析, 2011, 31(9): 2394-2398.
Separation and Physicochemical Characteristics of Cd-Binding Protein in Rice
LIU Shanshan1, CHEN Jiwang1,2,*, CHEN Lu1, DING Wenping1,2, WU Yongning1,3
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan430023, China;2. Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan430023, China;3. China National Center for Food Safety Risk Assessment, Beijing100021, China)
Rice Cd-binding protein (RCBP) was obtained from high-Cd rice using alkali extraction, thermal denaturation and ethanol precipitation. Physicochemical characteristics including UV absorbance, amino acid composition, molecular weight and secondary structures were investigated. The results showed that all the alkali-extractable protein (AP), thermally denaturated protein (TP) and ethanol-precipitated protein (EP) had the maximum absorption peak at 210 nm and similar amino acid composition. The 94-kD protein was completely removed and the 5 094-kD protein was decreased by the thermal denaturation. Moreover, the ethanol precipitation resulted in a further reduction of the 50-kD and 14-kD proteins. The major secondary structures of AP were α-helical and β-turn, while β-sheet and β-turn were found in TP. On the other hand, β-sheet and β-turn were predominant in EP. These results indicated that thermal denaturation and ethanol precipitation could be used to separate RCBP from AP.
rice Cd-binding protein; thermal denaturation; ethanol precipitation; physicochemical characteristic
TS254.4
A
1002-6630(2015)23-0100-05
10.7506/spkx1002-6630-201523019
2015-04-02
粮食公益性行业科研专项(201513006);武汉轻工大学重大项目培育专项(2011Z05);武汉市国际合作项目(201231234466);湖北省自然科学基金项目(2014CFB888);武汉轻工大学研究生创新基金项目(2012cx012;2013cx011)
刘珊珊(1988—),女,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:ashleyss@163.com
陈季旺(1970—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jiwangchen1970@126.com

