霍山石斛不同提取物抗小鼠亚急性酒精性肝损伤活性的比较研究
孟海涛,汪 鹤,查学强,潘利华,罗建平*
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
霍山石斛不同提取物抗小鼠亚急性酒精性肝损伤活性的比较研究
孟海涛,汪鹤,查学强,潘利华,罗建平*
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
目的:比较霍山石斛不同提取物抗小鼠亚急性酒精性肝损伤的活性。方法:制备霍山石斛冷冻干燥物、水提物、水提醇溶物、水提醇沉物、水提粗多糖5 种提取物;以连续灌胃30%乙醇的小鼠为亚急性酒精性肝损伤模型,以霍山石斛不同提取物连续灌胃30 d后,称量小鼠体质量及肝质量,测定血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)活性,以及总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量,同时测定肝脏中乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)活性,丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)水平,并检查肝组织损伤病理变化。结果:霍山石斛水提醇溶物抗亚急性酒精性肝损伤的活性最差,醇沉物、水提物、冷冻干燥物具有一定的肝损伤保护活性,水提粗多糖各个剂量组均可显著改善肝脏组织损伤和脂肪变性(P<0.05),降低血清ALT、AST、ALP活性和LDL-C、TC、TG水平,提高血清HDL-C含量,增强肝组织ADH、ALDH、SOD、GSH-Px活性,减少肝组织GSH损耗并抑制肝组织MDA含量增加。结论:多糖是霍山石斛抗小鼠亚急性酒精性肝损伤的功能因子。
霍山石斛;提取物;亚急性酒精性肝损伤
随着人们生活水平的提高,酒精消耗量逐年攀升,酒精性肝损伤已成为仅次于肝炎病毒导致肝损伤的第二大病因[1-2],对酒精性肝损伤的防治直接关系到人类和社会的健康安全[3]。霍山石斛(Dendrobium huoshanense)作为一种可食用的滋补植物[4],近年来已被证明具有抗CCl4致小鼠肝损伤以及亚硒酸钠致大鼠肝损伤的作用[5-6],但霍山石斛对酒精性肝损伤是否也具有保护作用还没有报道。本实验依据国家食品药品监督管理局颁布的《对化学性肝损伤有辅助保护功能评价方法(修订稿)》[7],以亚急性酒精性肝损伤小鼠为实验动物模型,对霍山石斛不同提取物抗亚急性酒精性肝损伤的作用进行对比研究,以期明确霍山石斛干预酒精性肝损伤的功能因子,为以霍山石斛为原料开发抗酒精性肝损伤的功能食品提供理论基础。
1 材料与方法
1.1动物、材料与试剂
SPF级昆明种小鼠,体质量(20±2) g,购于安徽医科大学动物实验中心。
霍山石斛鲜品由本实验室提供。
谷胱甘肽(glutathione,GSH)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒 南京建成生物工程研究所;二甲基亚砜(dimethyl sulfoxide,DMSO)、二乙氨基乙基纤维素(diethylaminoethyl cellulose,DEAE) 美国Sigma公司;水飞蓟素胶囊 德国马博士公司;烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+) 合肥Bios harp公司;鱼藤酮 北京Solarbio公司;其他试剂均为分析纯。
1.2仪器与设备
Hei-VAP Advantage旋转蒸发仪 德国Heidolph公司;7072自动生化分析仪 日本日立高新技术公司;CT15RT高速冷冻离心机 上海天美科学仪器有限公司;LBJ-18S原位真空冷冻干燥机 北京松源华兴科技发展有限公司;XSZ-3G普通光学显微镜 重庆广电仪器有限公司;Varioskan Flash酶标仪 美国Thermo Fisher公司。
1.3方法
1.3.1霍山石斛不同提取物制备
取新鲜霍山石斛真空冷冻干燥48 h得干燥物(样品A)。取样品A干粉按1∶60(m/V)料液比加入蒸馏水,75 ℃搅拌浸提4 h,8 000 r/min离心10 min,得到上清液和沉淀,将上清液减压浓缩、真空冷冻干燥得水提物(样品B)。取样品B用蒸馏水溶解,经终体积分数80%乙醇沉淀24 h,8 000 r/min离心10 min,得上清液和沉淀,上清液减压浓缩、真空冷冻干燥得到水提醇溶物(样品C),沉淀经真空冷冻干燥得水提醇沉物(样品D)。取样品D用蒸馏水溶解,经Sevag法[8]脱蛋白、截留分子质量为3 500 D透析袋透析48 h、真空冷冻干燥得水提粗多糖(样品E)。各个组分的得率以占霍山石斛干质量的百分比表示,各个组分的多糖含量用苯酚-硫酸法[9]测得,以多糖总量占各组分干质量的百分比表示(表1)。
1.3.2动物分组及给药
将实验小鼠随机分为18 组,每组10 只。18 组分别为(酒精性肝损伤)模型对照组,正常对照组,阳性对照组(水飞蓟素20 mg/kg),以及各提取物样品A、B、C、D、E的高、中、低剂量组。高、中、低剂量组的确定以《中华人民共和国药典(一部)》[10]中石斛干品的人体(60 kg)推荐摄入量(6~12 g/d)的中间量10 g/d的5、10、30 倍为依据,结合各种提取物得率,计算出每组的给药剂量,见表1。不同提取物样品和阳性对照物水飞蓟素均用0.1% DMSO溶液溶解,按10 mL/(kg·d)剂量(以体质量计,下同)灌胃小鼠,正常对照组和酒精性肝损伤模型组灌胃给予相应体积的0.1% DMSO溶液,连续灌胃30 d。从第16天后,除正常对照组外,其他各组每天给药结束后4 h灌胃给予30%乙醇(10 mL/kg)[7]。第30天灌胃结束后,禁食12 h,采用戊巴比妥钠溶液(60 mg/kg)麻醉后,腹主动脉取血,并解剖取出肝脏,记录质量后用液氮速冻,存于-80 ℃冰箱。
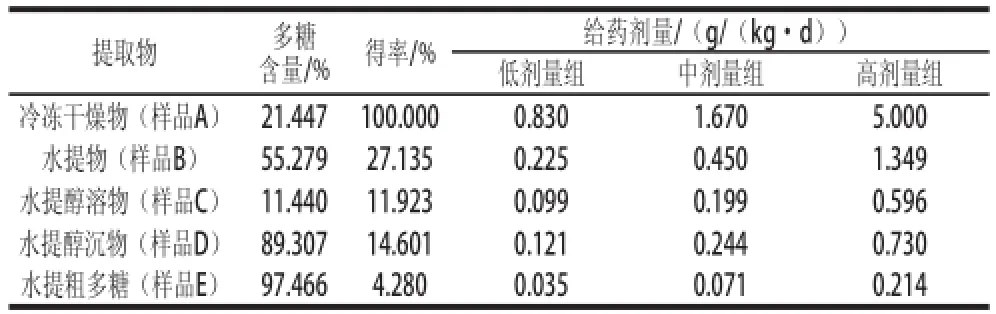
表1 霍山石斛不同提取物的给药剂量Table1 Administration dosages of different extraction fractions from Dendrobium huoshanense
1.3.3小鼠体质量和肝脏指数的测定
按照式(1)、(2)分别计算小鼠体质量增量和肝脏指数。

1.3.4小鼠肝组织病理学检查
取小鼠肝脏左叶处小块组织,10%福尔马林固定,常规脱水、石蜡包埋、苏木精-伊红(hematoxylineosin,HE)染色,制成切片后普通光学显微镜观察肝细胞变性程度、坏死及炎症改变等。
1.3.5血清生化指标测定
腹主动脉取血,血液静置过夜后,4 000 r/min离心20 min,分离得到血清,采用全自动生化分析仪测定血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)活力以及甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量。
1.3.6肝组织生化指标测定
1.3.6.1抗氧化应激指标测定
取出超低温冻存的肝脏,组织研磨后,加入0.9%生理盐水稀释成质量分数为10%的组织匀浆液,4 ℃、10 000 r/min离心15 min,分离上清液,按照试剂盒说明书方法检测GSH-Px、SOD活力以及MDA、GSH含量。
1.3.6.2乙醇代谢酶活性测定
乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)活性根据Koivisto等[11]的方法测定。
1.4数据统计及分析
2 结果与分析
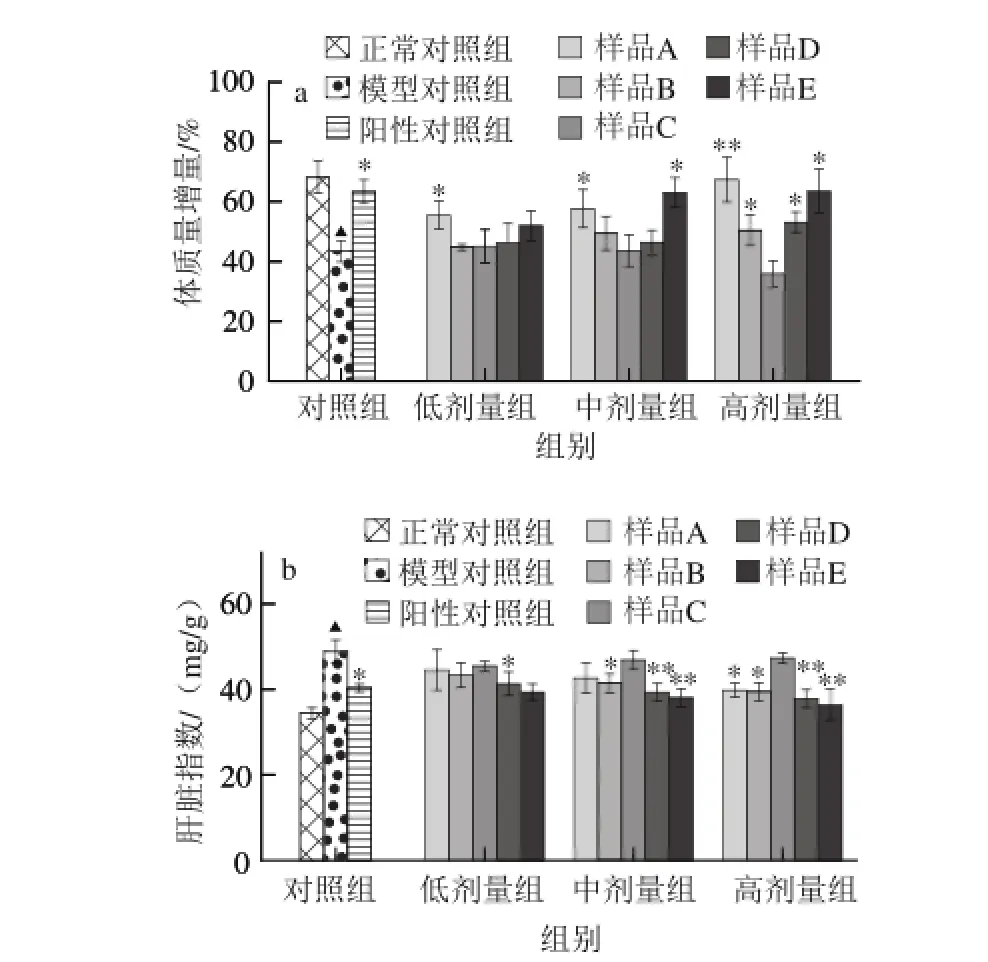
图1 霍山石斛不同提取物对小鼠体质量增量(a)及肝脏指数(b)的影响Fig.1 Effects of different extract fractions on weight gain (a) and liver index (b) of mice
2.1霍山石斛不同提取物对小鼠体质量增量及肝脏指数的影响如图1a所示,与正常对照组比较,模型对照组的小鼠体质量增量明显减少;与模型对照组相比,霍山石斛的冷冻干燥物及高剂量水提物、高剂量水提醇沉物和高、中剂量水提粗多糖均能不同程度地恢复酒精所抑制的小鼠体质量增量,而水提醇溶物对小鼠的体质量增量无显著性效果。其中,霍山石斛冷冻干燥物各剂量组均能显著增加小鼠体质量的现象可能与其能调节小鼠的饮食口味,促进摄食有关。进一步的小鼠肝质量与体质量变化分析表明,小鼠因酒精而升高的肝脏指数可被霍山石斛的高剂量冷冻干燥物及中、高剂量水提物、水提醇沉物和水提粗多糖抑制(图1b)。以上结果提示,在霍山石斛不同提取物中,多糖在缓解酒精性肝损伤小鼠的体质量降低和肝脏指数增加中发挥作用。
2.2霍山石斛不同提取物对小鼠肝组织形态的影响
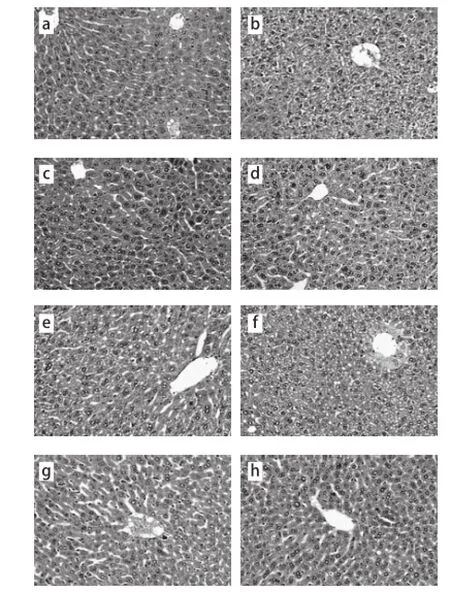
图2 霍山石斛不同提取物对小鼠肝组织形态的影响(HE,20×)Fig.2 Effects of different extract fractions on hepatic tissue morphology of mice (HE staining, 20 ×)
由图2可知,酒精可致小鼠肝细胞肿胀,部分肝细胞核固缩、溶解,肝细胞索排列混乱,肝小叶界限模糊,而霍山石斛的冷冻干燥物及水提物、水提粗多糖、水提醇沉物能不同程度地改善酒精引起的小鼠肝组织病理损伤,其中水提粗多糖(图2h)和水提醇沉物(图2g)的效果明显,但水提醇溶物组(图2f)小鼠肝损伤程度严重,接近模型对照组。
2.3霍山石斛不同提取物对小鼠肝功能的影响
长期或过量饮酒会造成肝细胞膜发生损伤[12],通透性增加,导致ALT、AST、ALP等酶类物质释放进入血液,因此,检测血清中ALT、AST、ALP的活性能准确反映早期酒精性肝损伤的程度[13-14]。如图3所示,与正常对照组相比,模型对照组小鼠血清ALT、AST、ALP活性均极显著升高(P<0.01),霍山石斛不同提取物对酒精致肝损伤小鼠血清中ALT、AST、ALP活性表现出不同的影响,霍山石斛的高剂量水提物以及低、中、高剂量水提醇沉物和水提粗多糖均能明显抑制血清ALT、AST、ALP活性的升高,且以水提粗多糖的效果最好,而水提醇溶物与模型对照组相比无显著性差异。以上结果表明,多糖在抑制酒精性肝损伤,降低酒精致血清ALT、AST、ALP活性升高中发挥重要作用。
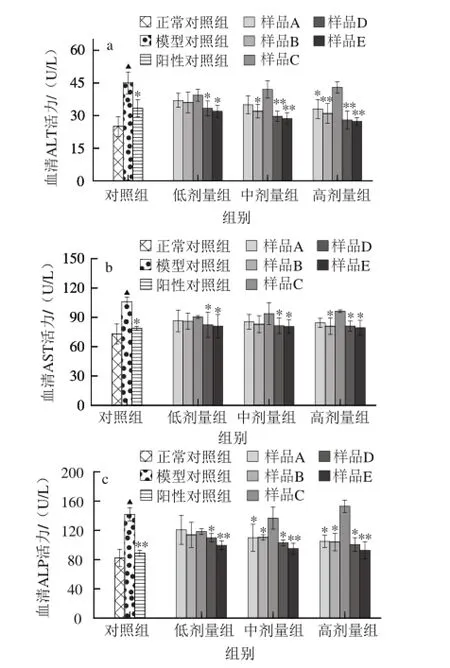
图3 霍山石斛不同提取物对小鼠血清ALT、AST及ALP活性的影响Fig.3 Effects of different extract fractions on the activities of serum ALT, AST and ALP in mice
2.4霍山石斛不同提取物对小鼠血清中脂质代谢水平的调节
酒精性肝损伤的另一个并发症状是脂质代谢异常,酒精代谢过程中代谢产物会导致甘油三酯合成量增加,脂蛋白的合成和分泌受阻,脂肪运出功能下降,致使血液中TC、TG和LDL-C含量增加,HDL-C含量降低,进而出现高脂血症和脂肪肝[15],因此,TC、TG、LDL-C、 HDL-C的水平可以反映脂质代谢情况。同正常对照组相比,模型对照组小鼠血清中HDL-C含量明显降低,LDL-C、TC、TG水平极显著升高(P<0.01),表明长期酒精摄入引起小鼠脂质代谢出现紊乱[16]。同模型对照组相比,高剂量水提醇沉物、水提粗多糖可显著恢复酒精引起的HDL-C水平降低,且水提粗多糖效果优于阳性对照组,接近于正常对照组水平(图4a)。进一步对LDL-C、TC、TG水平进行测定发现,除水提醇溶物外,中、高剂量冷冻干燥物、水提物以及不同剂量水提醇沉物和水提粗多糖均能不同程度抑制酒精致小鼠血清中LDL-C、TC、TG水平的升高(图4b~4d),以上结果说明多糖是霍山石斛中调节TC、TG、LDL-C、HDL-C水平,恢复脂质代谢异常的重要组分。
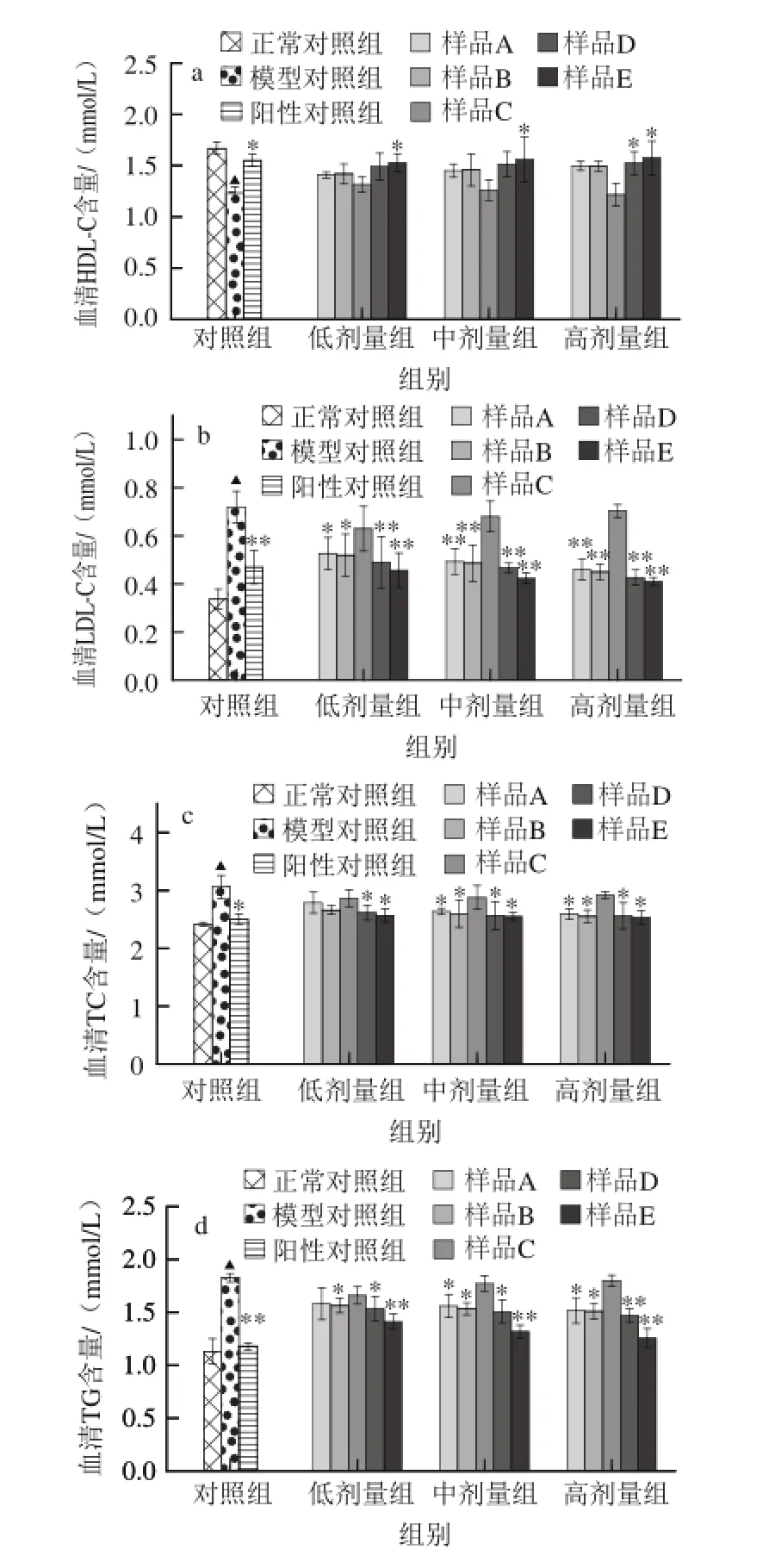
图4 霍山石斛不同提取物对小鼠血清中HDL-C、LDL-C、TC、TTGG水平的影响Fig.4 Effects of different extract fractions on the levels of serum TC,TG, HDL-C and LDL-C in mice
2.5霍山石斛不同提取物对小鼠肝组织抗氧化能力的影响
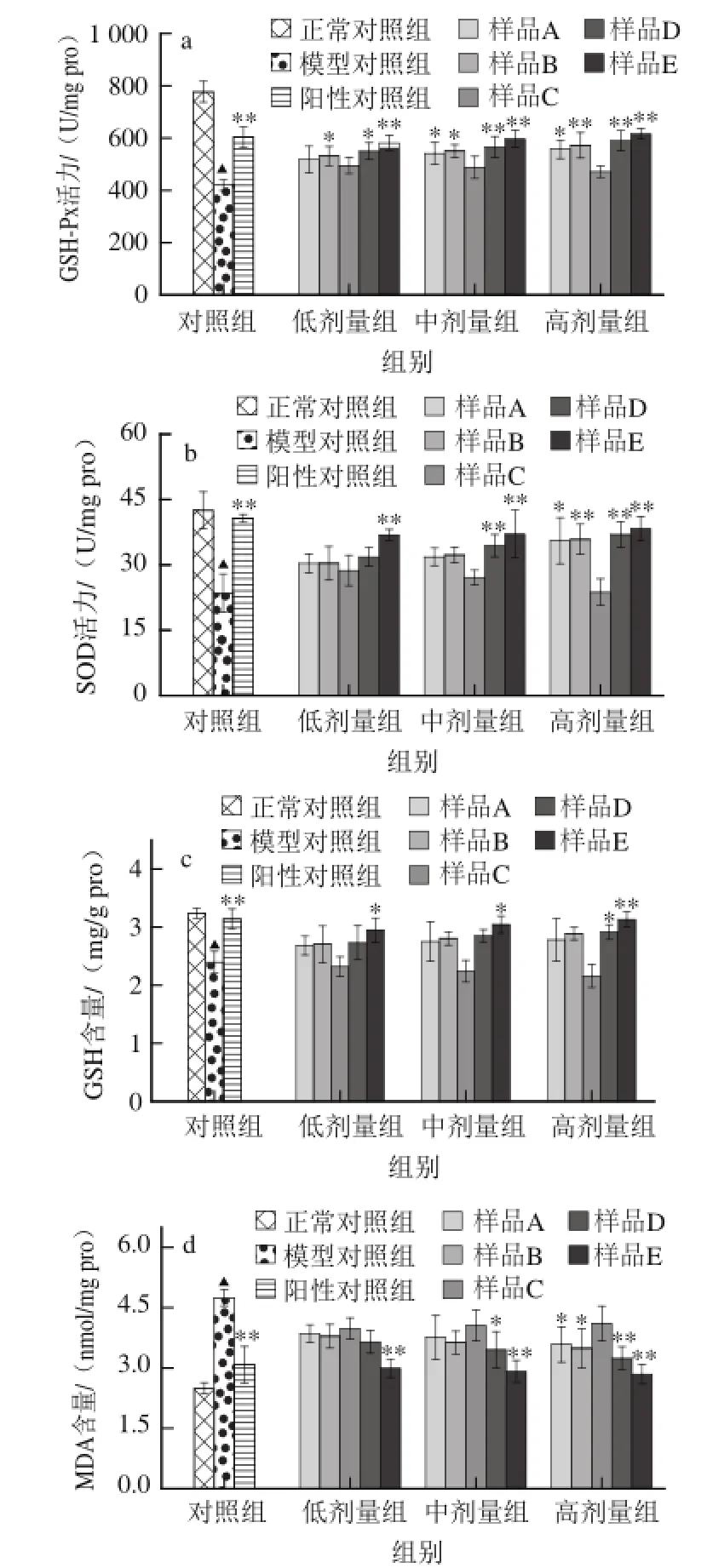
图5 霍山石斛不同提取物对小鼠肝组织抗氧化系统中GSH-Px、SSOODD活力及GSH、MDA含量的影响Fig.5 Effects of different extract fractions on antioxidant parameters such as GSH-Px, SOD, GSH and MDA in mice liver
肝组织中GSH-Px、SOD活力以及GSH、MDA水平的高低反映了肝组织抗氧化能力的强弱[17],长期摄入酒精会在肝脏内产生大量自由基[18-19],导致肝组织SOD、GSH-Px等抗氧化酶活性降低,GSH等非酶类抗氧化物质被大量消耗,膜脂质过氧化产物MDA含量增加,造成肝组织的氧化应激损伤[20-21]。如图5所示,高剂量冷冻干燥物以及中、高剂量的水提物、水提醇沉物、水提粗多糖均可明显恢复小鼠肝组织GSH-Px和SOD活性,并且高剂量水提醇沉物和水提粗多糖可明显提高肝组织GSH水平,高剂量冷冻干燥物和水提物以及中、高剂量水提醇沉物和水提粗多糖可明显抑制肝组织MDA的产生。以上结果与水提醇溶物缺乏改善作用相比,说明霍山石斛中主要是多糖组分参与了酒精致小鼠肝组织抗氧化损伤的修复。
2.6霍山石斛不同提取物对小鼠肝组织乙醇代谢酶活性的影响
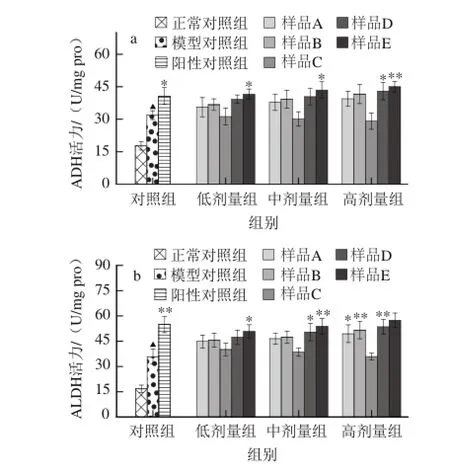
图6 霍山石斛不同提取物对小鼠肝组织中ADH、ALDH酶活性的影响Fig.6 Effects of different extract fractions on the levels of ADH and ALDH in mice liver
肝脏ADH、ALDH是机体分解乙醇、减轻乙醇损伤肝脏的重要代谢酶,它们活性的提高可减轻酒精对肝组织的损伤作用[22-23]。如图6所示,由于代谢的需要,酒精可刺激小鼠肝组织ADH、ALDH活性升高,而高剂量水提醇沉物和不同剂量水提粗多糖能进一步提高ADH活性(图6a),且高剂量冷冻干燥物和水提物,中、高剂量水提醇沉物以及不同剂量水提粗多糖能进一步提升ALDH活性(图6b)。结果表明,霍山石斛多糖可以大幅度升高ADH和ALDH活性以适应肝组织快速代谢酒精、减轻酒精毒性的需求。
3 结 论
酒精性肝损伤的发生与酒精在肝脏中产生的代谢毒性物质、氧化应激、脂质代谢紊乱等多种因素有关,血清转氨酶、脂质代谢水平和肝组织抗氧化指标可以反映酒精肝损伤程度[24]。本实验在进行病理学分析的同时,从对血清中AST、ALT、ALP 3 种转氨酶水平和TC、TG、HDL-C、LDL-C含量,肝组织中GSH-Px、SOD活性及GSH、MDA水平以及ADH、ALDH两种酒精代谢酶活性的比较研究中发现,霍山石斛及其不同提取物在抗亚急性酒精性肝损伤活性方面存在较大差异,其中水提粗多糖活性最好、水提醇沉物次之,水提物以及冷冻干燥物一般,而水提醇溶物无显著保护作用。由于从水提物依次纯化得到水提醇沉物和水提粗多糖,不同提取物中多糖含量呈梯度增加,表明霍山石斛及其不同提取物中发挥抗酒精性肝损伤作用的功能因子是多糖组分,其发挥作用的机制与抗氧化损伤和脂质代谢调节有关。进一步的研究需要从霍山石斛中分离出活性均一的多糖,并阐明其抗酒精性肝损伤的精细结构基础和分子作用机理。
[1] 江正辉, 王秦龄. 酒精性肝病[M]. 北京: 中国医药科技出版社, 2001:3-11.
[2] REUBEN A. Alcohol and the liver[J]. Current Opinion in Gastroenterology, 2007, 23(3): 283-291.
[3] 鲁晓岚, 陶明, 罗金燕, 等. 饮酒与肝病流行病学调查[J]. 中华肝脏病杂志, 2002, 10(6): 467-468.
[4] 赵嘉, 吕圭源, 陈素红. 石斛“性味归经”的相关药理学研究进展[J].浙江中西医结合杂志, 2009, 19(6): 388-390.
[5] 黄静, 李胜利, 赵宏伟, 等. 霍山石斛多糖对四氯化碳致急性肝损伤小鼠的保护作用[J]. 中国中药杂志, 2013, 38(4): 528-532.
[6] PAN Lihua, LU Jun, LUO Jianping, et al. Preventive effect of a galactoglucomannan (GGM) from Dendrobium huoshanense on selenium-induced liver injury and fi brosis in rats[J]. Experimental and Toxicologic Pathology, 2012, 64(7): 899-904.
[7] 国家食品药品监督管理总局. 对化学性肝损伤有辅助保护功能的评价方法(修订稿)[EB/OL]. (2011-09-30)[2014-05-17]. http://www. sda.gov.cn/WS01/CL0780/65778.html.
[8] STAUB A M. Removal of protein: Sevag method[J]. Methods in Carbohydrate Chemistry, 1965, 5(2): 5-6.
[9] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[10] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2010: 85-87.
[11] KOIVISTO T, ERIKSSON C J. Hepatic aldehyde and alcohol dehydrogenases in alcohol-preferring and alcohol-avoiding rat lines[J]. Biochemical Pharmacology, 1994, 48(8): 1551-1558.
[12] MELLO T, CENI E, SURRENTI C, et al. Alcohol induced hepatic fi brosis: role of acetaldehyde[J]. Molecular Aspects of Medicine, 2008,29(1): 17-21.
[13] JAYARAMAN J, NAMASIVAYAM N. Naringenin modulates circulatory lipid peroxidation, anti-oxidant status and hepatic alcohol metabolizing enzymes in rats with ethanol induced liver injury[J]. Fundamental and Clinical Pharmacology, 2011, 25(6): 682-689.
[14] KAVIARASAN S, ANURADHA C V. Fenugreek (Trigonella foenum graecum) seed polyphenols protect liver from alcohol toxicity: a role on hepatic detoxification system and apoptosis[J]. Pharmazie, 2007,62(4): 299-304.
[15] ROBINSON S F, QUARFORDT S H. The effect of ethanol on lipoprotein metabolism[J]. Alcoholism: Clinical and Experimental Research, 1981, 5(1): 101-109.
[16] 李胜立. 六种石斛多糖对酒精性肝损伤干预作用的比较研究[D]. 合肥: 合肥工业大学, 2013: 30-32.
[17] 邬升, 郑世华, 仝巧云. 酒精性肝病发病机制的研究进展[J]. 实用医学杂志, 2013, 29(12): 2049-2050.
[18] LU Y, CEDERBAUM A I. CYP2E1 and oxidative liver injury by alcohol[J]. Free Radical Biology and Medicine, 2008, 44(5): 723-738.
[19] de MINICIS S, BRENNER D A. Oxidative stress in alcoholic liver disease: role of NADPH oxidase complex[J]. Journal of Gastroenterology and Hepatology, 2008, 23(Suppl 1): 98-103.
[20] CHENG Daye, KONG Hong. The effect of Lycium barbarum polysaccharide on alcohol-induced oxidative stress in rats[J]. Molecules, 2011, 16(3): 2542-2550.
[21] ALBANO E. Alcohol, oxidative stress and free radical damage[J]. Proceedings of the Nutrition Society, 2006, 65(3): 278-290.
[22] 王国祥, 刘春荣. 酒精性肝病不同阶段大鼠胃乙醇脱氢酶活性变化研究[J]. 胃肠病学和肝病学杂志, 2000, 9(3): 181-183.
[23] 宋宇. 生物体内乙醇脱氢酶(ADH)的活力测定、分布及其与乙醇代谢动力学关系[D]. 成都: 四川大学, 2007: 41-44.
[24] 杨万枝, 吕雄文. 酒精性肝病发病机制研究进展[J]. 安徽医科大学学报, 2012, 47(1): 97-99.
Comparison of Hepatoprotective Effects of Different Extracts from Dendrobium huoshanense against Alcohol-Induced Subacute Liver Injury in Mice
MENG Haitao, WANG He, ZHA Xueqiang, PAN Lihua, LUO Jianping*
(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Objective: To compare the protective effects of different extracts from Dendrobium huoshanense against alcoholinduced subacute liver injury in mice. Methods: Freeze-dried Dendrobium huoshanense and its different extracts including water extract, alcohol-soluble extract, alcohol-insoluble extract and crude polysaccharides were prepared. Mouse liver injury was induced by oral administration of 30% alcohol and different extracts were employed to intervene in the liver injury. After continuous treatment for 30 days, mouse body weight and liver weight were measured, liver pathological changes were examined, the contents of serum alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase(ALP), total cholesterol (TC), triglyceride (TG), high density lipoprotein cholesterol (HDL-C) and low density lipoprotein cholesterol (LDL-C) were determined, and the levels of hepatic alcohol dehydrogenase (ADH), acetaldehyde dehydrogenase(ALDH), glutathione peroxidase (GSH-Px), superoxide dismutase (SOD), malonaldehyde (MDA), and glutathione (GSH)were determined. Results: The protective effects of freeze-dried Dendrobium huoshanense, and its water extract and alcoholinsoluble extract against alcohol-induced subacute liver injury were better than that of alcohol-soluble extract, but lower than that of crude polysaccharides. Liver tissue damage and steatosis in mice subjected to 30% alcohol were ameliorated by oral administration with crude polysaccharides, the levels of ALT, AST, ALP, LDL-C, TC and TG in serum were reduced,the level of HDL-C in serum and the activities of ADH, ALDH, SOD and GSH-Px in liver were enhanced, and the loss of GSH and the increase of MDA in liver were suppressed. Conclusion: Polysaccharides are the major functional factors in Dendrobium huoshanense protecting liver tissue from alcohol-induced injury.
Dendrobium huoshanense; extract fractions; subacute alcoholic liver injury
Q946.3
A
1002-6630(2015)13-0229-06
10.7506/spkx1002-6630-201513042
2014-07-29
安徽省科技攻关计划项目(12010402088)
孟海涛(1990—),男,硕士,研究方向为中草药与功能食品。E-mail:haitaomeng2013@163.com
罗建平(1966—),男,教授,博士,研究方向为食品化学与分子营养。E-mail:jianpingluo@hfut.edu.cn

