青金桔皮中多酚的提取及其抗氧化性研究
段宙位,窦志浩,何 艾,*,谢 辉,岳炜瑗
(1.海南省农业科学院农产品加工设计研究所,海南海口571100;2.海南大学食品学院,海南海口570228)
青金桔皮中多酚的提取及其抗氧化性研究
段宙位1,窦志浩1,何艾1,*,谢辉1,岳炜瑗2
(1.海南省农业科学院农产品加工设计研究所,海南海口571100;2.海南大学食品学院,海南海口570228)
以青金桔皮为原料,选取乙醇作为提取溶剂,采用Folin-Ciocalteu法测定其多酚含量,探讨了乙醇浓度、提取温度、料液比和提取时间对多酚得率的影响。在单因素实验的基础之上,通过正交实验优化提取工艺。采用DPPH自由基法、ABTS自由基法和铁氰化钾还原力法测定青金桔皮中多酚提取物的抗氧化活性。结果表明,青金桔皮多酚的提取工艺为乙醇浓度60%(v/v),温度55℃,料液比1∶30(g/mL),提取时间3h,提取1次,在此条件下多酚的得率为3.68%(以干重计,w/w)。抗氧化性实验表明,青金桔皮多酚提取物具有较强的清除DPPH自由基和ABTS自由基能力,其IC50值分别为1.38mg/mL和0.49mg/mL,还原力测定实验也得出相似的结果。
青金桔皮,多酚,提取,抗氧化活性
植物多酚是一类广泛存在于植物体内的大分子化合物,主要存在于植物的皮、根、叶、果中[1]。多酚具有抗氧化、抗突变、抗癌、抗菌、抗动脉硬化与防治冠心病等多种功效[2-7],广泛应用于食品、化妆品、药品及保健品等领域。目前,关于青金桔的研究主要在高产栽培、盆栽工艺等[8-9]方面,尚未开展青金桔皮多酚的提取及抗氧化活性研究。本实验以青金桔皮为原料,采用有机溶剂浸提法,提取其中的多酚类物质,测定其抗氧化活性,旨在为青金桔皮的高值化利用提供理论基础,提高青金桔的附加值。
1 材料与方法
1.1材料与仪器
青金桔购于海口市水果市场;Folin-Ciocalteu试剂北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH) 美国Sigma公司;2,2-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)上海生工生物有限公司;没食子酸标准品阿拉丁试剂有限公司;其他试剂均为国产分析纯。
101系列数显鼓风干燥箱上海叶拓仪器仪表有限公司;多功能粉碎机上海江信科技有限公司;CPA225D电子天平德国Sartorius公司;SPH-200B恒温培养振荡器上海世平实验设备有限公司;SHZ-D(Ⅲ)循环水式真空泵巩义市予华仪器有限责任公司;TU-1810紫外可见分光光度计北京普析通用仪器有限责任公司;RE-52AA旋转蒸发仪上海亚荣生化仪器。
1.2实验方法
1.2.1青金桔皮多酚提取工艺流程青金桔皮→清洗→烘干(50℃)→粉碎(60目)→浸提→过滤→取上清液(测定吸光值并计算得率)→优化提取工艺→制备多酚提取物→浓缩→干燥(测定抗氧化性)→成品。
(3)模拟工况测试阻垢率实验。为了使模拟工况测试阻垢率实验不受试样腐蚀的影响,实验选取825耐腐蚀合金,在60℃、常压的条件下进行挂片实验72 h。阻垢率按式(4)计算。
1.2.2多酚的测定参考贾冬英等[10]的方法,略有修改。将青金桔皮多酚提取液稀释200倍,取1mL稀释液与1mL Folin-Ciocalteu,2mL 15%Na2CO3混匀反应2h后,于765nm下测定吸光值。
1.2.3青金桔皮多酚得率的测定
1.2.3.1没食子酸标准曲线的绘制配制浓度为0.01mg/mL的没食子酸标准溶液,分别吸取2、4、6、8、10mL定容至10mL。采用1.2.2方法测定吸光值,以没食子酸浓度为横坐标,吸光值为纵坐标,绘制标准曲线,建立标准曲线方程:y=34.286x+0.0332,R2=0.9967,没食子酸溶液在0.002~0.010mg/mL范围内线性关系良好。
1.2.3.2多酚得率的计算取不同条件下提取的样液,测定吸光值,按下式计算得率。Y(%)=(A-0.0332)×200×V×100/(34.286×1000M),式中:Y为多酚得率;A为样液吸光值;M为样品质量(g);200为样液稀释倍数;V为样液体积。
1.2.4单因素实验
1.2.4.1乙醇浓度对多酚得率的影响称取10g青金桔皮粉,按料液比1∶20(g/mL),分别加入40%、50%、60%、70%、80%(v/v)的乙醇溶液,置于50℃恒温摇床(180r/ min)中浸提3h。取上清液,测定吸光值,计算得率。
1.2.4.2提取温度对多酚得率的影响称取10g青金桔皮粉,按料液比1∶20(g/mL),加入60%(v/v)的乙醇溶液,分别于40、45、50、55、60℃恒温摇床(180r/min)中浸提3h。取上清液,测定吸光值,计算得率。
1.2.4.3料液比对多酚得率的影响称取10g青金桔皮粉,按料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),分别加入60%(v/v)的乙醇溶液,置于55℃的恒温摇床(180r/ min)中振荡3.0h。取上清液,测定吸光值,计算得率。
1.2.4.4时间对多酚得率的影响称取10g青金桔皮粉,按料液比1∶25(g/mL),加入60%(v/v)的乙醇溶液,置于55℃的恒温摇床(180r/min)中分别振荡2.0、2.5、3.0、3.5、4.0h。取上清液,测定吸光值,计算得率。
1.2.4.5提取次数对多酚得率的影响称取10g青金桔皮粉,每份按料液比1∶25(g/mL),加入60%(v/v)的乙醇溶液,置于55℃的恒温摇床(180r/min)中振荡3h。提取次数超过1次的,合并提取液,测定吸光值,计算得率。
1.2.5正交实验根据单因素实验结果,运用L9(34)正交实验表,以青金桔皮中多酚的得率为指标,选择乙醇浓度、提取温度、液料比和提取时间做四因素三水平正交实验,因素水平设计见表1。

表1 正交实验因素水平表Table 1 The factors and levels of orthogonal design
1.2.6体外抗氧化活性测定将青金桔皮多酚提取物浓缩、干燥、配成不同质量浓度的样液,采用DPPH法[11-12]、ABTS法[13]、还原力法[14]测定其抗氧化性。
1.2.7数据处理采用正交助手V3.1进行正交实验设计,Origin7.5绘制图形。

图1 乙醇提取浓度对多酚得率的影响Fig.1 Effect of ethanol concentration on the yield of polyphenols
2 结果与分析
2.1青金桔皮多酚提取的单因素实验
2.1.1乙醇浓度对多酚得率的影响由图1可知。当乙醇浓度小于60%(v/v)时,随着乙醇浓度的提高,青金桔皮多酚的得率增加;当乙醇浓度大于60%(v/v)时,随着乙醇浓度的提高,青金桔皮多酚的得率减小。这可能是因为不同浓度的乙醇溶液极性不一样,60%(v/v)乙醇溶液的极性与多酚提取物的极性相近,根据相似相溶原理,多酚提取物在60%(v/v)乙醇溶液中的溶解性较大,利于提取;当乙醇浓度小于60%(v/v)时,随着乙醇浓度的提高,多酚的溶出增加,得率增大;当乙醇浓度大于60%(v/v)时,多酚的溶出减少,同时一些醇溶性杂质、色素、亲脂性强的成分溶出量增加,这些成分与多酚竞争同乙醇-水分子结合,从而导致多酚得率下降。因此,乙醇浓度选择60%左右为宜。
2.1.2提取温度对多酚得率的影响由图2可知,随着温度的升高,青金桔多酚的得率先增大后减小,当温度小于55℃时,随着温度的升高,得率增大,这是因为温度升高,分子运动加速,氢键更易断裂,多酚的渗透、溶解、扩散速度也加快,酚类物质更易从原料中溶出。当温度大于55℃时,随着温度的升高,得率减小,这是因为较高温度下部分多酚类物质发生氧化或降解反应。因此,提取温度选择55℃左右为宜。

图2 温度对多酚得率的影响Fig.2 Effect of temperatures on the yield of polyphenols
2.1.3料液比对多酚得率的影响由图3可知,随着料液比的减小,多酚的得率呈上升趋势,当料液比达到1∶25(g/mL)时,继续减小料液比对多酚的得率影响不大,这是因为料液比1∶25(g/mL)时,青金桔皮多酚的溶出基本完全。料液比选择1∶25(g/mL)左右为宜。

图3 料液比对多酚得率的影响Fig.3 Effect of solid-liquid ratio on the yield of polyphenol
2.1.4提取时间对多酚得率的影响由图4可知,当时间小于3h时,随着时间的延长,得率逐渐上升,这是因为时间小于3h时,多酚还未充分溶出;当时间在3.0~4.0h时,随着时间的增加,得率变化不大,表明当提取达到一定时间时,多酚的溶出达到平衡;4.0h时,得率略有降低,可能是因为时间过长,一些热敏性组分被破坏而使多酚类化合物得率降低。提取时间选择3h左右为宜。
2.1.5提取次数对多酚得率的影响由图5可知,提取次数为3次时,青金桔皮多酚的得率变化不大;提取次数为2次时多酚的得率稍有提高。由于增加提取次数对多酚得率的影响不大,同时青金桔皮为废弃物,原料成本低,综合考虑得率、效率与经济效益,提取次数选择1次为宜。

图4 时间对中多酚的得率的影响Fig.4 Effect of time on the yield of polyphenol
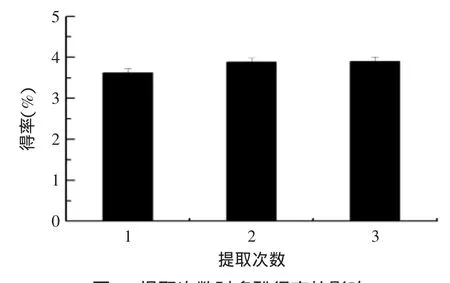
图5 提取次数对多酚得率的影响Fig.5 Effect of extraction times on the yield of polyphenol
2.2正交实验
由表2可知,4个因素对青金桔皮中多酚得率的影响次序为A>B>C>D,即乙醇浓度>提取温度>料液比>提取时间,最优水平位A2B2C3D3。由表3方差分析可知,乙醇浓度与温度对多酚得率的影响显著(p<0.05),料液比与时间对多酚得率的影响不显著。由于时间对得率的影响不显著,且水平D2与D3仅相差0.037%,综合考虑成本、提取效率,提取时间选择D2,最终确定青金桔皮多酚的提取工艺为A2B2C3D2,即乙醇浓度60%(v/v),温度55℃,料液比1∶30(g/mL),提取时间3h,提取次数1次。对照正交表,正交实验9组实验中没有A2B2C3D2,按A2B2C3D2条件补加实验,重复三次取平均值,得青金桔皮多酚的得率为3.68%(以干重计,w/w)。青金桔皮的多酚的得率高于香蕉皮中多酚的得率1.02%[10],石榴皮中多酚的得率1.42%[15],芒果皮中多酚的得率1.41%[16],葡萄皮中多酚的得率0.85%[17],说明可以从青金桔皮中提取较多的多酚物质。

表2 正交实验设计及其结果Table 2 Orthogonal experiment and its results
2.3抗氧化活性的测定
2.3.1DPPH自由基清除作用的测定DPPH分子溶液具有典型紫色,在517nm处有强吸收,当它与自由基清除剂作用时,生成无色产物,溶液的紫色变浅。由图6可知,青金桔皮多酚提取物对DPPH自由基具有一定的清除能力,且随质量浓度的增加而增强。根据线性方程求出青金桔皮多酚提取物和VC对DPPH自由基的半抑制浓度(the half inhibitory concentration,IC50)分别为1.38、0.0057mg/mL,说明青金桔皮多酚提取物清除DPPH自由基能力弱于VC,这可能是因为多酚提取物是混合物,纯度低,杂质多,抑制了其活性。一般认为某种物质清除自由基的IC50值低于10mg/mL,表明其具有较好的抗氧化性[18],可见青金桔皮多酚提取物仍表现出较强的清除DPPH自由基效果。

表3 方差分析表Table 3 Analysis of variance table

图6 提取物浓度对DPPH自由基清除率的影响Fig.6 Effect of extract density on rate of scavenging DPPH free radical
2.3.2ABTS自由基清除率的测定ABTS经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS+,当有自由基清除剂作用时,则会与ABTS+发生反应而使溶液颜色变浅。由图7可知,随着青金桔皮多酚提取物质量浓度的增加,各提取物对ABTS自由基的清除率也随之增大。根据方程求出青金桔皮多酚提取物和VC对ABTS自由基的IC50值分别为0.49、0.0067mg/mL。可见青金桔皮多酚提取物具有清除ABTS自由基能力,但仍弱于VC。
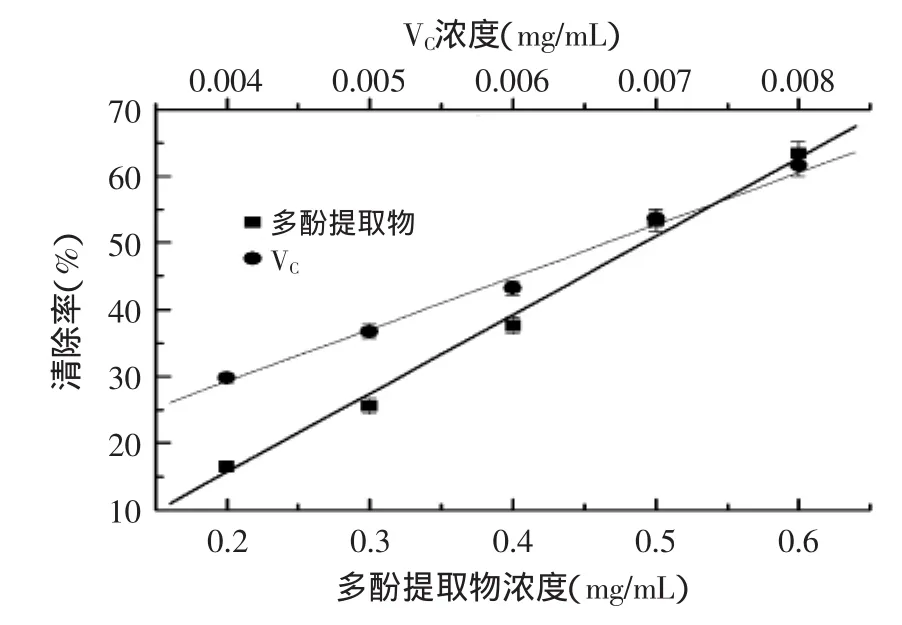
图7 提取物浓度对ABTS自由基清除率的影响Fig.7 Effect of extract density on rate ofscavenging ABTS free radical
2.3.3还原力的测定据研究报道[19],抗氧化活性与还原力之间普遍存在相关性,吸光值越高,还原能力越强,抗氧化性越强。由图8可知,青金桔皮多酚提取物具有一定的还原能力,还原力随提取物质量浓度的增加而增强,但仍弱于VC,这与清除DPPH自由基与ABTS自由基表现的效果类似。

图8 提取物浓度对还原力的影响Fig.8 Effect of extract density on the reduction power
3 结论
以青金桔皮为原料,采用有机溶剂浸提法,在单因素的基础上,考察乙醇浓度、提取温度、液料比、提取时间对多酚得率的影响,通过正交实验优化提取工艺。结果表明,青金桔皮多酚的提取工艺为乙醇浓度60%(v/v),温度55℃,料液比1∶30(g/mL),提取时间3h,提取次数1次,此条件下多酚的得率为3.68%(以干重计,w/w)。抗氧化性实验表明,青金桔皮多酚提取物具有较强的清除DPPH自由基和ABTS自由基能力,其IC50值分别为1.38mg/mL和0.49mg/mL,还原力测定实验也得出相似的结果。
[1]王华斌,王珊,傅力.酶法提取石榴皮多酚工艺研究[J].中国食品学报,2012,12(6):56-65.
[2]Nevin K G,Rajamohan T.Beneficial effects of virgin coconut oil on lipid parameters and in vitro LDL oxidation[J].Clinical Biochemistry,2004,37(9):830-835.
[3]Leticia X,Lopez-Martinez,Rosa M,et al.Antioxidant activity,phenolic compounds and anthocyanins content of eighteen strains of mexican maize[J].Food Science and Technology,2009,42(6):1187-1192.
[4]Tomaino A,Cristani M,Cimino F,et al.In vitro protective effect of a Jacquez grapes wine extract on UVB-induced skin damage[J].Toxicology in Vitro,2006,20(8):1395-1402.
[5]Laguerre M,Lecomte J,Villeneuve P.Evaluation of the ability of antioxidants to counteract lipid oxidation:Existing methods,new trends and challenges[J].Progress in Lipid Research,2007,46(5):244-282.
[6]Joao C M,Isabel C F R,Beatriz P O,et al.Antioxidant activities of the extracts from chestnut flower,leaf,skins and fruit[J].Food Chemistry,2008,107(3):1106-1113.
[7]Jesus N S,Evaldo M,Adeline L,et al.Antioxidant capacity of four polyphenol-rich Amazonian plant extracts:A correlation study using chemical and biological in vitro assays[J].Food Chemistry,2008,106(1):331-339.
[8]罗洪林.酸桔砧温州蜜柑断根环割增产显著[J].中国柑桔,1985(2):38.
[9]徐成文.金桔盆景的制作[J].农村新技术,2006(11):25-26.
[10]贾冬英,李尧,姚开,等.香蕉皮中多酚的提取工艺条件研究[J].四川大学学报:工程科学版,2005,37(6):55-58.
[11]Sun T,Ho C T.Antioxidant activities of buckwheat extrats[J]. Food Chemistry,2005,90(4):743-749.
[12]段宙位,申铉日,李鹏,等.罗非鱼尾色素中抗氧化成分的提取及活性研究[J].食品工业科技,2012,33(10):143-150.
[13]Stphanie D,Xavier V,Philippe C,et al.Comparative study of antioxidant properties and total phenolic content of 30 plant extracts of industrial interest using DPPH,ABTS,FRAP,SOD,and ORAC assays[J].Journal of Agriculture and Food Chemistry,2009,57(5):1768-1774.
[14]Fang Z X,Zhang Y H,Yuan L A,et al.Phenolic compounds and antioxidant capacities of bayberry juices[J].Food Chemistry,2009,113(4):884-888.
[15]房玉林,齐迪,郭志君,等.超声波辅助法提取石榴皮中总多酚工艺[J].食品科学,2012,33(6):115-118.
[16]张国治,薛慧.芒果皮中多酚提取工艺的优化[J].河南工业大学学报:自然科学版,2011,32(3):35-40.
[17]令博,王捷,吴洪斌,等.葡萄皮渣多酚超声波辅助提取工艺响应面法优化及抗氧化活性研究[J].食品科学,2011,32(18):24-29.
[18]刘楠,于新宇,赵红,等.益智仁化学成分研究[J].中草药,2009,40(1):29-32.
[19]董欢欢,曹树稳,余燕影.半枝莲、白花蛇舌草及其药对提取物抗氧化及清除自由基活性[J].天然产物研究与开发,2008,20(5):782-786,802.
Extraction and antioxidant activity of polyphenols from green kumquat peel
DUAN Zhou-wei1,DOU Zhi-hao1,HE Ai1,*,XIE Hui1,YUE Wei-yuan2
(1.Institute of Processing&Design of Agroproducts,Hainan Academy of Agricultural Science,Haikou 571100,China;2.Collage of Food Science and Technology,Hainan University,Haikou 570228,China)
Taking green kumquat peel as raw material,used ethanol as extraction solvent extracting polyphenols,determined the content of polyphenols by Folin-Ciocalteu method,identified the effect of ethanol concentration,temperature,solid-liquid ratio and time on the extraction efficiency of polyphenols.Based on single factor test,an orthogonal design was applied to optimize extraction process.Antioxidant activities of extract were evaluated by three different methods,such as DPPH and ABTS radical scavenging assay,potassium ferricyanide reduction method.The results showed that the optimum polyphenols extraction conditions as follows:extraction solvent 60%ethanol(v/v),extraction temperature 55℃,solid-liquid ratio(g/mL)1∶30,extraction time 3h and one time. Under these conditions,the extraction rate of polyphenols was 3.68%(calculated on dry basis,w/w).And the experiments of antioxidant activity showed that the extracted polyphenols presented the strong antioxidant activity to the DPPH and ABTS radical,and the IC50was 1.38mg/mL and 0.49mg/mL,respectively.Potassium ferricyanide reduction test also showed similar results.
green kumquat peel;polyphenols;extraction;antioxidant activity
TS201.1
B
1002-0306(2015)10-0244-05
10.13386/j.issn1002-0306.2015.10.043
2014-09-12
段宙位(1985-),男,硕士研究生,研究实习员,研究方向:农产品加工。
何艾(1965-),女,本科,助理园艺师,研究方向:热带果蔬加工,农产品质量检测。
海南省科学事业费项目(314155);海南省科研院所技术开发专项(KYYS-2014-35)。

