一个显性卷叶突变体z2的遗传分析与精细定位
张龙弟王雁伟张治国吴金霞
(1.中国农业科学院生物技术研究所,北京 100081;2.首都师范大学,北京 100048)
一个显性卷叶突变体z2的遗传分析与精细定位
张龙弟1王雁伟2张治国1吴金霞1
(1.中国农业科学院生物技术研究所,北京 100081;2.首都师范大学,北京 100048)
叶片的适度卷曲对水稻理想株型育种具有重要意义。在水稻T-DNA插入突变体库中获得一个叶片外卷突变体z2,突变体表型出现在分蘖期;与野生型相比,农艺性状无明显差异,光合作用效率高于野生型。对突变体和野生型的石蜡切片研究表明,突变体叶片泡状细胞数量(8-9个)明显多于野生型(4-5个)。z2卷叶性状遗传稳定,由一对显性核基因控制。以z2纯合突变体为母本,籼稻Dular为父本进行杂交构建F2代定位群体,利用图位克隆的方法,将该基因初定位于水稻第2号染色体的InDel1812与InDel1870标记之间,物理距离为580 kb。
水稻(Oryza sativa L.);卷叶突变体;遗传分析;图位克隆
叶片是植物进行光合作用最主要的营养器官。叶形对水稻的产量、品质等具有极大的影响,研究者在水稻理想株型的研究中就明确提出,微卷的叶片可以使叶片保持直立,相比于弯叶,直立的叶片有助于增加透光率,使植株整体的光合作用增强,从而提高光能利用率[1]。同时,适当的卷叶还可以降低叶片在干旱环境下的蒸腾作用,减少植株失水,增强植株的抗逆性,从而提高产量[2]。所以,在理想株型育种中,卷叶叶形越来越成为育种家们所关注的焦点[3]。水稻卷叶突变体则为水稻理想株型的研究和提高水稻产量提供了理想的实验材料。
到目前为止,已有多个卷叶基因被定位,其中6个基因(rl1-rl6)是通过传统的遗传分析手段,即形态学标记,被定位在染色体上;有的基因如rl7-rl12是通过分子标记被定位在染色体上。rl7、rl8定位于5号染色体[4],rl9[5]、rl10[6]定位于9号染色体,rl11[7]定位于7号染色体,rl12[8]定位在10号染色体。此外,还有url(t)[9]、nrl2(t)[10]、nal3(t)[11]、acl1[12]等。就目前的研究报道,造成卷叶主要的原因是叶片细胞的变化,如泡状细胞数量的变化、厚壁细胞增多或缺失等。sll1突变体叶片极度内卷是由于SLL1基因功能缺失,导致远轴面叶肉细胞PCD过程紊乱,致使厚壁细胞缺失造成的[13]。Fang等[14]通过图位克隆的方法定位了卷叶基因rl14,其编码2OG-Fe(II)氧化酶,rl4突变体叶肉细胞次生细胞壁组分发生改变,从而影响到水分的运输,使得叶片失水,泡状细胞异常,造成叶片内卷。srl1突变体的正卷性状是由于叶片近轴面泡状细胞增多而造成的[15]。roc5的功能缺失会使叶片泡状细胞增多且变大,造成叶片外卷,而在roc5过表达植株中,泡状细胞则减少且变小,造成叶片内卷,这说明了roc5在泡状细胞发育过程中起重要的调控作用[16]。
本研究以水稻T-DNA插入突变体库中所筛选到的显性叶片内卷突变体z2为基础,通过初定位和精细定位,将基因定位在一个较小的范围内,旨在为克隆控制显性卷叶z2基因奠定基础。
1 材料与方法
1.1 材料
水稻叶片外卷突变体z2来自本实验室构建的水稻激活标签突变体库[17]。经过大田多代自交,卷叶性状稳定遗传,后代无性状分离。野生型为日本晴和杂交群体亲本为籼稻Dular。
1.2 方法
1.2.1 表型鉴定和农艺性状 选取z2突变体与野生型种子各约40粒放入底部铺有滤纸的玻璃培养皿,25℃加水萌发。待水稻露白后移至光照培养箱中,培养条件:光照强度40 000 lx,光照周期14/10 h,温度28/20℃,湿度70%。待芽长约2-3 cm后移栽至温室,观察z2突变体与野生型各叶片叶形差异。后移栽至河北廊坊大田,挂牌标记,观察各叶叶长、叶宽和卷曲程度。在水稻成熟后测量统计其农艺性状,如株高、分蘖数、有效分蘖数、穗长、结实率、千粒重、剑叶长、剑叶宽等。
1.2.2 z2突变体光合参数测定 使用光合测定仪LICOR LI-600分别对抽穗期的z2突变体与野生型进行光合作用效率、蒸腾作用速率、二氧化碳气孔导度测定。
1.2.3 叶片石蜡切片观察 在田间取抽穗期z2突变体与野生型叶片,立即放入Carnoy固定液(无水乙醇∶氯仿∶冰醋酸=6∶3∶1,现用现配)中,利用注射器抽真空使材料浸没与固定液中,室温放置12 h,进行梯度浓度乙醇脱水和二甲苯透明,在浸蜡包埋后使用RM2155型切片机进行切片,经熔蜡、复水、染色和脱水后进行封片,最后在ZESIS蔡司荧光显微镜下镜检、拍照。
1.2.4 遗传分析和F2代定位群体构建 以卷叶突变体z2与野生型进行正反交组合,获得F1代种子,后观察F1代植株性状并进行自交获得F2代种子。将F2种子种于大田,观察F2代表型,统计性状分离比,进行遗传分析。以z2纯合突变体为母本,籼稻亚种Dular为父本进行杂交,获得F1代,F1代自交构建F2代定位群体。
1.2.5 水稻基因组DNA提取和PCR扩增体系 用于构建混池的F2代正常表型水稻单株、野生型和Dular的DNA提取均采用改进的CTAB法[18]。10 μL PCR扩增体系:10×Buffer 1 μL,25 mmol/L MgCl20.5 μL,2.5 mmol/L dNTPs 0.5 μL,20 pmol/L正、反向引物各1 μL,约20 nmol/L DNA模板1 μL,5 U/μL Taq DNA聚合酶0.1 μL,ddH2O 4.9 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,33个循环;72℃延伸7 min。根据产物差异,选择(1)进行4%琼脂糖凝胶电泳,185 V,15 min;(2)进行10%聚丙烯凝胶电泳,200 V,120 min,后经银染观察。
1.2.6 InDel分子标记建立与基因定位 利用植物分子生物学网站Gramene(http://www.gramene.org)上所公布的籼稻日本晴与粳稻9311全基因组进行比对,挖掘籼稻与粳稻之间差异,一般相差10 bp以上,DNAMAN设计初定位引物。开发的初定位引物共612条,对612条初定位引物进行多态性分析,其中166条在日本晴与Dular之间具有多态性,平均分布在水稻的12条染色体上,平均约3 Mbp有一条初定位引物。以F2代正常表型的植株每5株组成一定位混池,共3个混池,以初定位引物对混池进行PCR扩增,确定连锁关系。获得连锁后,扩大群体,设计精细定位引物进行精细定位。
1.2.7 遗传作图 将与Dular亲本带型一样的记为I型带,与日本晴亲本带型一样的记为II型带,具有双带的记为Ⅲ型带。统计并分析带型结果,利用MapMaker EXP 3.0[19]进行数据分析计算遗传距离,并绘制连锁图谱。
2 结果
2.1 z2突变体的表型分析
z2突变体在温室生长时期5叶期,移栽至廊坊大田后到分蘖期表型开始出现,表现为叶片向远轴面卷曲,随着植株生长,全部叶片整体发生卷曲,叶片卷曲呈半桶状。叶片卷曲度(LRIs)为65%左右,野生型卷曲度为0(图1)。由于z2突变体的叶片外卷,其叶片的直立度(LEIs)高于野生型,其光合作用效率也相应的有所提高(表1)。在农艺性状方面,经过大田统计分析,相对于野生型,z2突变体在株高、分蘖数、穗长、穗粒数、千粒重等方面均无显著差异。

图1 成熟期野生型与z2突变体表型比较

表1 野生型与z2突变体光合生理指标比较
2.2 z2突变体细胞形态学分析
通过对野生型和z2突变体叶片进行石蜡切片观察发现,相比于野生型,z2突变体的叶片泡状细胞明显增多,达到7-8个,而野生型一般有4-5个,突变体泡状细胞在叶片横切面中的总面积也明显大于野生型(图2),所以z2突变体叶片外卷表型的出现是由于叶片泡状细胞增多导致的。
2.3 z2突变体的遗传分析
以z2突变体与野生型杂交获得F1代种子,对F1代植株进行大田观察,发现全部F1代植株的叶片在分蘖期出现向进轴面卷曲,表型与z2突变体相同。F1代植株自交产生F2代植株出现性状分离,卷曲叶与非卷曲叶植株的分离比为3∶1,经卡方检测,实得数据与理论比例无明显差异(表2),可以证明z2突变体是由一对显性核基因控制。
2.4 z2基因的初定位与精细定位
使用612对初定位引物中日本晴与Dular之间具有多态性的166对引物对3个混池(z2/Dular F2代正常叶形5株一混池)进行PCR扩增,进行初定位,发现其中2个混池与2号染色体长臂上的rm2-6和rm2-10完全连锁。取30株野生型表型的F2代单株使用rm2-6和rm2-10标记进行连锁分析,结果显示rm2-6和rm2-10与z2突变位点连锁,部分开发的初定位引物与精细定位引物,见表3。
在rm2-6与rm2-10标记之间设计InDel精细定位引物共29对,经检测其中16对在日本晴与Dular之间具有多态性,且能使用4%琼脂糖凝胶电泳或10%聚丙烯凝胶电泳分辨开。使用33个正常表型F2代交换单株将z2突变位点定位在InDel1599与InDel1918标记之间,进一步扩大群体并开发新的InDel标记,使用519个正常表型F2代单株,最终将z2突变基因定位于InDel1870与InDel1812之间,其物理距离为580 kb(图3)。
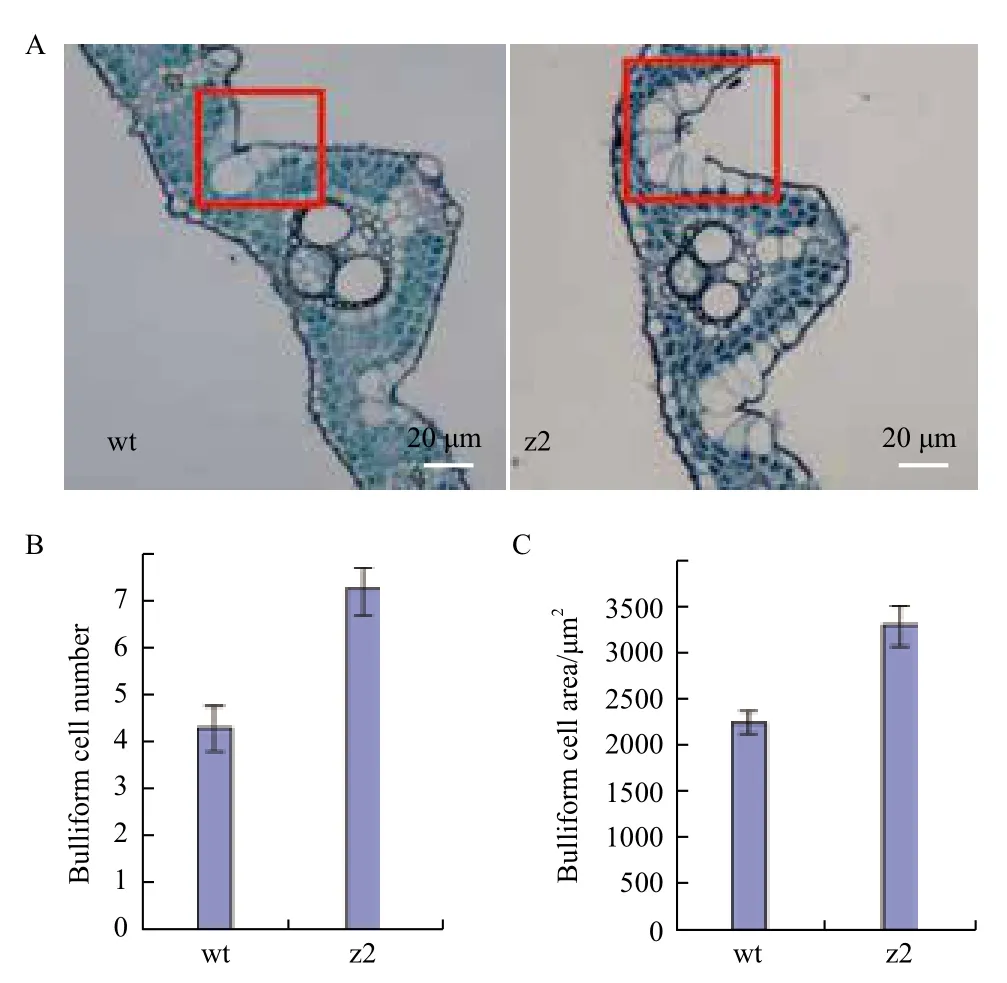
图2 成熟期野生型与z2突变体叶片石蜡切片观察
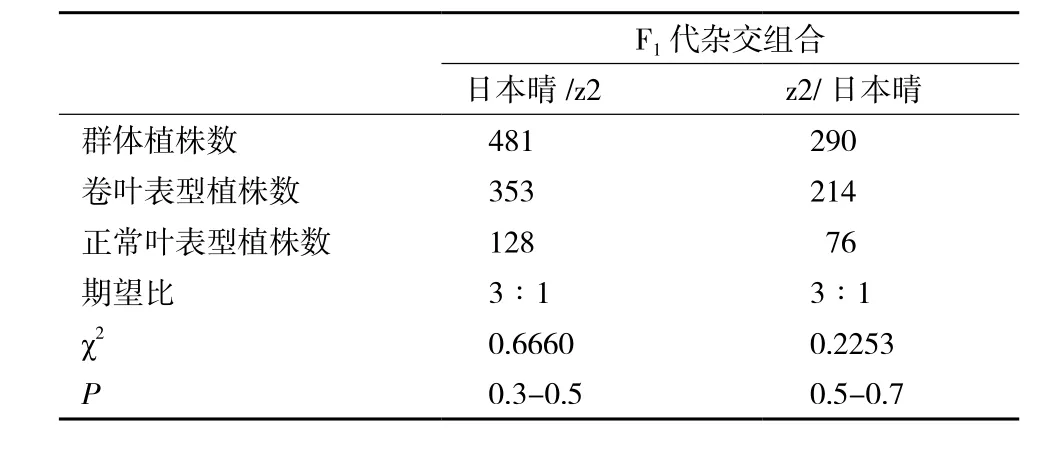
表2 F2代分离群体统计结果
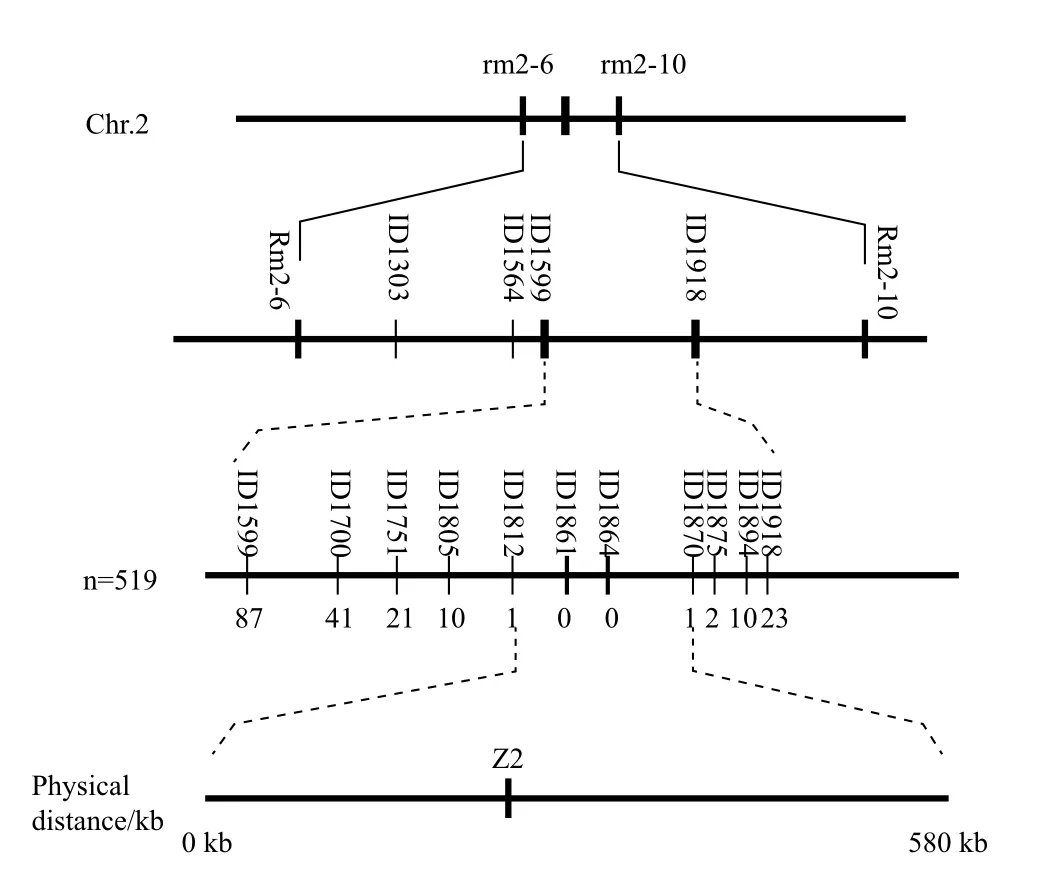
图3 z2突变基因在第2号染色体上的定位

表3 本研究开发的多态性rm和InDel标记
3 讨论
叶片是水稻进行光合作用最主要的场所,叶片的适度卷曲在水稻理想株型改良中具有重要的应用意义。在已克隆的控制卷叶的基因中,大多数属于单基因隐性遗传,还有一些卷叶性状是由数量性状基因所控制的[20],鲜有报道由显性控制的卷叶基因。目前所报道的显性卷叶基因主要有OsAGO7[21]和OsCLF1[22]。其中OsAGO7是利用T-DNA标签法分离到的,位于3号染色体,其编码一个Argnaute(AGO)家族蛋白,其中包含PAZ和PIWI保守结构域。AGO家族蛋白是RNA介导的沉默复合体(RISC)的重要组成部分[23],PAZ结构域是与miRNA或siRNA结合的区域,而PIWI结构域是负责剪切mRNA的区域[24]。在OsAGO7突变体中,有可能是由于ARF3或ARF4基因受到抑制而产生叶片内卷的性状[22]。OsCFL1也是通过T-DNA标签法分离得到的,其编码一个具有WW结构域的蛋白。在OsCFL1突变体植株中OsCFL1基因表达量约为野生型的30倍,突变体表现出叶片扭曲、内卷的性状。在水稻中过表达OsCFL1、在拟南芥中过表达OsCFL1的同源基因AtCFL1和AtCFL2,结果显示无论是水稻叶片还是拟南芥叶片其角质层都出现发育异常,而降低AtCFL1的表达则会使拟南芥叶片的角质层增厚。通过点对点酵母双杂交验证AtCFL1与AtHDG1互作,抑制AtHDG1的表达会使野生型拟南芥角质层受损,而在AtCFL1突变体中角质层的受损程度降低。进一步发现在AtCFL1过表达和AtHDG1共抑制植株中BDG与FDH基因的表达量下降,而BDG与FDH在拟南芥中是与角质层发育相关的,并且BDG与FDH的调控区含有能与AtHDG1结合的顺式作用元件L1。这就说明了造成水稻卷叶的原因是CFL1通过HDG1负调控BDG与FDH,从而导致表皮角质层的缺损[23]。在z2卷叶突变基因精细定位的区间内发现含有CFL1基因,但经过测序未发现在CFL1的读码框和上下游调控序列中有突变位点存在,因此我们认为定位z2基因可能是一个新的位点。

图4 z2突变位点与InDel1812和InDel1870分子标记连锁分析
4 结论
本实验对z2卷叶突变体进行了表型分析,其叶片外卷表型出现在分蘖期,突变体的直立度高于野生型,并且其光合作用效率也有所提高,通过石蜡切片发现z2突变体叶片泡状细胞明显增多。遗传分析表明,z2突变体卷叶表型由一对显性核基因控制。利用图位克隆的方法将z2显性卷叶突变基因定位于分子标记InDel1870与InDel1812之间,物理距离为580 kb。
[1]胡凝, 吕川根, 姚克敏, 等. 卷叶水稻的光分布模拟及适宜叶面卷曲度分析[J]. 中国水稻科学, 2008, 22(6):617-624.
[2]郎有忠, 张祖建, 顾兴友, 等. 水稻卷叶性状生理生态效应的研究Ⅱ. 光合特性、物质生产与产量形成[J]. 作物学报, 2008,30(1):883-887.
[3]Price AH, Young EM, Tomos AD. Quantitative trait loci associated with stomatal conductance, leaf rolling and heading date mapped in upland rice(Oryza sativa)[J]. New Phytol, 1997, 137(1):83-91.
[4]Li SG, He P, Wang YP, et al. Genetic analysis and gene mapping of the leaf traits in rice(Oryza sativa L. )[J]. Acta Agron Sin,2000, 26(3):261-265.
[5]Yan CJ, Yan S, Zhang ZQ, et al. Genetic analysis and gene fine mapping for a rice novel mutant rl9(t)with rolling leaf character[J]. Chin Sci Bull, 2006, 51(1):63-69.
[6]Luo ZK, Yang ZL, Zhong BQ, et al. Genetic analysis and fine mapping of a dynamic rolled leaf gene, Rl10(t), in rice(Oryza sativa L. )[J]. Genome, 2007, 50(9):811-817.
[7]Shi Y, Chen J, Liu W, et al. Genetic analysis and gene mapping of anew rolled-leaf mutant in rice(Oryza sativa L.)[J]. Sci China C Life Sci, 2009, 52(9):885-890.
[8]Luo YZ, Zhao FM, Sang XC, et al. Genetic analysis and gene mapping of a novel rolled leaf mutant rl12(t)in rice[J]. Acta Agron Sin, 2009, 35(11):1967-1972.
[9]Yu D, Wu HB, Yang WT, et al. Genetic analysis and mapping of the unilateral rolled leaf trait of rice mutant B157[J]. Mol Plant Breed, 2008, 6(2):220-226.
[10]Wang DZ, Sang XC, You XQ, et al. Genetic analysis and gene mapping of a novel narrow and rolled leaf mutantnrl2(t)in rice(Oryza sativa L. )[J]. ActaAgron Sin, 2011, 37(7):1159-1166.
[11]Wang DK, Liu HQ, Li KL. Genetic analysis and gene mapping of a narrow leaf mutant in rice(Oryza sativa L. )[J]. Chin Sci Bull,2009, 54(5):752-758.
[12]Li L, Shi ZY. Overexpression of ACL1(abaxially curled leaf 1)increased bulliform cells and induced abaxial curling of leaf blades in rice[J]. Molecular Plant, 2010, 3(5):807-817.
[13]Zhang GH, Xu Q, Zhu XD, et al. SHALLOT-LIKE1 is a KANADI transcription factor that modulates rice leaf rolling by regulating leaf abaxial cell development[J]. The Plant Cell, 2009, 21(3):719-735.
[14]Fang L, Zhao F, Cong Y, et al. Rolling-leaf14 is a 2OG-Fe(II)oxygenase family protein that modulates rice leaf rolling by affecting secondary cell wall formation in leaves[J]. Plant Biotechnology Journal, 2012, 10(5):524-532.
[15]Xiang JJ, Zhang GH, Qian Q, Xue HW. Semi-rolled leaf1 encodes a putative glycosylphosphatidylinositol-anchored protein and modulates rice leaf rolling by regulating the formation of bulliform c ells[J]. Plant Physiology, 2012, 159(4):1488-1500.
[16]Zou L, Sun X, Zhang Z, et al. Leaf rolling controlled by the homeodomain leucine zipper class IV gene Roc5 in rice[J]. Plant Physiology, 2011, 156(3):1589-1602.
[17]Wan S, Wu J, Zhang Q, et al. Activtion tagging, an efficient tool for functional analysis of the rice genome[J]. Plant Mol Biol, 2009,69(1-2):69-80.
[18]Murray MG, Thompson WF. Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Res, 1980, 8(19):4321-4325.
[19]Lander ES, Green P, Abrahamson J, et al. MAPMAKER:an interactive computer package for constructing primary genetic linkage maps of experimental and natural populations[J]. Genomics, 1987, 1(2):174-181.
[20]邵元健, 陈宗祥, 张亚芳, 等. 一个水稻卷叶主效QTL的定位及其物理图谱的构建[J]. 遗传学报, 2005, 32(5):501-506.
[21]Shi Z, Wang J, Wan X, et al. Over-expression of rice OsAGO7 gene induces upward curling of the leaf blade that enhanced erect-leaf habit[J]. Planta, 2007, 226(1):99-108.
[22]Wu R, Li S, He S, et al. CFL1, a WW domain protein, regulates cuticle development by modulating the function of HDG1, a class IV homeodomain transcription factor, in rice and Arabidopsis[J]. The Plant Cell, 2011, 23(9):3392-3411.
[23]Carmell MA, Xuan ZY, Zhang MQ, Hannon GJ. The Argonaute family:tentacles that reach into RNAi, developmental control,stem cell maintenance, and tumorigenesis[J]. Genes Dev, 2002,16(21):2733-2742.
[24]Lingel A, Sattler M. Novel modes of protein-RNA recognitionin the RNAi pathway[J]. Curr Opin Struct Biol, 2005, 15(1):107-115.
(责任编辑 马鑫)
Genetic Analysis and Gene Mapping of a Dominant Rolled Leaf Mutant z2 in Rice
Zhang Longdi1Wang Yanwei2Zhang Zhiguo1Wu Jinxia1
(1. Biotechnology Research Institute,Chinese Academy of Agricultural Science,Beijing 100081;2. Capital Normal University,Beijing 100048)
Moderate rolled leaf is significant in ideotype breeding of rice. An outward rolled leaf mutant z2 was discovered from the rice T-DNA insertion mutant library, and its leaves became curly during tillering stage. Compared with the wild type, there was no significant difference in its main agronomic traits, and its photosynthetic was more efficient. Paraffin sections showed that the number of bulliform cells(8-9)in the mutant was higher than that in the wild type(4-5). Through successive selfing, phenotype of z2 was stable and was controlled by a pair of dominant nuclear genes. We made the combination of z2/Dular to establish F2 mapping population, and used map-based cloning method to locate the gene on rice chromosome 2 between maker InDel1812 and InDel1870 with 580 kb physical distance.
rice(Oryza sativa L.);rolled leaf mutant;genetic analysis;map-based cloning
10.13560/j.cnki.biotech.bull.1985.2015.06.014
2015-02-04
中国、巴西作物生物技术与种质资源联合研究项目(2014DFA31550)
张龙弟,男,硕士研究生,研究方向:植物分子生物学与基因工程;E-mail:zld2011@126.com
吴金霞,女,副研究员,研究方向:植物功能基因组学;E-mail:wujinxia@caas.cn

