染料木素抑制人胰腺癌细胞株PANC-1细胞增殖机制的研究
马志亮崔啸晨李夏青王丽凤苑洪莲卫建平安峡尹彩虹王志茹
染料木素抑制人胰腺癌细胞株PANC-1细胞增殖机制的研究
马志亮1崔啸晨1李夏青2王丽凤3苑洪莲4卫建平5安峡6尹彩虹6王志茹1
目的 探讨不同浓度染料木素对胰腺癌细胞作用及其抑癌基因表达的研究。方法 本实验共分实验组(80,120,160,200 μmol/L)的染料木素、空白对照组(PBS)和标准对照(吉西他滨)。各组培养基处理细胞12,24,36,48,60 h后,细胞计数试剂盒(CCK-8)法检测人胰腺癌细胞株PANC-1在染料木素作用下的增殖活性;流式细胞术检测人胰腺癌细胞株PANC-1在染料木素木素作用下的凋亡细胞百分率;用逆转录-聚合酶连反应(RTPCR)方法测定P53及P21抑癌基因的表达;Western-blot法检测抑癌基因P53和P21的蛋白表达水平。细胞凋亡与细胞基因mRNA采用的是LSD法,细胞增殖数据采用的是配对t检验。结果 流式细胞术显示,人胰腺癌细胞株PANC-1处理后60 h时在不同浓度(80,120,160,200 μmol/L)的染料木素作用下细胞凋亡率分别为(3.72 ± 1.58)%、(35.98± 3.76)%、(51.36 ± 4.32)%和(64.10 ± 2.09)%。吉西他滨(gemcitabine, GEM)组为(43.45 ± 5.28)%,不同浓度染料木素组与标准对照组间比较差异有统计学意义(均P < 0.01);细胞增殖效果:160 μmol/L与200 μmol/L、120 μmol/L与200 μmol/L、200 μmol/L与吉西他滨组之间比较,均有统计学意义(P < 0.01),而160 μmol/L与吉西他滨组比较无统计学意义(P > 0.05);Western-blot检测蛋白水平显示160 μmol/L和200 μmol/L染料木素相对于空白对照能够明显的增强抑癌基因P21和P53的蛋白水平的表达,相对于标准组没有明显的差异。结论 染料木素可以抑制人胰腺癌细胞株PANC-1增殖,并且初步探索了这种抑制作用表现出浓度及时间依赖性。
胰腺肿瘤; 染料木素; 吉西他滨; 细胞凋亡
随着人们生活方式与饮食结构的急剧变化,胰腺癌的发病率呈明显上升趋势并且日益年轻化[1]。由于其具有病情进展快和缺乏特定症状的特征,其早期诊断很大程度上相当困难, 而且治疗效果差,预后不良[2]。因此化疗成为其治疗主要措施,鉴于目前临床所应用化疗药物作用有限且副作用给患者带来巨大痛苦,如何提高胰腺癌的化疗疗效仍是目前临床亟需解决的难题,寻找天然植物抗癌成分成了研究的热点之一[3-4]。目前已有研究表明染料木素(Genistein,Gen)在非小细胞型肺癌、胃癌、宫颈癌、乳腺癌与卵巢癌等疾病有重要意义并且取得一定的临床疗效,但对恶性肿瘤中死亡率较高的胰腺癌研究较少。鉴于此,本实验通过流式细胞仪、Cell Counting Kit-8(CCK-8试剂盒)法、RT-PCR和Western-blot对染料木素抗人胰腺癌细胞株PANC-1的体外增殖进行研究,以期为胰腺癌的临床治疗提供数据支持及理论依据,进一步提高胰腺癌患者的中位生存率和明显改善其生存质量。
材料与方法
一、材料
人胰腺癌细胞株PANC-1购自中国科学院典型培养物保藏委员会细胞库;DMEM培养液和胎牛血清购自美国Gibco公司;染料木素购自生工生物工程(上海)有限公司。染料木素用二甲基亚砜(DMSO)配制成浓度为10 mmol/L的原液并储存于-20℃冰箱,实验时根据需要用DMEM培养液将原液稀释成不同浓度的工作液;细胞计数试剂盒(CCK-8)购自日本同仁化学研究所;抗总蛋白激酶B(t-Akt)、磷酸化蛋白激酶B(P-Akt)、甘油醛-3-磷酸脱氢酶一抗购自博士德公司(武汉),辣根过氧化物酶标记的二抗购于博士德公司。
二、方法
1.细胞培养:人胰腺癌细胞株PANC-1用含有10%胎牛血清、100 U/ml青霉素和100 mg/ml链霉素的DMEM培养基,置于37℃、5%CO2的饱和湿度细胞培养箱中培养,每2 d换液1次,待细胞融合达到80%时,以1:2比例进行传代,取第2代生长良好的细胞用于实验。(1)不同浓度染料木素实验组:培养基中染料木素的浓度为80,120,160,200 μmol/L。(2)对照组分为2组,标准对照采用吉西他滨(gemcitabine,GEM),DMEM培养液稀释为浓度2%;空白对照组(C组)加等量的PBS液。
2.流式细胞仪:收集分别培养48 h的对照组和试验组细胞各l × 106个,0.01 mmol/L PBS洗2 ~ 3次,加500 μl PBS重悬细胞,加入AnnexinV-FITC和PI(BD公司)各5 μl,37℃避光水浴30 min,离心半径13.5cm,1 400 r/min离心5 min,加入1 × binding Buffer(BD公司)500 μl混悬,流式细胞仪检测细胞凋亡细胞百分率。
3.CCK-8法检测细胞增殖活性并绘制生长曲线:常规消化细胞,调整细胞密度至1 × 104个/ml接种于96孔板,每孔150 μl。实验设含正常细胞培养液的对照组,4个加不同浓度染料木素,染料木素溶于细胞培养液,浓度分别为80,120,160,200 μmol/L的试验组,每组8个复孔。培养24 h后,每孔加入CCK-8试剂15 μl,继续培养4 h,酶标仪测定450 nm波长的A值。
4.RT-PCR检测P21和P53基因表达:按材料与方法2中的方法取培养48 h的细胞并分组后,Trizol(Invitrogen公司)碱性裂解法提取细胞总的RNA,NanodroP2000检测RNA的浓度和纯度。取2 μl RNA按照逆转录试剂盒(Takara公司)说明书逆转录合成cDNA,以cDNA为模板,SYBR Green(Takara公司)进行PCR反应以扩增P21和P53基因,选择肌动蛋白(β-actin)作为内参照,引物序列P21上游引物:5'-CGAAGTCAGTTCCTTGTGG-3',下游引物5'-TGAGACTAAGGCAGAAGATGTA-3';P53上游引物5'-ACCCTGGGCAACCAGCCCTGT-3',下游引物5'-ACAGGGCTGGTTGCCCAGGGT-3';β-actin上游引物5'-ACACTGTGCCCATCTACGAGG-3',下游引物5'-AGGGGCCGGACTCGTCATACT-3'。PCR反应条件:95℃预变性180 s,95℃变性30 s,60℃退火30 s及72℃延伸45 s,共扩增40个循环,72℃在延伸10 min。Q5(Bio-RAD公司)PCR仪记录Ct值。
5.Western-blot检测蛋白水平:细胞培养及分组同前,每组于培养48 h后,收集约1 × 107个细胞,按BCA法说明书(碧云天公司)以蛋白提取试剂盒提取细胞总蛋白,并定量,煮沸5 min进行电泳并转膜。然后将膜置于5%脱脂奶粉中封闭1 h后,加入所需一抗4℃孵育过夜。TBST洗膜后加入辣根过氧化物酶标记的羊抗兔二抗,室温结合2 h,暗室显影,并以β-actin为内参进行定量分析。

图1 流式细胞术检测染料木素对人胰腺癌细胞株PANC-1凋亡的影响
三、统计学分析方法
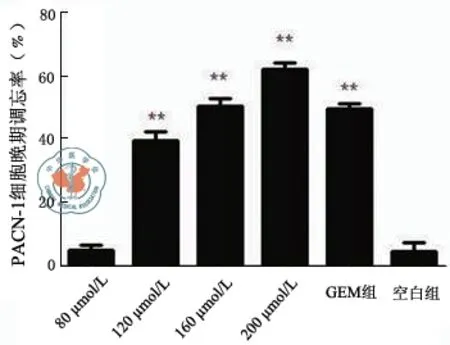
图2 流式细胞术检测染料木素对人胰腺癌细胞株PANC-1凋亡的影响
结 果
1.流式细胞仪:如图1和图2所示,C组(空白对照组)细胞集中于LL象限(82.22%);GEM组集中于LL(50.27%)和LR(43.45%)象限;在染料木素组中,80 μmol/L比较接近C组,82.42%细胞集中于LL象限;120 μmol/L主要分布于LL(49.22%)和LR(35.95%),但LR总体偏少;160 μmol/L细胞集中于LL(36.70%)和LR(51.36%);200 μmol/L大部分细胞分布在LR(64.10%),LL较少(4.44%)。有FCM结果可以看出,4个染料木素分组中,80 μmol/L对细胞增殖抑制效果并不明显,而120 μmol/L和160 μmol/L最接近GEM组的效果,200 μmol/L晚期凋亡细胞占大部分。可见染料木素的作用有明显的浓度依赖性。
2.CCK-8细胞增殖检测:如表1所示,C组细胞增殖数据最好,随着染料木素的浓度增高,细胞增殖效果变差,在80 μmol/L、120 μmol/L和160 μmol/L逐级递减;36 h内200 μmol/L较120 μmol/L、160 μmol/L曲线总体较为接近,与GEM组亦较为接近;36 h后80 μmol/L效果变差,200 μmol/L较160 μmol/L稍差,160 μmol/L较GEM组较为接近;总体观察160 μmol/L、200 μmol/L与GEM组较为接近。如表1所示,分别对160 μmol/L与200 μmol/L、120 μmol/L对200 μmol/L、160 μmol/L对GEM组、200 μmol/ L对GEM组通过SPSS 13.0 进行配对样本t检验,结果显示160 μmol/L对GEM组无统计学差异(P = 0.067),而其余3组均P < 0.05;针对36 h以内的数据,统计发现120 μmol/L对GEM组P < 0.05,而200 μmol/L与GEM组差异无统计学意义(P = 0.051)。根据以上结果,笔者认为染料木素总体呈浓度依赖性和时间依赖性,其中36 h内200 μmol/L效果与GEM组较为接近,但160 μmol/L总体效果最好,且与GEM组最为接近。
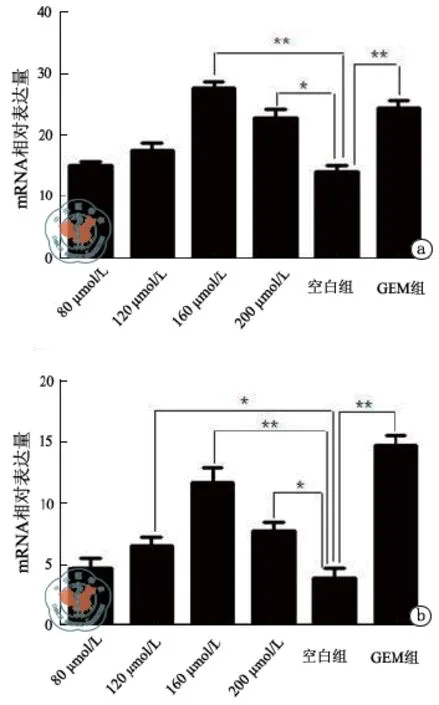
图3 RT-PCR检测P21基因和P53基因的mRNA的表达量
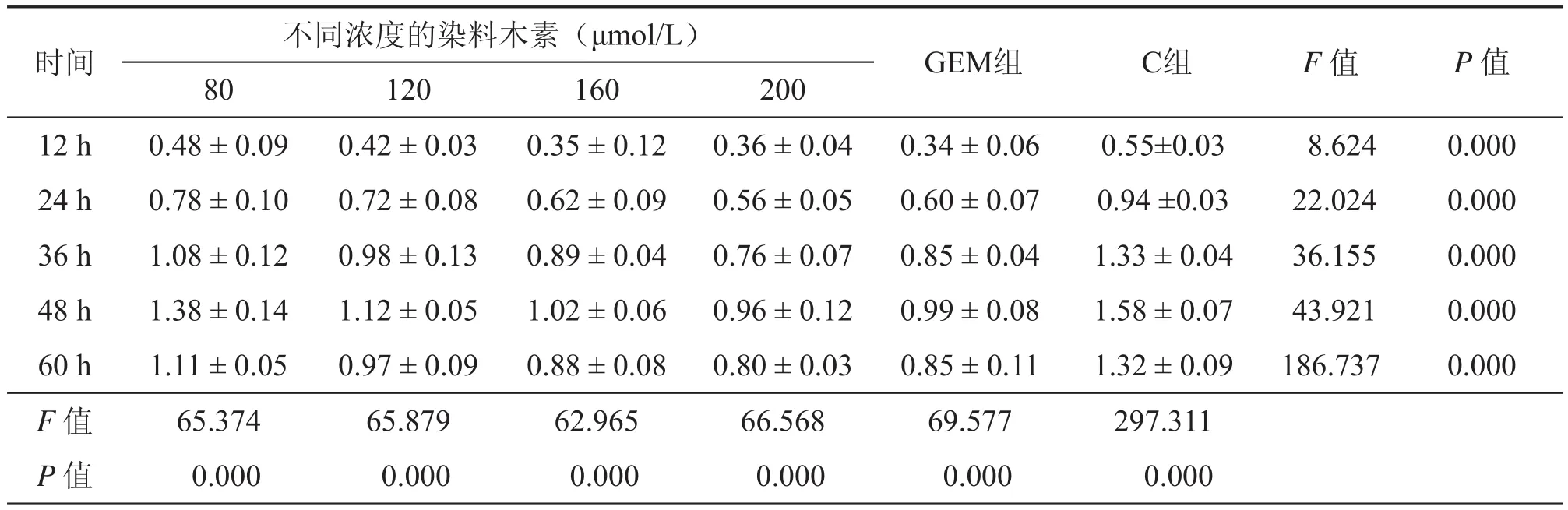
表1 不同浓度的染料木素不同时间细胞增殖(A)值(λ = 450 nm)
3.半定量RT-PCR结果:P21抑癌基因mRNA表达水平:160 μmol/L、GEM组与空白组比差别有统计学意义(P < 0.01),200 μmol/L与空白组比差别有统计学意义(P < 0.05)。80 μmol/L、120 μmol/L组与空白组相比差别没有统计学意义(P > 0.05)。P53抑癌基因mRNA表达水平:160 μmol/L、GEM组与对照组比有统计学意义(P < 0.01),120 μmol/L、200 μmol/L与对照组比有统计学意义(P < 0.05),80 μmol/L组与空白组比较差别没有统计学意义(P > 0.05,图3)。本研究提示:160 μmol/L和200 μmol/L染料木素相对于空白对照能够明显的增强抑癌基因P21和P53的mRNA水平的表达。
4.相关蛋白的表达检测:Western-blot检测蛋白水平显示160 μmol/L和200 μmol/L染料木素相对于空白对照能够明显的增强抑癌基因P21和P53的蛋白水平的表达,相对于标准组没有明显的差异(图4)。
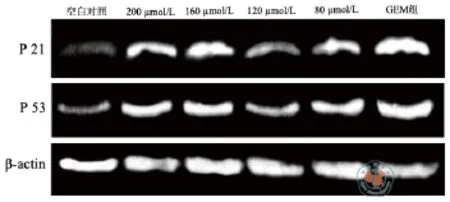
图4 P21和P53 Western-blot的检测结果
讨 论
染料木素(genistein, Gen)为植物雌激素的一种,是从大豆、三叶草等豆科植物中提取出来的异黄酮化合物,是一种天然的酪氨酸激酶,其化学结构与内源性雌激素相似,据报道能与雌激素胞膜及胞内受体结合发挥作用[5],如抗肿瘤及抗氧化等作用。流行病学研究和实验研究证实染料木素能降低前列腺癌等激素依赖型肿瘤的发生率[6],对激素依赖型肿瘤的预防和治疗有一定的疗效,而LamPe等[7]指出其与人类乳腺疾病的发生率呈负相关,同时Catterchio等通过对结直肠癌的患者进行随访,提出染料木素亦可降低其发病率[8],近期Dajas[9]和Han等[10]分别验证了此类植物激素类药物在鼻咽癌、宫颈癌等诊治中有重大意义。目前有大量文献显示染料木素对各类肿瘤细胞均有抑制作用,如乳腺癌和前列腺癌,对胰腺癌细胞研究方面则较少。该研究表明染料木素可以抑制人胰腺癌细胞株PANC-1,并且初步探索了机理。
大量研究已经证明,染料木素具有广泛的抗恶性细胞增殖作用,能诱导恶性细胞的分化,抑制细胞的恶性转化和侵袭以及肿瘤的转移[10-12]。本实验显示,通过流式细胞仪和CCK-8法表明染料木素作用具有浓度依赖性和时间依赖性,但是在低浓度时,染料木素的作用并不理想,而当浓度达到160 μmol/L以上时其流式细胞仪结果与标准对照组吉西他滨非常接近,浓度达到200 μmol/L时晚期凋亡细胞已占60%以上,CCK-8法细胞增殖的结果显示160 μmol/L的抑制效果在48 h达到最佳,整体效果最好且曲线与标准对照相近,而Western-blot结果显示染料木素对P21、P53蛋白均有明显上调作用,浓度依赖性小。鉴于此,推断浓度为160 μmol/L染料木素对胰腺癌细胞株PANC-1的抑制作用最佳,可能的机制是通过上调P21、P53蛋白而发挥作用,使染料木素对胰腺癌细胞株PANC-1体外增殖的抑制作用表现出浓度及时间依赖性,从而发挥抑制癌细胞作用。
胰腺癌是常见的并且死亡率高的消化道恶性肿瘤之一,在欧美国家,由胰腺癌所引起的死亡在所有癌症疾病中的排名为第6位,严重影响人们的生活水平[13]。而此研究为染料木素治疗胰腺癌提供可能,但其在临床治疗中的有效性、副作用以及具体的抗肿瘤机制,有待进一步的相关实验研究以及后期的临床研究证实,从而为胰腺癌的治疗提供新的空间。
1 Charles BK, Shuja A, Eddy CH. Current surgical management of Pancreatic cancer[J]. Chinese Journal of General Surgery, 2013, 22(9):1105-1113.
2 Stathis A, Moore MJ. Advanced pancreatic carcinoma: current treatment and future challenges[J]. Nat Rev Clin Oncol, 2010, 7(3):163-172.
3 Khan N, Afag F, Mukhtar H, et al. APoPtosis by dietary factors:the suicide solution for delaying cancer growth[J]. Carcinogenesis, 2007, 28(2):233-239.
4 Surh YJ. Cancer chemoPrevention with dietary Phytochemicals[J]. Nat Rev Cancer, 2003, 3(10):768-780.
5 Li YQ, Xing XH, Wang H, et al. Dose-dependent effects of genistein on bone homeostasia in rats mandibular subchondral bone[J]. Acta Pharmacol Sin, 2012,33(1):66-74.
6 Pavese JM, Krishna SN, Bergan RC. Genistein induced human prostate cancer cell detachment,invasion,and metastasis[J]. Am J Clin Nutr, 2014, 100(Suppl 1):431s-436s.
7 Lampe JW, Nishino Y, Ray RM, et a1. Plasma isofl avones and fibrocystie breast conditions and breast cancer among women in Shanghai, China[J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(2):2579-2586.
8 Cotterchio M, Boucher BA, Manno M, et a1.Dietary Phytoeatrogen intake is associated with reduced colorectal cancer risk[J]. J Nutr, 2006, 136(12):3046-3053.
9 Dajas F. Life or death: neuroprotective and anticancer effects of quercetin[J]. J EthnoPharmacol, 2012,143(2):383-396.
10 Han H, Zhong C, Zhang X, et al. Genistein induces growth inhibition and G2/M arrest in nasoPharyngeal carcinoma cells[J]. Nutr Cancer, 2010, 62(5):641-647.
11 Zhou HB, Chen JM, Cai JT, et al. Anticancer activity of genistein on implanted tumor of human SG7901 cells in nude mice[J]. World J Gastroenterol, 2008, 14(4):627-631.
12 Li Y, Sarkar FH. Inhibition of nuclear factor kappaB activation in PC3 cells by genistein is mediated via Akt signaling pathway[J]. Clin Cancer Res, 2002,8(7):2369-2377.
13 Krug S, Michl P. New developments in pancreatic cancer treatment[J]. Minerva Gastroenterol Dietol, 2012,58(4):427-443.
Genistein inhibits proliferation of PANC-1 human pancreatic cancer cells
Ma Zhiliang1, CuiXiaochen1, Li Xiaqing2, Wang Lifeng3, Yuan Honglian4, Wei Jianping5, An Xia6, Yin Caihong6, Wang Zhiru1.1Department of General Surgery,4Operation Room,5Department of Pathology,Second Hospital of Shanxi Medical University, Taiyuan 030001, China;2Department of pathophysiology, Shanxi Medical University, Taiyuan 030001, China;3Department of Pathology, Shanxi Dayi hospital, Taiyuan 030001, China;6Department of Internal Medicine, Shuozhou Central Hospital, Shuozhou 036000, China
Wang Zhiru, Email:geraldzwang@yahoo.com
Objective To explore the effects of Genistein on pancreatic cancer and the expression of tumor suppressor genes. Methods This study included experimental group(80, 120, 160, 200 μmol/L Genistein), positive control group(gemcitabine)and blank group(PBS). At the different time points(12, 24, 36, 48 and 60 h)proliferation of human pancreatic cancer cell line PANC-1 was evaluated with CCK-8 assay. Apoptotic cells were detected with FCM. Express of tumor suppressor genes P53 and P21 was evaluated using RT-PCR. Protein expression level of P53 and P21 was evaluated using Western-blot. The statistical analysis of apoptotic apoptotic and cell mRNA was the way of LSD. The statistical analysis of the proliferation activity was t test of paired sample. ResultsThe percentages of apoptotic pancreatic cancer cells were(3.72 ± 1.58)%,(35.98 ± 3.76)%,(51.36 ± 4.32)% and(64.10 ± 2.09)%60 h after treatment with different concentrations of Genistein. The percentages of apoptotic pancreatic cancer cells was 43.45 ± 5.28 for the gemcitabine group(P < 0.05). Cell proliferation wase significant different between the 160 μmol/L Genistein and 200 μmol/L Genistein, 120 μmol/L Genistein and 200 μmol/L Genistein, 200 μmol/L Genistein and gemcitabine(P < 0.05); however there was no significant difference between 160 μmol/L Genistein and gemcitabine(P > 0.05). Genistein at 160 μmol/L and 20 μmol/L could obviously increase the protein expression of tumor suppressor genes P53 and P21 compared with the blank control group(P < 0.01), however, they are not significantly different with the gemcitabine group(P > 0.05). Conclusion Genistein can inhibit the proliferation of human pancreatic cancer cell line PANC-1.
Pancreatic neoplasms; genistein; gemcitabine; cell apoptosis
2014-12-26)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2015.02.009
山西省归国留学项目(2010099)
030001 太原,山西医科大学第二医院普外科1,手术室4,病理科5;030001 太原,山西医科大学病理生理教研室2;030001 太原,山西大医院病理科3;036000 朔州,朔州市中心医院内科6
王志茹,Email:geraldzwang@yahoo.com

