总丹参多酚酸预处理对脊髓缺血再灌注损伤的保护作用
李夏静 陈瑞琦 陈旭征 曹治云 廖联明
总丹参多酚酸预处理对脊髓缺血再灌注损伤的保护作用
李夏静 陈瑞琦 陈旭征 曹治云 廖联明
目的 探讨总丹参多酚酸(TSI)对大鼠脊髓缺血再灌注损伤(SCII)的神经保护作用以及评估TSI预处理对氧化应激的影响和功能修复的作用。方法 将18只雄性SD大鼠随机分为假手术组、模型对照组、TSI(20 mg/kg)处理组,每组6只。采用夹闭左肾下腹主动脉的方法建立SCII模型,分别于再灌注6,12,24及48 h对大鼠后肢进行运动功能评分。各组大鼠再灌注48 h后,取其脊髓组织,并进行组织病理学检测和生化指标分析。药物组与对照组间运动功能评分的均值比较用非参数秩和检验(Kruskal-Wallis)进行分析,药物组与对照组间MDA,SOD,CAT,GSH-Px含量测定的均值比较采用单因素方差分析。结果 与假手术组相比,模型组脊髓组织丙二醛(MDA)的含量明显升高,从2.95 mM/mg上升到5.90 mM/mg(P = 0.023),谷胱甘肽过氧化物酶(GSH-PX)活力显著增强,GSH-PX酶活力从0.31 U/mg升高至0.78 U/mg(P = 0.001),而超氧化物歧化酶(SOD)活力、过氧化氢酶(CAT)活力明显降低;SOD酶活力从16.03 U/mg降低至8.37 U/mg(P = 0.001),CAT酶活力从1.24 U/mg降低至0.54 U/mg(P = 0.002)。动物后肢神经功能评分明显下降,于6 h时从21分降低至15.5分(P = 0.001)。预先给与动物注射TSI(20 mg/kg)后,可以降低MDA浓度,从5.90 mM/mg降为3.27 mM/mg(P = 0.0355)。抑制GSH-PX活性,从0.78 U/mg降为0.36 U/mg(P = 0.001)和提高SOD和CAT活性,SOD酶活力从8.37 U/mg升高至14.79 U/mg(P = 0.001),CAT酶活力从0.54 U/mg升高至0.89 U/mg(P = 0.043),提高动物后肢神经功能评分从15.5分升高至17分(P = 0.001),TSI组在光学显微镜下脊髓病理改变轻微,而对照组脊髓损伤较重(P < 0. 05)。结论 TSI可通过改善氧化和抗氧化系统的平衡来预防SCII。
总丹参多酚酸; 脊髓损伤; 再灌注损伤
脊髓缺血再灌注损伤(spinal cord ischemic reperfusion injury, SCII)是指去除导致脊髓缺血的因素后,虽然脊髓恢复血供,神经损伤进一步加重,甚至出现不可逆性脊髓神经元迟发性死亡的现象[1-2]。SCII是原发性脊髓损伤的继发性损害,是造成神经细胞损伤的重要因素之一。SCII常见于脊柱外科手术和胸腹部手术血管意外因素导致的脊髓缺血,常伴有四肢瘫痪和截瘫等并发症,甚至死亡。胸腹主动脉手术所致脊髓缺血的截瘫发生率高达11%~ 40%[3-4]。
SCII患者每年要耗费大量的人力、物力及医疗费用,给患者带来无尽痛苦的同时还给家庭带来沉重的负担。如何有效治疗脊髓损伤是一个极大的难题和挑战。传统预防因脊髓缺血引起截瘫的策略,包括降低全身体温,左心分流术,脊髓液引流和缺血预处理,应用抗氧化剂等,这些方法并不足以保护脊髓组织,因其复杂性和侵袭性还有可能引起额外的不利并发症[5-9]。大量研究表明缺血再灌注损伤的发生和自由基的产生有关[10-12]。文献报道丹酚酸通过清除自由基和减少自由基对机体的损伤,改善微循环状况,对机体产生保护作用[13-14]。因此,本研究观察总丹参多酚酸(total salvianolic acid, TSI)对大鼠脊髓缺血损伤的保护作用。
材料与方法
一、材料
1.实验动物:健康成年SD大鼠18只,雄性,体重280 ~ 300 g,由上海实验动物中心提供,适应性饲养7 d,每天自由饮食取水,自然光照。
2.药物与试剂:TSI由天津天士力之骄药业有限公司提供,超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)、过氧化氢酶(catalase, CAT)测试盒购自南京建成生物工程研究所,BCA蛋白测试试剂盒和尼氏体染色液购自碧云天生物技术研究所。
二、方法
(一)实验方法
将实验大鼠随机分为假手术组,模型组,总丹参多酚酸(25 mg/kg)预处理组,每组6只。大鼠采用Zivin法复制模型,禁食12 h,禁水4 h,动物腹腔注射水合氯醛(10%,3 mg/kg)进行麻醉,仰卧位固定大鼠于无菌手术台上,腹部手术区备皮,消毒,取腹正中线作切口,小心分离腹腔内组织,暴露腹主动脉,游离右肾动脉水平的腹主动脉,于右肾动脉起始处近心端用动脉夹夹闭腹主动脉,阻断血流,切口用生理盐水纱布覆盖,即造成脊髓缺血。手术期间保持37℃。然后于45 min后,松开血管夹使脊髓血供恢复,关闭腹腔,即制成脊髓缺血再灌注损伤模型[15]。假手术组大鼠分离腹主动脉至右肾动脉水平后,不夹闭腹主动脉。
TSI组于缺血前48 h,24 h,30 min,腹腔注射给药,于再灌注24 h后再次给药,其余两组分别于同时间点给与同等体积的生理盐水。
(二)标本采集和处理
于再灌注48 h后,再次麻醉动物,每组随机抽取3只开胸左心室插管至主动脉弓,右心耳剪一小口,150 ml生理盐水灌注,最终流出的液体清亮,肝脏变白,取俯卧位,行背部正中切口,逐层剥离椎旁肌,暴露出腰椎各段棘突,以咬骨钳咬断棘突及椎板,暴露至硬膜囊,眼科剪逐一剪断脊神经根,分离出L2-6节段脊髓组织,快速取下脊髓标本,标记后迅速放入-80℃冰箱保存。每组剩余3只,在用生理盐水灌注后,再用相同体积4%的多聚甲醛灌注,取L4-5段脊髓组织,于4%多聚甲醛中固定48 h,包埋,切片备用。
(三)观察指标和检测方法
1.运动功能评分:分别于再灌注6,12,24,48 h,采用Basso Beattie Bresnahan(BBB)运动功能评分法对后肢运动功能进行评估。BBB评分标准将大鼠后肢运动分为22个等级。后肢全瘫为0分,完全正常为21分,两者之间根据功能分别定为1 ~ 20分,其基本内容为:关节活动的数目和范围,负重程度和前后肢协调性,前后爪和尾部的活动情况。
2.氧化产物MDA含量检测:取-80℃保存的脊髓组织,准确称取一定重量的组织,按照重量体积比1:9的比例添加匀浆介质生理盐水,制成10%的组织匀浆,以硫代巴比妥酸法测定脊髓MDA含量,根据BCA试剂测试说明书测定组织匀浆的蛋白浓度。
3.抗氧化酶活力的测定:应用上述制备好的组织匀浆,分别测定脊髓组织内SOD、GSH-PX、CAT的活力,分别按照试剂盒说明书进行操作和计算。
4.脊髓组织形态学观察:将固定于4%多聚甲醛中的脊髓组织,无水酒精脱水,石蜡包埋,横断面切成4 μm薄片,行苏木素-伊红染色和尼氏体染色,光镜下观察。
三、统计学分析方法
采用SPSS18.0软件进行统计分析,MDA,SOD,CAT,GSH-Px的含量测定及运动功能评分的数据用±s表示。药物组与对照组间运动功能评分的均值比较用非参数秩和检验(Kruskal-Wallis)进行分析,药物组与对照组间MDA, SOD,CAT,GSH-Px含量测定的均值比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
结 果
1.BBB运动功能评分结果:分别对假手术组,模型组,TSI药物预处理组大鼠再灌注6,12,24和48 h的后肢进行运动功能评分。与假手术组(21分)相比,模型组大鼠评分显著降低,并于再灌注6 h时从21分降为最低15.5分(P = 0.001),而药物处理组相对于模型组大鼠而言,评分相对较高,从15.5分升高至17分(P = 0.001),差异有统计学意义,说明药物对大鼠有神经保护作用(图1)。
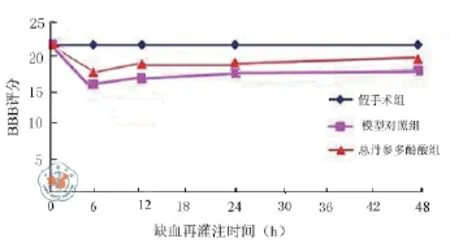
图1 TSL对大鼠SCII后大鼠后肢BBB评分的比较,评分为每组6只大鼠的平均值
2.脊髓组织内MDA含量检测结果:SCII组动物在再灌注48 h后,脊髓组织内MDA含量显著增加,即从2.95 mM/mg上升到5.90 mM/mg(P = 0.023)。TSI能一定程度的预防缺血再灌注损伤大鼠脊髓组织内MDA含量的增加,使MDA从5.90 mM/mg降为3.27 mM/mg(P = 0.035,图2)。
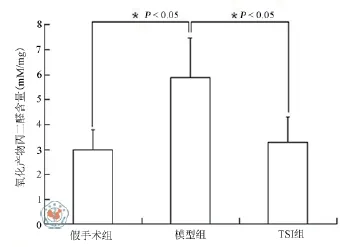
图2 TSL对大鼠SCII后MDA水平的影响,数值为每组6只大鼠的平均值,*与对照组相比(P < 0.05)
3.脊髓组织内抗氧化酶活性的检测结果:与假手术组大鼠相比,缺血再灌注损伤48 h后,模型组大鼠的抗氧化酶SOD和CAT活性显著下降,SOD酶活力从16.03 U/mg降低至8.37 U/mg(P = 0.001),CAT酶活力从1.24 U/mg降低至0.54 U/mg(P = 0.002),表明缺血再灌注损伤后动物体内的氧化应激反复增强。TSI处理能恢复SOD和CAT的活力,SOD酶活力从8.37 U/mg升高至14.79 U/mg(P = 0.001),CAT酶活力从0.54 U/mg升高至0.89 U/mg(P = 0.043)。相反,SCII能够诱导GSH-Px酶的活力,使GSH-PX酶活力从0.30 U/mg升高至0.78 U/mg(P = 0.001),而TSI能有效的抑制GSH-Px酶活力的增强,使其从0.78 U/mg降为0.36 U/mg(P = 0.001)。(图3a、3b、3c)。
4.脊髓组织形态学观察结果:形态学观察结果表明,SCII 48 h后,脊髓神经元肿胀,局部充血水肿,甚至出现严重的空泡化。HE染色可见假手术组细胞结构均匀,没有空泡化,对照组白质出现明显的空泡化,而药物干预后能够降低白质的空泡化程度。尼氏体染色后可见假手术组的神经细胞形态和灰质结构均正常,模型组的神经细胞数量明显较假手术组少,而且出现严重的空泡化,TSI组的正常神经元细胞的数量比模型组明显增加(图4,5)。

图3 TSI对大鼠SCII后SOD(3a)、CAT(3b)和GSH-Px(3c)活力的影响,数值为每组6只大鼠的平均值,**与对照组相比(P < 0.01),*与对照组相比(P < 0.05)

图4 TSI对大鼠SCII后大鼠脊髓HE染色结果(生物显微镜,×100)
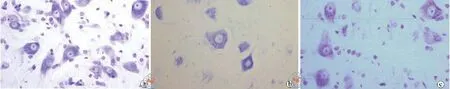
图5 TSI对大鼠SCII后大鼠脊髓尼氏体染色结果(×200)
讨 论
脊髓损伤在现代社会的发病率和致残率呈现出逐年上升的趋势。因此,如何保护脊髓,促进脊髓损伤的恢复,成为国内外学者研究的热点。近年来越来越多的研究表明微循环障碍及缺氧作用是引起SCII的重要诱因[16-18]。为了改善微循环障碍及缺氧情况,使损伤的脊髓得到恢复进而保护脊髓,国内外学者做了大量关于脊髓缺血的模型,并试图寻找合理有效的药物帮助其恢复。大鼠肾动脉的阻断模型由于很好的模拟了SCII后脊髓组织及运动功能的变化而被广泛的应用于SCII的模型研究。
丹参中的有效成分可通过抑制脂质过氧化反应,保护抗氧化酶的活性,从而介导神经保护作用。丹参水溶液的提取物总丹参多酚酸中,含量最高的两个成分丹酚酸A和丹酚酸B活性最强,对脂质过氧化引起的细胞膜损伤有明显的保护作用。丹酚酸A对心肌缺血再灌注损伤具有保护作用,也具有抗氧化、抗凝、抗血栓和抗炎等药理作用[19-22]。付军等[23]研究表明,总丹参多酚酸B能够降低脊髓缺血再灌注导致的神经损伤和氧化应激反应。
TSI能够降低缺血再灌注造成的神经损伤,可能是因为TSI的抗氧化作用。氧化应激反应的发生是因为在缺血再灌注过程中机体产生的氧自由基、过氧根离子和超氧化物等氧化产物不能及时被清除导致氧化和抗氧化系统不能平衡[24-25]。SOD具有特殊的生理活性,是生物体内清除自由基的首要物质。它可对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞。CAT可促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,它能催化GSH变为GSSG,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。研究表明,缺血再灌注过程中产生的自由基等过氧化物能够导致器官的功能受损[26-27]。本研究表明TSI能够降低脊髓匀浆中脂质过氧化反应产物MDA的水平,增强SOD和CAT酶的活力,降低GSH-Px酶的活力并改善脊髓的神经和运动功能,并能缓解病理学损伤。
总之,本研究结果提示TSI可能是通过减少氧化应激反应保护大鼠的神经功能。总丹参多酚酸的具体作用机制还有待于进一步研究。
1 Allen AR. Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal column: preliminary report[J]. JAMA, 1911,57(11):878-880.
2 Baptiste DC, Fehlings MG. Phamacological approaches to repair the injured spinal cord[J]. J Neurotrauma, 2006,23(3-4):318-334.
3 Crawford ES, Rubio PA. Reappraisal of adjuncts to avoid ischemia in the treatment of aneurysms of descending thoracic aorta[J]. J Thorac Cardiovasc Surg, 1973,66(5):693-704.
4 Svensson LG, Crawford ES, Hess KR, et al. Experience with 1509 patients undergoing thoracoabdominal aortic operations[J]. J Vasc Surg, 1993, 17(2):357-370.
5 Saito T, Tsuchida M, Umehara S, et al. Reduction of Spinal Cord Ischemia/Reperfusion Injury with Simvastatin in Rats[J]. Anesth Analg, 2011, 113(3):565-571.
6 Cassada DC, Tribble CG, Long SM, et al. Adenosine A2A agonistreduces paralysis after spinal cord ischemia: correlation with A2A receptor expression on motor neurons[J]. Ann Thorac Surg, 2002, 74(3):846-850.
7 Böckler D, Kotelis D, Kohlhof P, et al. Spinal cord ischemia after endovascular repair of the descending thoracic aorta in a sheep model[J]. Eur J Vasc Endovasc Surg, 2007, 34(4):461-469.
8 Koçogullari CU, Becit N, Erkut B, et al. Prevention of reperfusion injury of the spinal cord in aortic surgery: an experimental study[J]. Surg Today, 2008, 38(3):237-244.
9 Fu Q, Zhou Z, Li X, et al. Protective effect of adenosine preconditioning against spinal cord ischemia-reperfusion injury in rats[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014,34(1):92-95.
10 Tu Q, Cao H, Zhong W, et al.Atorvastatin protects against cerebral ischemia /reperfusion injury through antiinfl ammatory and antioxidant effects[J]. Neural Regen Res,2014, 9(3):268-275.
11 Ren X, Akiyoshi K, Vandenbark AA, et al. Programmed death-1 pathway limits central nervous system infl ammationand neurologic deficits in murine experimental stroke[J]. Stroke, 2011, 42(9):2578-2583.
12 Miyazaki T, Kimura Y, Ohata H, et al. Distinct effects of tissue-type plasminogen activator and SMTP-7 on cerebrovascular inflammation following thrombolytic reperfusion[J]. Stroke, 2011, 42(4):1097-1104.
13 Emmez H, Yildirim Z, Kale A, et al. Anti-apoptotie and neui-protective effects of α-lipoic acid on spinal cord ischemia-reperfusion injury rabbits[J]. Acta Neumchir,2010, 152(9):1591-1600.
14 Cheng B, Wang W, Lin L, et al. The change of the spinal cord ischemia-reperfusion injury in mitochondrial passway and the effect of the Ginkgo biloba extract's preconditioning interventin[J]. Cell Mol Neurobiol, 2011,31(3):415-420.
15 Zhang L, Liu ZB, Li CZ, et al. Establishment and identification of spinal cord ischemia/reperfusion injury models by vessel cast technique and digital subtraction angiography[J]. Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu, 2007, 11(40):8193-8195.
16 Pryor J, Shi R. Electrophysiological changes in isolated spinal cord white matter in response to oxygen deprivation[J]. Spinal Cord, 2006, 44(11):653-661.
17 Allan DC. Spinal cord ischemia complicating aortic surgery[M]. Vascular Surgery:The Theory and Practice,Appleton & Lange, 1996:1402-1425.
18 Peasley MA, Shi R. Resistance of isolated mammalian spinal cord white matter to oxygen-glucose deprivation[J]. Am J Physiol Cell Physiol, 2002, 283(3):980-989.
19 Cao W, Guo XW, Zheng HZ, et al. Current progress of research on pharmacologic actions of salvianolic acid B[J]. Chin J Integr Med, 2012, 18(4):316-320.
20 Chen T, Liu W, Chao X, et al. Salvianolic acid B attenuates brain damage and infl ammation after traumatic brain injury in mice[J]. Brain res bull, 2011, 84(2):163-168.
21 Fan H, Yang L, Fu F, et al. Cardioprotective effects of salvianolic acid A on myocardial ischemia-reperfusion injury in vivo and in vitro[J]. Evid Based complement altern medeCAM, 2012, 2012:508938.
22 Tang M, Feng W, Zhang Y, et al. Salvianolic acid B improves motor function after cerebral ischemia in rats[J]. Behav pharmacol, 2006, 17(5-6):493-498.
23 Fu J, PhD, Fan HB, et al. Salvianolic acid B attenuates spinal cord ischemia-reperfusion-induced neuronal injury and oxidative stress by activating the extracellular signalregulated kinase pathway in rats[J]. J Surg Res, 2014,188(1):222-230.
24 Paller MS, Hoidal JR, Ferris TF. Oxygen free radicals in ischemic acute renal failure in the rat[J]. J Clin Invest,1984, 74(4):1156-1164.
25 Burns AT, Davies DR, McLaren AJ, et al. Apoptosis in ischemia/reperfusion injury of human renal allografts[J]. Transplantation, 1988, 66(7):872-876.
26 Kleikers PW, Wingler K, Hermans JJ, et al. NADPH oxidases as a source of oxidative stress and molecular target in ischemia/reperfusion injury[J]. J Mol Med (Berl),2012, 90(12):1391-1406.
27 Chen T, Fei F, Jiang XF, et al. Down-regulation of Homer1b/c attenuates glutamate-mediated excitotoxicity through endoplasmic reticulum and mitochondria pathways in rat cortical neurons[J]. Free Radic Biol Med, 2012,52(1):208-217.
Protective effect of pretreatment with salvianolic acids on spinal cord ischemia-reperfusioninjury in rats
Li Xiajing, Chen Riqi, Chen Xuzheng, Cao Zhiyun, Liao Lianming. Fujian Academy of Integrative Medicine, Fujian University of Traditional Chinese Medicine, Fuzhou 350112, China
Liao Lianming, Email:llm@fjtcm.edu.cn
Objectives The aim of this study was to investigate the neuroprotective effects of total salvianolic acids on spinal cord ischemia/reperfusion injury (SCII) in the rat and to assess the effects of salvianolic acids treatment on oxidative stress as well as functional recovery. Methods Eighteen adult male SD rats were randomly assigned to either sham,vehicle, or TSI (20 mg/kg) groups (n = 6 per group). Spinal cord ischemia was induced by infrarenal aortic occlusion followed by 48 h of reperfusion. Hind limb motor function was assessed with Tarlov grades at 6, 12, 24 and 48 hours after reperfusion. Spinal cord tissues wereharvested at 48 h after SCII. Histopathological and biochemical examinations were performed. The Kruskal-Wallis one-way analysis of variance by ranks was used for testing hind limb motor function. Differences for malondialdehyde (MDA), gluthatione peroxidase (GSH-Px),superoxide dismutase (SOD) and catalase (CAT) levels were tested using one-way analysis of variance. Results Compared with the sham-operated rats, the vehicle-treated SCII group showed significantly higher malondialdehyde(MDA)levels(2.95 mM/mg vs 5.90 mmM/ mg, P =0.023) and increased gluthatione peroxidase(GSH-Px)activity(0.31 U/mg vs 0.78 U/mg, P =0.001). Superoxide dismutase(SOD)(16.03 U/mg vs 8.37 U/mg, P =0.001)and catalase (CAT)(1.24 U/mg vs 0.54 U/mg, P =0.002) activities were significantly reduced following SCII; Administration of TSI before and after SCII could reverse this trend. Furthermore, the percents of histological positive cells were lower in the TSI-treated group compared with the vehicle-treated group(P < 0.05). Conclusions These results suggest that TSI reduces spinal cord oxidative injury and facilitates repair following SCII by improving oxidant and anti-oxidant balance.
Total salvianolic acid; spinal cord injury; reperfusion injury
2015-01-30)
(本文编辑:陈媛媛)
10.3877/cma.j.issn.2095-1221.2015.02.007
350108福州,福建中医药大学中西医结合研究院肿瘤研究所
廖联明,Email:llm@fjtcm.edu.cn

