肝动脉化疗栓塞联合粒子植入治疗肝癌自发性破裂出血的临床研究
刘德鑫, 王 伟, 李新丰, 叶超平, 赖清泉, 李伯义, 李 平
·临床研究Clinical research·
肝动脉化疗栓塞联合粒子植入治疗肝癌自发性破裂出血的临床研究
刘德鑫,王伟,李新丰,叶超平,赖清泉,李伯义,李平
目的探讨肝动脉化疗栓塞(TACE)联合粒子植入治疗肝癌自发性破裂出血的临床疗效。方法50例肝癌自发性破裂出血患者分为单纯组(20例)和联合组(30例),联合组行急症肝动脉栓塞术(TAE)→125I放射性粒子植入→TACE术序贯治疗,单纯组急症TAE术→TACE序贯治疗。治疗1个月后患者均接受彩色多普勒超声、CT检查并比较两组患者AFP水平变化、肿瘤缩小率、1、2年生存率和不良反应。结果联合组AFP正常率、肿瘤缩小率和1、2年生存率分别为85.7%、90%、90%、66.6%,明显高于单纯组的33.3%、65%、55%、30%(均P<0.05);而不良反应方面,两组比较,差异无统计学意义(P>0.05)。结论TACE联合粒子植入治疗肝癌自发性破裂出血患者,可充分发挥其优势,明显增加治疗效果,并延长患者的生存期。
肝细胞癌;破裂,自发性;肝动脉化疗栓塞;125I放射性粒子
肝癌自发性破裂出血是肝癌严重而病死率高的并发症,其发生率为5%~26%,病死率达33%~67%[1-2]。目前较多学者报告肝动脉栓塞术(TAE)治疗肝癌自发性破裂出血疗效确切[3-6],但是单纯应用TAE术治疗肝癌自发性破裂出血,部分乏血管性肝癌不能有效控制。2007年1月—2013年2月,我院尝试用肝动脉化疗栓塞(TACE)联合B超或CT引导下将放射性粒子植入(联合组)治疗因各种原因不能手术切除的肝癌自发性破裂患者30例,并与同期单纯行TAE联合TACE(称单纯组)治疗不能手术切除的肝癌自发性破裂患者20例进行比较,报道如下。
1 材料与方法
1.1临床资料
2007年1月—2013年2月共急诊收治各种原因不能手术切除的肝癌自发性破裂患者50例,男41例,女9例,年龄为28~75岁,平均50岁。所有患者腹腔穿刺均抽出不凝血,检查血AFP水平并经CT和(或)MRI、彩色多普勒超声(彩超)、术中肝动脉造影等检查确诊为肝癌自发性破裂出血。根据治疗方法的不同将患者随机分为两组。单纯组:20例接受急症TAE术→TACE序贯治疗;联合组:30例接受急症TAE术→125I放射性粒子植入(CT或彩超引导下)→TACE术序贯治疗。两组的临床资料比较见表1。
1.2方法
1.2.1治疗方法
1.2.1.1单纯组治疗:急症TAE术序贯TACE术治疗。急症TAE术方法:进行各项术前准备后,经股动脉采用改良Seldinger法插管,送入1支5F RH导管进入肝总动脉造影,若发现肝动脉变异等情况,则必要时行肠系膜上动脉或胃左动脉或双膈下动脉或右肾动脉或右胸廓内动脉造影,明确肝肿瘤滋养动脉及肝肿瘤破裂出血动脉,再送入1支微导管超选至肝肿瘤滋养动脉及肝肿瘤破裂出血动脉,即注入 38%超液态碘化油10~30 ml乳剂及明胶海绵颗粒状碎块和(或)条状栓塞,直至肝总动脉造影示肝肿瘤滋养动脉及肝肿瘤破裂出血动脉已完全栓塞为止。在出血控制后3~4周后再行TACE术,TACE术方法同TAE术,只是在肝肿瘤滋养动脉多注入5-Fu 750~1 250 mg,艾恒100~200 mg行动脉灌注化疗和表阿霉素40~60 mg或丝裂霉素10~20 mg与38%碘化油10~20 ml乳剂行肝肿瘤滋养动脉栓塞。2、3次TACE术为一个疗程,每次间隔1~2个月。

表1 单纯组和联合组的临床资料
1.2.1.2联合组治疗:急症TAE术,1~2周后行125I放射性粒子植入(CT或彩超引导下)和序贯TACE术治疗。TAE术方法同单纯组;125I放射性粒子植入治疗,放射性粒子植入治疗2~3周后再行TACE术。粒子选用宁波君安药业生产的放射性核素125I粒子,粒子长4.5 mm,外径0.8 mm,半衰期 59.6 d。粒子穿射距离为1.7 cm,粒子的平均能量27~35 keV,粒子放射性活度 25.9~27.01 MBq(0.7~0.73 mCi,1 mCi=37 MBq)。植入器械选用国产含铅合金粒子植入枪及18 G专用粒子植入针,穿刺定位系统采用美国GE公司双排螺旋 CT或美国GE公司VOLUSON 730彩超仪。根据植入前在治疗计划系统(TPS)上设计,制定治疗前计划,确定植入导针数、导针位置、粒子数及位置,选择粒子种类及单个粒子活度,计算靶区总活度,预期靶区剂量分布,包括肿瘤及正常组织的剂量分布。在CT或彩超引导下,进行125I放射性粒子布源。根据剂量分布要求,选用均匀分布或周缘密集、中心稀疏布源方法操作植入。术中注意确定穿刺针到位后,植入粒子,再调整穿刺针的方向进行穿刺,并继续按上述方法植入粒子,粒子间距为0.5~1.0 cm,多次重复上述步骤,直至粒子植入满意为止。1周后CT或彩超复查,依据肿瘤靶区125I放射性粒子分布疏与密及有无均匀情况再补充植入125I放射性粒子。
1.2.2随访患者于治疗后1个月采用彩超、CT和AFP追踪复查,或在2次TACE术前常规行肝动脉造影了解肿瘤区域血流情况。治疗1个月后行彩超血流显像,瘤内、瘤周无血流为完全灭活,瘤内、瘤周部分血流为灭活不全。CT平扫+增强扫描肿瘤区域,结合CT平扫+增强影像观察:完全低密度并且未见密度增强定为完全灭活,密度增高定为复发。MRI平扫+动态增强扫描肿瘤区域,结合MRI增强扫描和弥散加权成像(DWI)观察:动态增强扫描动脉期病变未见明显强化,DWI序列呈等、低信号改变定为完全灭活;增强扫描动脉期可见强化,DWI序列呈高信号定为复发。随诊过程中如发现肿瘤增大、AFP升高、肝内外转移,则定为恶化。同步动态监测血清AFP。肿瘤缩小判定标准(RECIST):显效,指肿瘤缩小≥50%;有效,指肿瘤缩小<50%;稳定,指体积无变化,病情稳定1个月以上;无效,指体积增大,新生肿瘤血管产生,病情恶化。每1、2个月复查上述项目1次,随访时间为24个月。
1.3统计学方法
采用SPSS 17.0软件包进行统计学分析,采用χ2检验及秩和检验,P<0.05为差别有统计学意义。
2 结果
2.1AFP变化
两组治疗前后AFP变化见表2。

表2 单纯组与联合组治疗前后AFP变化
2.2肿瘤缩小率
按疗程定期采用彩超、CT扫描2次,TACE术前常规行肝动脉造影测定肿瘤大小变化。单纯组肿瘤缩小12例(60%),联合组27例(90%),2组比较差异有统计学意义(P<0.05,表3)。单纯组伴有门静脉分支癌栓5例,治疗后门静脉分支癌栓有效1例、稳定1例、无效3例,联合组中伴有门静脉分支癌栓7例,治疗后门静脉分支癌栓显效5例、有效2例,2组比较,差异有统计学意义(P<0.05)。

表3 单纯组与联合组治疗后肿瘤缩小程度
2.3生存率
50例患者随访2年或至患者死亡。远期疗效联合组6、12、18、24个月生存率均显著高于单纯组(P<0.05,表4)。

表4 单纯组与联合组治疗后生存率 n(%)
2.4不良反应
主要是血液学毒性及Ⅰ、Ⅱ级肝功能受损,对症治疗后均可缓解。2组均未发生严重(Ⅲ、Ⅳ级)肝功能受损,联合组无发生125I放射性粒子移位、胆汁瘘、内出血等严重并发症。2组治疗后不良反应比较,差异无统计学意义(P>0.05,表5)。
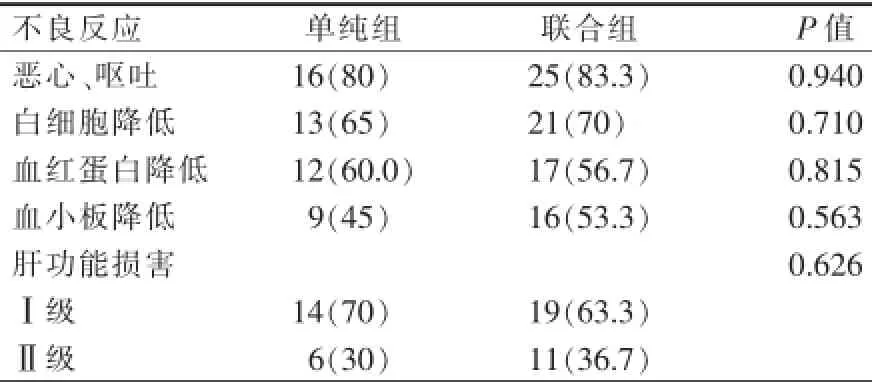
表5 单纯组与联合组治疗后不良反应 n(%)
3 讨论
原发性肝癌自发性破裂出血是原发性肝癌严重而死亡率高的并发症,其发生机制目前尚不清楚。有学者研究认为与下列因素有关[7-10]:①肝癌在进展过程中呈膨胀性生长,肿瘤内压力较高,同时肿瘤生长迅速引起瘤体供血不足发生中心坏死,在肿瘤淤血、内压高及坏死的基础上,特别是位于缺乏正常肝组织覆盖肝脏边缘的肿块,由于患者深呼吸、剧烈咳嗽、用力排便等情况腹内压突然增高,瘤内压力突破肿瘤周边包膜或正常薄弱的肝组织破裂导致腹腔大出血。②肝肿瘤周边是静脉系统供血,且门静脉与肝静脉有交通支相连,当门静脉压力增高时,动、静脉内的压力也升高,使血管壁逐渐变薄,最终导致破裂出血;另肿瘤血供丰富的新生血管组织学上缺乏肌层,血管无收缩性以及通透性增加也导致其易于破裂出血。③肝癌患者大都是在乙型肝炎或肝硬化的基础上发生癌变,常伴有严重的门静脉高压、肝功能损害和凝血功能异常等,均是导致肝癌破裂出血的危险因素。④肿瘤坏死液化后感染和肿瘤直接侵犯肝血管等也是导致肝癌破裂出血的危险因素。
目前,国内外文献中对原发性肝癌自发性破裂出血患者的处理有了很多报道。急症TAE术是治疗原发性肝癌自发性破裂出血首选疗法[3,11-16]。TAE术能有效控制原发性肝癌自发性破裂出血(70%~100%),降低病死率(0%~29.4%)[7,17]。本研究中单纯组和联合组共50例原发性肝癌自发性破裂出血患者急症行TAE,有效止血率为100%,病死率为0%,未发生严重并发症。这与国内外文献报道结果一致。急症行TAE的优点:①通过肝动脉造影,能观察到肝癌自发性破裂出血的责任血管明确诊断,进而行栓塞出血责任血管及肿瘤本身,达到双重治疗目的;②操作简单、创伤小、并发症少、术后恢复快等;③控制出血后,明胶海绵条或(和)颗粒2~3周会被吸收,部分血管再通,且一般不会再出血,可为肿瘤后续治疗提供机会(如TACE)。
然而,单纯TAE或TACE治疗原发性肝癌自发性破裂出血,肿瘤完全坏死率较低,这是因为TAE或TACE后,侧支循环建立、静脉对癌肿供血代偿性增加以及肿瘤周围子结节的供血小动脉不易阻断等,使得肿瘤不能完全坏死,肿瘤的周围区域仍可见大量残存细胞,成为原发性肝癌复发的主要原因[18]。对于乏血供的原发性肝癌自发性破裂出血或多次序贯行TACE的原发性肝癌自发性破裂出血患者,其肿瘤的供血动脉较少,且较细小或缺乏,单纯多次TACE碘化油沉积不佳,治疗效果差。
正常肝脏属于放射治疗敏感组织。剂量>40 Gy常规方法外照射时75%患者会出现肝功能不全[19],远低于肝癌的治疗剂量(至少60 Gy),常规的外放射治疗由于容易引起肝功能不全而不适于肝癌的治疗。放射性粒子瘤内植入术具有近距离精确放疗作用[20]。植入125I粒子近程放疗有下列优点:①方法简单、可操作性强、创伤小、并发症少;②125I粒子的穿射距离短,减少了对正常肝组织、邻近器官的损害;③肿瘤组织间植入125I粒子可不间断地在细胞增殖各周期杀伤肿瘤细胞,从而达到彻底的治疗效果;④低剂量、连续辐射可改变肿瘤的免疫表型而减少肿瘤转移的产生。目前已有采用125I粒子植入治疗原发性肝癌取得较好临床疗效的报道[21-24]。
本研究显示,联合组AFP下降率及下降至正常范围的例数、肿瘤缩小率、生存率均显著高于对照组(P<0.05),而不良反应,两组差异无统计学意义(P>0.05)。
以上研究提示,TACE联合粒子植入序贯疗法是治疗肝癌自发性破裂出血有价值的联合,可能与下列因素有关:①TAE后植入125I粒子可以减少出血并发症;②TACE有效杀死大部分由肝动脉供血的中央癌组织,而粒子植入产生的γ射线则有效杀伤周边主要由门静脉供血的残存癌组织,提高局部疗效;③TACE后碘油的有效储留病灶中,提高粒子植入定位准确,避免穿刺的盲目性,减少并发症发生率;④TACE术后大量活跃的肝癌细胞被杀灭,使非增殖细胞敏感化,更能增加125I粒子释放的γ射线的杀灭效果;⑤血管内皮细胞对放射线敏感,γ射线可以直接损伤血管内皮细胞,使微血管生成减少,抑制肿瘤新生血管形成[25]。
综上所述,采用TACE联合粒子植入治疗肝癌自发性破裂出血患者,可充分发挥其优势互补,明显增加治疗效果,并延长患者的生存期。
[1]Battula N,Madanur M,Priest O,et al.Spontaneous rupture of hepatocellular carcinoma:a Western experience[J].Am J Surg,2009,197:164-167.
[2]Miyoshi A,Kitahara K,Kohya N,et al.Outcomes of patients with spontaneous rupture of hepatocellular carcinoma[J].Hepatogastroenterology,2011,58:99-102.
[3]LaiEC,LauWY.Spontaneousruptureofhepatocellular carcinoma:a systematic review[J].Arch Surg,2006,141:191-198.
[4]Min HJ,Lee OJ,Kang DY,et al.The clinical study on spontaneously ruptured hepatocellular carcinoma[J].Korean J Gastroenterol,2004,44:160-167.
[5]申淑群,杨业发,葛乃建,等.肝癌破裂出血的介入与外科手术疗效评价[J].介入放射学杂志,2010,19:544-546.
[6]郭海国,杜玥蒙,余新林,等.原发性肝癌自发性破裂出血的急诊介入治疗[J].实用放射学杂志,2011,27:1728-1730.
[7]Zhu LX,Wang GS,Fan ST.Spontaneous rupture of hepatocellular carcinoma[J].Br J Surg,1996,83:602-607.
[8]Tanaka T,Yamanaka N,Oriyama T,et al.Factors regulating tumor pressure in hepatocellular carcinoma and implications for tumor spread[J].Hepatology,1997,26:283-287.
[9]虞希祥.肝癌破裂(腹部急诊的介入治疗)[A].杨仁杰,李文华,Sclafani JAeds.急诊介入诊疗学[M].北京:科学出版社,2008:382-386.
[10]Miyayama S,Yamashiro M,Okuda M,et al.The march of extrahepatic collaterals:analysis of blood supply to hepatocellular carcinomalocatedinthebareareaoftheliverafter chemoembolization[J].Cardiovasc Intervent Radiol,2010,33:513-522.
[11]汪建成,胡道予,姚洪亮,等.原发性肝癌自发性破裂出血介入动脉栓塞治疗[J].中国癌症杂志,2005,15:285-287.
[12]杨业发,程红岩,徐爱民,等.肝动脉插管栓塞治疗原发性肝癌自发破裂出血的疗效评价[J].中华肿瘤杂志,2002,24:285-287.
[13]张罡,史颖弘,沈忠培,等.肝动脉化疗栓塞治疗原发性肝癌自发性破裂出血[J].中国临床医学,2010,17:363-364.
[14]王革,毕晓霞,李雪梅.肝动脉化疗栓塞治疗原发性肝癌自发性破裂出血的临床价值[J].中国基层医药,2008,15:1235-1236.
[15]Bruls S,Joskin J,Chauveau R,et al.Ruptured hepatocellular carcinoma following transcatheter arterial chemoembolization[J]. JBR-BTR,2011,94:68-70.
[16]Shin BS,Park MH,Jeon GS.Outcome and prognostic factors of spontaneousrupturedhepatocellularcarcinomatreatedwith transarterial embolization[J].Acta Radiol,2011,52:331-335.
[17]Yoshida H,Onda M,Tajiri T,et al.Treatment of spontaneous ruptured hepatocellular carcinoma[J].Hepatogastroenterology,1999,46:2451-2453.
[18]Mahmoud-Ahmed AS,Suh JH,Lee SY,et al.Results of whole brain radiotherapy in patients with brain metastases from breast cancer:a retrospective study[J].Int J Radiat Oncol Biol Phys,2002,54:810-817.
[19]黄尚飞,卢振盛.普通CT引导下125I粒子植入治疗恶性肿瘤(附25例报告)[J].中国临床医学影像杂志,2007,18:518-519.
[20]李力军,于世平,孙兴臣,等.放射性粒子组织间永久植入治疗晚期胰腺癌[J].中华外科杂志,2003,41:717.
[21]Nag S,Dehaan M,Scruggs G,et al.Long term follow-up of patients of intrahepatic malignancies treated with iodine-125 brachytherapy[J].Int J Radiat Oncol Biol Phys,2006,64:736-744.
[22]In ZY,Lin J,Lin C,et al.1.5 T conventional MR-guided iodine-125 interstitial impiants for hepatocellular carcinoma:feasibility and preliminary clinical experience[J].Eur J Radiol,2012,81:1420-1425.
[23]谢正强,张丽,殷娟,等.超声引导下125I粒子植入治疗中晚期肝癌[J].现代肿瘤医学,2011,2:314-315.
[24]刘健,张福君,吴沛宏,等.CT导向下125I粒子植入治疗肝门区肝癌[J].介入放射学杂志,2005,14:606-609.
[25]程宝兴,吴浩荣,吴锦昌.碘-125组织间植入治疗大鼠移植性肝癌的实验研究[J].苏州大学学报·医学版,2002,22:13-16.
LIU De-xin,E-mail:22339922@163.com
ObjectiveTo evaluate the clinical effects of transcatheter arterial chemoembolization(TACE)combined with radioactive seed implantation in treating abdominal bleeding caused by spontaneous rupture of primary hepatocellular carcinoma(HCC).MethodsA total of 50 HCC patients with abdominal bleeding due to spontaneous rupture of hepatic cancer were divided into simple group(n=20)and combination group(n=30).Emergency transcatheter arterial embolization(TAE)with subsequent CT-guided or ultrasoundguided125I seed implantation and TACE were sequentially carried out in the patients of combination group,while TAE with subsequent TACE was performed in the patients of simple group.One month after the treatment,color Doppler ultrasound and CT scan were reexamined in all patients;the serum AFP levels,the reduction rate of tumor size,the one-year and 2-year survival rate,and the adverse reactions were compared between the two groups.ResultsThe negative rate of AFP,the tumor shrinkage rate,the one-year and 2-year survival rates in the combination group were 85.7%,90%,90%and 66.6%respectively,which were significantly higher than those in the single group(33.3%,65%,55%and 30%respectively),the differences between the two groups were statistically significant(P<0.05 for all).No statistically significant differences in the incidence of adverse reactions existed between the two groups(P>0.05).ConclusionIn treating abdominal bleeding caused by spontaneous rupture of primary HCC,TACE combined with radioactive125I seed implantation can full play their complementary advantages,significantly increase the therapeutic effect,and prolong the patient's survival time.(J Intervent Radiol,2015,24:999-1003)
hepatocellular carcinoma;rupture,spontaneous;hepatic arterial chemoembolization;radioactive125I seed
R735.7
B
1008-794X(2015)-11-0999-05 TACE combined with radioactive seed implantation for the treatment of abdominal hemorrhage due to spontaneous rupture of primary hepatocellular carcinoma:a clinical studyLIU De-xin,WANG Wei,LI Xin-feng,YE Chao-ping,LAI Qing-quan,LI Bo-yi,LI Ping.Department of Radiology,Second Affiliated Hospital of Fujian Medical University,Quanzhou,Fujian Province 362000,China
2015-04-06)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.11.017
福建省卫生厅医学创新课题项目(2012-CXB-23)、泉州市科技局课题项目(2012Z46)
362000福建泉州福建医科大学附属第二医院放射科(刘德鑫、李平)、肝胆外科(王伟、李新丰、叶超平)、CT-MR室(赖清泉)、超声科(李伯义)
刘德鑫E-mail:22339922@163.com

