磁性纳米材料载体固定纤维素酶技术研究进展
邢朝晖苏跃龙张琦阮馨怡林燕王欣泽孔海南
(1.上海交通大学环境科学与工程学院,上海 200240;2.云龙县环境监测站,大理 672700)
磁性纳米材料载体固定纤维素酶技术研究进展
邢朝晖1苏跃龙2张琦1阮馨怡1林燕1王欣泽1孔海南1
(1.上海交通大学环境科学与工程学院,上海200240;2.云龙县环境监测站,大理672700)
生物质原料转化为还原性糖,从而为生物质燃料乙醇的生产提供基础原料。针对现在游离酶生产工艺中的不足,研究者提出了纤维素酶固定化技术,其中以磁性纳米材料作为纤维素酶的固定化载体,不仅可提高纤维素酶的催化性能,增强酶的稳定性,而且以外加磁场代替传统的机械搅拌方式可充分发挥载体材料的磁响应性,从而使制备的固定化酶从反应体系中易于分离,高效且具有重复性。研究者们提出了很多优秀的纤维素酶固定化方案,综述了近年来磁性纳米材料固定纤维素酶的不同方法,并对其做了较为详细的阐述,在此基础上进一步对其优缺点和发展前景进行了讨论。
生物乙醇;纤维素酶;酶固定化;磁性纳米载体
木质纤维素是地球上已知的最为丰富的可再生有机物质,利用纤维素酶的生物催化能力可将大量未被利用的废弃木质纤维素转化为生物乙醇[1],具有可观的经济效益和环境效益。酶的水解过程是木质纤维素转化为生物乙醇的关键步骤,但游离纤维素酶在工业上的应用并不理想:游离的纤维素酶在高温、强酸、强碱、高离子浓度及存在部分有机溶剂等条件下不够稳定,容易失活而降低其催化能力,难以实现回收和重复利用,造成了在工业应用上的很大限制。采用固定化技术对纤维素酶进行固定,可提高其稳定性和抗抑制性,使其能重复使用,在一定程度上提高其催化活性和选择性[2-4]。但是酶的固定化技术中酶使用后的分离限制了酶固定化技术的进一步应用,其中载体材料的选择影响着酶的活性以及后续工艺的开展,是现今研究的关键之一[5]。在多种载体材料中,磁性纳米载体除可有效固定化纤维素酶外,还可利用外加磁场替代工业生产中的传统搅拌方式;与其他载体材料相比,磁性纳米载体无毒、比表面积大、机械强度优良。复合型的纳米磁性材料是将纳米磁性材料与特定的载体材料相结合设计的新型载体材料,目前这方面的技术具有很大的发展潜力。
本文介绍了纤维素酶的固定化技术发展进程,就近年来的研究热点——磁性纳米材料载体,总结归纳了建立在磁性纳米材料载体上的纤维素酶固定化方法研究,着重分析了以壳聚糖—磁性纳米材料为代表的复合载体的优缺点以及进一步开发的方向,旨在为后续的纤维素酶固定化研究提供一定的参考。
1 纤维素酶固定化发展过程
酶的固定化技术最早由Nelson和Griffin[6]在1916年提出,他们发现将蔗糖酶与氧化铝和焦炭结合以后,蔗糖酶仍具有催化活性。至20世纪80年代这一意外的发现才被接受为近代酶固定化技术的基石,随后固定化酶的技术得到了长足的发展[7]。现阶段,酶的固定化(Immobilization of enzymes)主要是指利用物理或化学的方法将酶束缚在一定区域内,使得酶分子仍能进行其特有的催化反应并能有效回收重复使用的技术[8,9]。传统意义上用来固定化酶的载体也可以特异性地用来固定纤维素酶[10],其中最为常见的种类包括:无机载体、合成高分子载体、天然高分子载体以及复合载体等[11],各类载体都有广泛的应用。
无机载体是最早应用于固定化酶的载体材料,之后载体除了充当酶的固定化支持物以外,在实际应用中还可以用于改造酶的性质、提高酶的催化活性、稳定性与选择性[12,13]。高分子载体(天然及合成载体)相对于无机载体,可供修饰的官能团增多,其表面性质、电荷分布和尺寸大小都可以预先设计以满足实际要求[14]。复合载体兼具了组合材料的优良性质,不再单一选择载体材料,具有更加自由的开发空间。各类固定化载体在实际研究中并没有严格的时间先后顺序和绝对的优劣性,这是由于纤维素酶分子结构的复杂性和多样性,不可能有一种固定化方法和固定化载体是适用于每一种工业应用的。因此,针对需要研究的酶的使用状况开发及选择新的固定化方法和固定化载体显得尤为重要。
近年来,纳米材料的优良性能逐渐显现[15],研究者们逐渐把目光投向开发纳米材料作为酶的固定化载体研究[16]。从实际应用的层面出发,纳米材料也是一类特殊的无机载体,因此兼具了无机载体的优良性质,纳米材料是指广义上三维空间中至少有一维处于纳米尺度范围或者由该尺度范围的物质为基本结构单元所构成的材料,同时纳米尺寸的物质因具有与宏观物质所迥异的表面效应、小尺寸效应、宏观量子隧道效应等,可以构建不同的形状[17,18],应用于制备固定化纤维素酶[19]。在实验室阶段,纳米粒子作为纤维素酶固定化载体时表现出了优良的性质[20],但是实际工业生产中仍然存在不易分离、酶固载率偏低和酶活力回收率较低等问题。为了有效的解决上述问题,研究者们通过固定化策略的改进[21],包括结合不同的固定化技术、设计开发新的固定化载体以及固定化条件,来提高固定化酶的催化活性、选择性和稳定性,磁性纳米材料的应用是其中一个有效方法[22]。当固定化酶载体具有磁性时,制备得到的固定化酶易于从反应体系中分离回收,操作简单;同时可以利用外加磁场代替传统的搅拌方式。
2 磁性纳米材料固定纤维素酶研究进展
传统使用的磁性材料是四氧化三铁,一般而言,铁的氧化物及羟基氧化物,按价态、晶型和结构的不同可分为(α-,β-,γ-)Fe2O3、Fe3O4、FeO和(α-、β-、γ-和δ-)FeOOH,其中研究较多和具有实用价值的铁的氧化物主要有Fe3O4、γ-Fe2O3及α-Fe2O3等[23]。现阶段由于纤维素酶结构的复杂性,研究者一直在寻找合适的固定化方法,基于磁性纳米粒子与固定的纤维素酶的结合方式,本文将固定化方案大致分为3类,即直接固定、修饰固定及复合载体进行固定。
2.1 直接固定
将纤维素酶直接固定在磁性纳米颗粒表面可以克服有孔载体普遍存在的扩散阻力,单一的磁性纳米粒子具有更高的磁响应性和更大的比表面积。有关酶直接固定在磁性纳米粒子表面的固定化机理一般认为:通过化学共沉淀法制备的磁性纳米粒子属于“巨型离子”,其表面会在特定的溶液体系中吸附氢氧根离子从而带有正(负)电荷(粒子表面在吸附氢氧根后还会因为氢氧根的电荷效应结合其他阳离子,因此其所处的离子环境决定了粒子吸附后的电荷表现)从而导致粒子在碱性环境中表面带有负电荷,而在酸性环境中表面带有正电荷。有研究指出在pH7.5时OH-在粒子表面的电荷效应为零,这时粒子表面电荷密度很小并且极易团聚[24]。Bacri等指出-OH在pH6-10的范围内都会被吸附保留在粒子表面。因此直接固定化主要是使粒子表面自由的羟基和酶的氨基结合使得其固定在粒子表面[25]。由于使用磁性纳米材料进行纤维素酶固定化的简易性引起了人们广泛的兴趣,表1从载体制备到固定化效果梳理了常见的纤维素酶固定化方案。
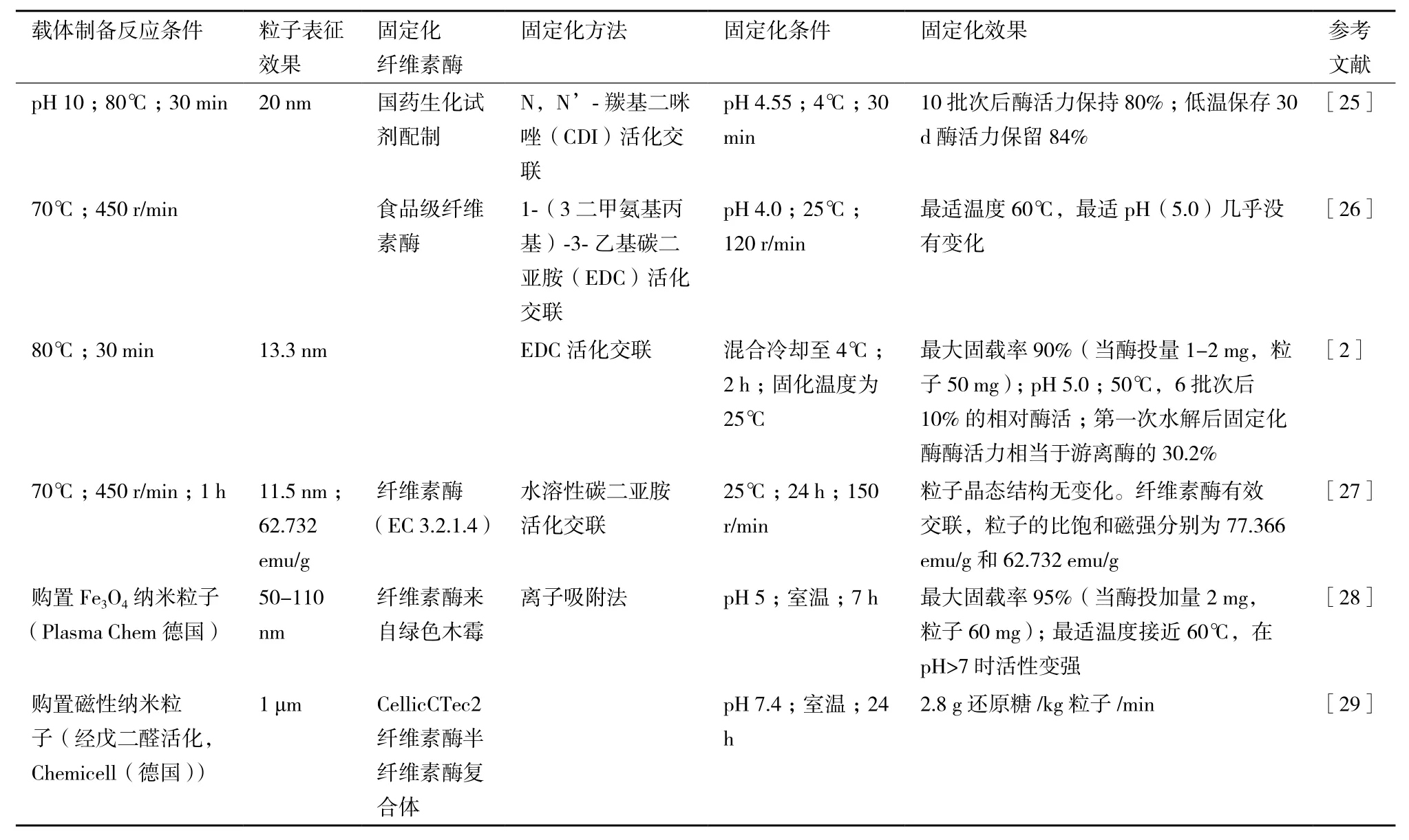
表1 纤维素酶直接固定在磁性纳米载体
在直接固定化中,更加常见和成熟的方案是共价吸附法[30]。表1中列举的前几项研究都建立在此方法之上。一般在载体结合酶的时候要经过两个阶段:吸附与共价结合。当酶分子在溶液中因为物理作用靠近带有化学功能基团位点的载体附近后,足够接近的酶分子上的非活性部位基团与载体上数量足够的活性化学功能团发生化学反应,使得酶分子结合到载体上。虽然直接固定不需要对磁性纳米粒子进行修饰,流程较为简单,在这种条件下,酶的活力取决于吸附与共价结合两个操作过程[31],扩散限制、载体活性位点官能团和固定化条件、体系的pH及温度等都会影响酶的活性。表1显示,直接固定条件的选择存在多样性,而共价结合的取向难以控制[32],从而导致了酶活力的差异。20世纪70年代就有研究者提出,固定化载体和酶之间的静电复合物对于固定化酶的活性与稳定性具有重要意义,不同的活化剂选择、固定化条件的控制都会导致纤维素酶的固载率和酶活力的差异,从而导致应用上的局限。除了磁性纳米粒子的物理特性(粒径、比表面积以及粒子形貌等)的差异,选择合适的活化剂,调控合适的固定化条件仍是现在研究的重点。表1中列举的方案多采用水溶性碳二亚胺活化纤维素酶再将其与磁性纳米粒子交联固化,无论是EDC还是CDI,价格都偏高,若需要大规模生产经济成本较高,有待进一步寻找合适的交联活化剂。
2.2 修饰固定
相比较直接将酶固定于磁性纳米粒子,对载体表面化学修饰后使其带上各种反应性功能基团(如环氧基、羰基或氨基等),可在一定程度上增加其结合酶的强度[33],使得固定化酶不易脱落[34],同时因为部分修饰方法需要进行较为剧烈的化学反应,因此可能会对酶的活性中心造成相对的损伤,从而导致固定化酶活性的下降,所以在修饰固定化纤维素酶时需要格外注意修饰的功能团化学生物性质以及修饰方法的温和性,尽量不要对固定化的酶催化性能造成损失,表2列举了近年来常见的几种较为成熟的修饰固定纤维素酶的方法。

表2 纤维素酶固定在表面修饰的磁性纳米载体
修饰固定法的设计理念是:先经过与化学试剂反应使得制备的磁性纳米颗粒表面带上特定的官能团,再通过物理或化学作用让酶分子接近反应位点并与活化的官能团结合,从而使得酶分子牢固结合到载体上[39]。在表2列举的固定化方法中,经过多批次的水解之后,固定纤维素酶仍保有相当高的酶活性,这说明了经过修饰的载体与酶分子间的结合更为牢固,并且可以重复水解纤维素。修饰载体上共价结合的酶可以看作是经过化学或物理作用修饰过的酶,它们的理化性质被所使用的载体修饰了。在进行固定化的时候,酶和载体上修饰的化学官能团发生反应,这改变了酶的构象,同时酶分子的空间取向也因为结合到反应位点而发生了相应的改变,因此酶的化学性质也相应改变,这都使得成功固定化的纤维素酶在催化性能、选择性和稳定性上都比传统吸附法固定的酶或天然酶有了显著提升。
2.3 复合载体固定
以磁性纳米粒子作为载体直接通过吸附、偶联的方式固定纤维素酶,操作要求较低、工艺较为简便,易于实现工业化,但是直接固定往往导致纤维素酶的固载量偏低,这是由于简单吸附的附着力较弱,酶分子易脱落,即使是使用脱水剂活化之后共价结合,也较容易受到溶液环境的影响,在表1实验方案中的高固载率往往要在比较低的纤维素酶投加量下得到,且高固载率下的重复性能仍待实验验证;以表面功能化的磁性纳米粒子作为载体固定纤维素酶,虽然可以通过增加粒子表面的可用官能团数量,或者利用复杂化的空间结构提高酶分子与结合位点的反应机会,从而增加酶分子的固载量,但是表2固定化方法中,化学修饰相对繁琐,操作要求较高,而且经过复杂的表面修饰,高刺激性的化学试剂残留也可能会对酶的生物特性产生影响。另外,由于共价结合改变了酶分子的空间构象,有时反而会使固定的纤维素酶酶活降低。因此,研究者们开始研究以磁性高分子微球为载体的复合固定化酶技术。对于无孔的磁性载体颗粒,如以包覆法制备的微球,在可分离的非均相反应体系中,颗粒越小,其固定化的表面积越大,越有利于增加载体的固载量;对于制备的多孔载体,因为会有浓度梯度的存在,渗透到载体内部的酶分子会因为扩散限制出现功能性失活,通常在制备载体微球时可以通过改变载体制备条件,如致孔剂,交联剂的选择和浓度,控制载体的孔隙率,对于较大的颗粒,酶活可以通过酶的固载率进行控制。另外复合载体兼有强磁响应性、高比表面积、机械强度高、单分散性好的优势。其中四氧化三铁-壳聚糖复合载体因为其良好的机械性能、化学稳定性以及抗金属离子干扰等优点而备受关注。
壳聚糖本身也可以单独成为纤维素酶的固定化载体[40],结合磁性材料的壳聚糖复合载体继承了其生物大分子的特性[41],目前,磁性壳聚糖微球的结构可分为3类[42]:核-壳结构,磁性材料为核,高分子材料为壳;混合结构,磁性材料分散在磁性微球内部;多层夹心结构,外层和内层为高分子材料,中间为磁性材料。
制备的四氧化三铁-壳聚糖复合载体兼具磁性纳米材料的磁响应性以及壳聚糖生物大分子的生物相容性、易于修饰的特点,提高了载体的机械性能以及稳定性,在酶固定化领域具有广阔的应用前景,表3以修饰方法为出发点,介绍了以壳聚糖磁性纳米材料为固定化载体制备的纤维素酶(蛋白质)固化方法及效果。

表3 纤维素酶固定在四氧化三铁-壳聚糖复合载体
现阶段应用于固定纤维素酶的复合载体,特别是与磁性纳米粒子复合的载体数量还有待进一步开发,研究者们就如何得到更高效的四氧化三铁-壳聚糖磁性纳米复合载体,在修饰基团[46]、固定化方法[47]、固定化条件[48]控制等方面并未达成一致,还有待深入研究。由于结合了两种或多种载体材料,复合载体显示出了优于单一载体的理化性能,同时也发挥了磁性纳米材料的优势,但是开发新的载体并不表明要与已有的载体材料分割开来,研究者们开发了众多的酶固定化载体,这些载体材料都可能经过新的设计特异性地应用到纤维素酶的固定化中。可以说,利用磁性纳米材料为基础的复合固定化载体会为大规模的工业应用奠定基础。但是不容忽视的一点是,虽然复合载体优势突出,但是制作工艺相对较复杂,操作条件要求相对较高,所以寻找更优化的复合材料,以及如何简化复合材料的制备和固定化流程将是进一步研究开发的重点。
3 展望
纤维素酶以其高效、专一的催化作用已经成为国内外研究者开发的关注点。壳聚糖是自然界含量第二丰富的天然高分子,具有多种优良的生物、物理化学性能,是一种出色的纤维素酶固定化载体,两者结合必然能为生物质转化领域带来新的突破。从现在国内外研究者们的成果来看,利用磁性纳米粒子固定纤维素酶已展现出卓有成效的科研和实业价值。但是现阶段关于磁性纳米作为固定纤维素酶的研究中仍然存在一些亟待进一步研究的方面:(1)研究开发优质的交联剂,制备出具有更高活力和稳定性的固定化纤维素酶;(2)采用结构、化学键检测手段深入研究酶的集聚状态、超分子结构等微观结构的变化,更好的阐明磁性固定化交联酶聚集形态形成机理;(3)针对不同的纤维素结构和纤维素酶种类,研究开发更适宜的改性结构以及更加深入阐释固定化纤维素酶水解发酵工艺中的微观动力学。
[1]Humbird D, Davis R, Tao L, et al, Process design and economics for biochemical conversion of lignocellulosic biomass to ethanol:diluteacid pretreatment and enzymatic hydrolysis of corn stover[R]. USA:National Renewable Energy Laboratory(NREL), 2011.
[2]Jordan J, Kumar CSSR, Theegala C. Preparation and characterization of cellulase-bound magnetite nanoparticles[J]. Journal of Molecular Catalysis B:Enzymatic, 2011, 68(2):139-146.
[3]Bornscheuer UT. Immobilizing enzymes:how to create more suitable biocatalysts[J]. Angewandte Chem ie International Edition, 2003, 42(29):3336-3337.
[4]Mateo C, Palomo JM, Fernandez-Lorente G, et al. Improvement of enzyme activity, stability and selectivity via immobilization techniques[J]. Enzyme and Microbial Technology, 2007, 40(6):1451-1463.
[5] 王景林. 纤维素酶固定化的研究进展[J]. 生命科学, 1997, 9(3):116-118.
[6]Nelson JM, Griffin EG. Adsorption of invertase[J]. Journal of the American Chemical Society, 1916, 38(5):1109-1115.
[7]Hanefeld U, Gardossi L, Magner E. Understanding enzyme immobilisation[J]. Chemical Society Reviews, 2009, 38(2):453-468.
[8]Mosbach K. Immobilized enzymes[J]. Trends in Biochemical Sciences, 1980, 5(1):1-3.
[9] 徐莉, 侯红萍. 酶的固定化方法的研究进展[J]. 酿酒科技,2010(1):86-89.
[10]Sheldon RA. Enzyme immobilization:the quest for optimum performance[J]. Advanced Synthesis & Catalysis, 2007, 349(8-9):1289-1307.
[11]Wang S, Su P, Ding F, et al. Immobilization of cellulase on polyam idoam ine dendrimer-grafted silica[J]. Journal of Molecular Catalysis B:Enzymatic, 2013, 89:35-40.
[12] Tebeka IR, Silva AG, Petri DF. Hydrolytic activity of free and immobilized cellulase[J]. Langmuir, 2009, 25(3):1582-1587.
[13] Safari Sinegani AA, Em tiazi G, Shariatmadari H. Sorption and immobilization of cellulase on silicate clay minerals[J]. J Colloid Interface Sci, 2005, 290(1):39-44.
[14] Wu L, Yuan X, Sheng J. Immobilization of cellulase in nanofibrous PVA membranes by electrospinning[J]. Journal of Membrane Science, 2005, 250(1-2):167-173.
[15] Kim J, Jia H, Wang P. Challenges in biocatalysis for enzyme-based biofuel cells[J]. Biotechnol Adv, 2006, 24(3):296-308.
[16] Cipolatti EP, Silva MJA, Klein M, et al. Current status and trends in enzymatic nanoimmobilization[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 99:56-67.
[17]Gokhale AA, Lu J, Lee I. Immobilization of cellu lase on magnetoresponsive graphene nano-supports[J]. Journal of Molecular Catalysis B:Enzymatic, 2013, 90:76-86.
[18]Mubarak NM, Wong JR, Tan KW, et al. Immobilization of cellulase enzyme on functionalized multiwall carbon nanotubes[J]. J Mol Catal B:Enzym, 2014, 107:124-131.
[19] Suh WH, Suslick KS, Stucky GD, et al. Nanotechnology,nanotoxicology, and neuroscience[J]. Progress in Neurobiology,2009, 87(3):133-170.
[20] Ansari SA, Husain Q. Potential applications of enzymes immobilized on/in nano materials:A review[J]. Biotechnology Advances,2012, 30(3):512-523.
[21]Lupoi JS, Smith EA. Evaluation of nanoparticle-immobilized cellulase for improved ethanol yield in simultaneous saccharification and fermentation reactions[J]. Biotechnology and Bioengineering, 2011, 108(12):2835-2843.
[22] Tang ZX, Qian JQ, Shi LE. Characterizations of immobilized neutral lipase on chitosan nano-particles[J]. Materials Letters, 2007, 61(1):37-40.
[23] 辛宝娟, 邢国文. 氧化铁磁性纳米粒子固定化酶[J]. 化学进展, 2010, 22(4):593-602.
[24] Mehta RV, Upadhyay RV, Charles SW, et al. Direct binding ofprotein to magnetic particles[J]. Biotechnology Techniques,1997, 11(7):493-496.
[25] 王玫, 宋芳, 汪世龙, 等. 磁性纳米颗粒Fe3O4固定化纤维素酶的光谱学研究[J]. 光谱学与光谱分析, 2006(5):895-,88.
[26] 霍书豪, 许敬亮, 张猛, 等. Fe3O4纳米颗粒固定化纤维素酶的酶学特性研究[J]. 可再生能源, 2009(6):33-35, 40.
[27] 霍书豪, 许敬亮, 庄新姝, 等. 超顺磁性纳米颗粒固定化纤维素酶初步研究[J]. 现代化工, 2009(S2):188-190.
[28] Khoshnevisan K, Bordbar AK, Zare D, et al. Immobilization of cellulase enzyme on superparamagnetic nanoparticles and determination of its activity and stability[J]. Chemical Engineering Journal, 2011, 171(2):669-673.
[29] Alftren J, Hobley TJ. Immobilization of cellulase mixtures on magnetic particles for hydrolysis of lignocellulose and ease of recycling[J]. Biomass and Bioenergy, 2014, 65:72-78.
[30] Xu J, Huo S, Yuan Z, et al. Characterization of direct cellulase immobilization with superparamagnetic nanoparticles[J]. Biocatalysis and Biotransformation, 2011, 29(2-3):71-76.
[31] Talbert JN, Goddard JM. Enzymes on material surfaces[J]. Colloids and Surfaces B:Biointerfaces, 2012, 93:8-19.
[32] Zoungrana T, Norde W. Thermal stability and enzymatic activity of α-chymotrypsin adsorbed on polystyrene surfaces[J]. Colloids and Surfaces B:Biointerfaces, 1997, 9(3):157-167.
[33] Šulek F, Drofenik M, Habulin M, et al. Surface functionalization of silica-coated magnetic nanoparticles for covalent attachment of cholesterol oxidase[J]. J Magn Magn Mater, 2010, 322(2):179-185.
[34] Lopez-Gallego F, Betancor L, Mateo C, et al. Enzyme stabilization by glutaraldehyde crosslinking of adsorbed proteins on aminated supports[J]. Journal of Biotechnology, 2005, 119(1):70-75.
[35] 李咏兰, 吕桂芬, 弓剑, 等. 纳米磁性微粒固定化纤维素酶及水解秸秆的研究[J]. 江西师范大学学报:自然科学版,2011(6):574-578.
[36] 廖红东, 袁丽, 童春义, 等. 基于聚乙烯醇/Fe2O3纳米颗粒的纤维素酶固定化[J]. 高等学校化学学报, 2008(8):1564-1568.
[37] 张猛, 许敬亮, 张宇, 等. 氨基硅烷化磁性纳米微球固定化纤维素酶研究[J]. 太阳能学报, 2013(2):337-342.
[38] 王秀玲, 顾银君, 庄虹, 等. 新型氨基化磁性树状分子纳米颗粒的制备与表征[J]. 化工新型材料, 2012(11):61-63.
[39] Liao H, Chen D, Yuan L, et al. Immobilized cellulase by polyvinyl alcohol/Fe2O3magnetic nanoparticle to degrade microcrystalline cellulose[J]. Carbohydrate Polymers, 2010, 82(3):600-604.
[40] Mao X, Guo G, Huang J, et al. A novel method to prepare chitosan powder and its application in cellulase immobilization[J]. J Chemi Technol Biotechnology, 2006, 81(2):189-195.
[41] Liu X, Hu Q, Fang Z, et al. Magnetic chitosan nanocomposites:a useful recyclable tool for heavy metal ion removal[J]. Langmuir,2008, 25(1):3-8.
[42] 石浩明, 张树彪, 陈会英, 等. 壳聚糖/Fe3O4复合纳米颗粒的制备[J]. 大连民族学院学报, 2012(3):213-216.
[43] 李冰, 邵海员, 黎锡流, 等. 磁性固定化纤维素酶的交联法制备及其磁致酶学性质[J]. 河南工业大学学报:自然科学版,2006(6):10-14.
[44] Zang L, Qiu J, Wu X, et al. Preparation of magnetic chitosan nanoparticles as support for cellulase immobilization[J]. Industrial & Engineering Chemistry Research, 2014, 53(9):3448-3454.
[45] 马云辉, 陈国, 赵珺. 壳聚糖包覆磁性纳米粒子的制备和表征以及蛋白质吸附特性[J]. 高分子学报, 2013(11):1369-1375.
[46] Dincer A, Telefoncu A. Improving the stability of cellulase by immobilization on modified polyvinyl alcohol coated chitosan beads[J]. J Mol Catal B:Enzym, 2007, 45(1-2):10-14.
[47] Jiang Y, Guo C, Xia H, et al. Magnetic nanoparticles supported ionic liquids for lipase immobilization:Enzyme activity in catalyzing esterification[J]. J Mol Catal B:Enzym, 2009, 58(1-4):103-109.
[48]Podrepšek GH, Primožič M, Knez Ž, et al. Immobilization of cellulase for industrial production[J]. Chemical Engineering,2012, 27:235-240.
(责任编辑 狄艳红)
Research Progress on Cellulase Immobilized by M agnetic Nanoparticles as Carriers
Xing Zhaohui1Su Yuelong2Zhang Qi1Ruan Xinyi1Lin Yan1Wang Xinze1Kong Hainan1
(1. School of Environmental Science and Engineering,Shanghai Jiao Tong University,Shanghai200240;2. Environmental Monitoring Bureau of Yunlong Country,Dali672700)
Conversion of biomass to reducing sugar by cellulase is the foundation of the biomass fuel production. Nowadays researchers have invented the enzyme immobilization technology to avoid the disadvantages of free enzymatic hydrolization. Utilization of magnetic nanoparticles as carriers for the cellulase immobilization can increase the catalytic activities of enzyme and enhance stability of the enzyme. Moreover, replacing conventional mechanical stirring by external magnetic field can give full play to the role of carriers’ magnetic response;with the immobilization on magnetic nanoparticles, the produced cellulase can be separated easily from the mixture in the reaction systems. Researchers have proposed many excellent immobilization methods. Here the different methods of cellulase immobilization by magnetic nanoparticles are reviewed, their applications are explained in detail, and consequently the advantages and disadvantages as well as the development prospect are discussed.
bioethanol; cellulase; cellulase immobilization; magnetic nanoparticles as carrier
10.13560/j.cnki.biotech.bull.1985.2015.08.009
2014-12-15
国家科技重大专项(2012ZX07105-003),上海市自然科学基金项目(11ZR1417200)
邢朝晖,男,硕士研究生,研究方向:固定化技术应用;E-mail:doulejuice2013@sjtu.edu.cn
林燕,女,博士,副教授,研究方向:生物质能源利用;E-mail:linyan2002@sjtu.edu.cn

