木薯干旱胁迫响应基因MeGSTU7自然变异分析
邓德力 王斌 曾长英 郭鑫 彭明
摘 要 在2个木薯品种中检测MeGSTU7基因在不同干旱胁迫阶段的表达量变化,并克隆测序了60个木薯品种的基因区DNA序列,分析基因核苷酸多态性及其自然变异,并将核苷酸多态性与干旱胁迫表型关联分析,挖掘优等位变异。结果表明,干旱胁迫条件下,2个品种的MeGSTU7的表达量均上调。MeGSTU7基因区核苷酸变异丰富,共有23个SNP位点,A/G突变为主;外显子区总计10个同义突变,12个非同义突变;外显子区在品种资源群体中有4种主要单倍型,所有的单倍型分为两大类,分子进化分析表明,MeGSTU7的外显子区的两端受到很强的正选择作用;Q+K+MLM混合线性模型关联分析结果表明,1个Indel和2个SNP与干旱胁迫下地上部鲜重耐旱系数显著关联,并筛选得到了优等位变异。
关键词 谷胱甘肽转移酶;MeGSTU7;木薯;抗旱;自然变异;单倍型
中图分类号 S533 文献标识码 A
Abstract Glutathione-S-transferase(GST)plays an important role in glutathione conjugation reaction and involves in many physiological and biochemical reaction in plants including stress resistance, primary metabolism and cellular signal transduction. MeGSTU7 codes GST in cassava(Manihot esculenta crantz). In order to research the function of MeGSTU7 in drought-resisting, the expression quantity of MeGSTU7 was detected in two cassava varieties which are tolerant and sensitive to water stress in different degrees of drought stress. MeGSTU7 was cloned from 60 cassava varieties and sequenced. Sequceces were analyzed to study the single nucleotide polymorphism(SNP)and the natural variation. Correlation analysis between single nucleotide polymorphism and drought phenotype was made to select the excellent allelic variations. The results indicated that the expression of MeGSTU7 in two cassava varieties were up-regulated under drought stress. Nucleotide polymorphism in the gene regions of MeGSTU7 was abundant with 23 SNP among which the A/G mutation type was the major. There were 10 synonymous changes and 12 replacement changes in exon regions. All of the haplotypes were divided into two types among which 4 haplotypes were the major in population. Molecular evolution showed that intense positive selection function at the ends of the exon in MeGSTU7. By Q+K+MLM mixed linear model, one Indel and 2 SNP were significantly associated with the fresh weight of aerial parts in the stress of drought and excellent allelic variations were selected. In conclusion, this paper lays a good foundation for further research of the function of MeGSTU7 in drought resistant and the selection of excellent allelic variations.
Key words Glutathione-S-transferase; MeGSTU7; Cassava; Drought-resisting; Natural variation; Haploidtype
doi 10.3969/j.issn.1000-2561.2015.11.011
谷胱甘肽转移酶(glutathione-S-transferase, GST)在谷胱甘肽(glutathione, GSH)结合反应时起到关键作用,催化谷胱甘肽结合反应的起始。植物中,所有GSTs蛋白都是由2个25 ku亚基组成的蛋白二聚体,每一个GST亚基包含独立的催化位點[1]。谷胱甘肽转移酶超家族(GST)可根据蛋白序列相似性以及基因结构分为六大类:phi(F)、tau(U)、theta(T)、zeta(Z)、lambda(L)和dehydroascorbate reductase(DHAR)[2]。MeGSTU7蛋白属于tau(U)类,该类型谷胱甘肽转移酶是植物中所特有的[3]。
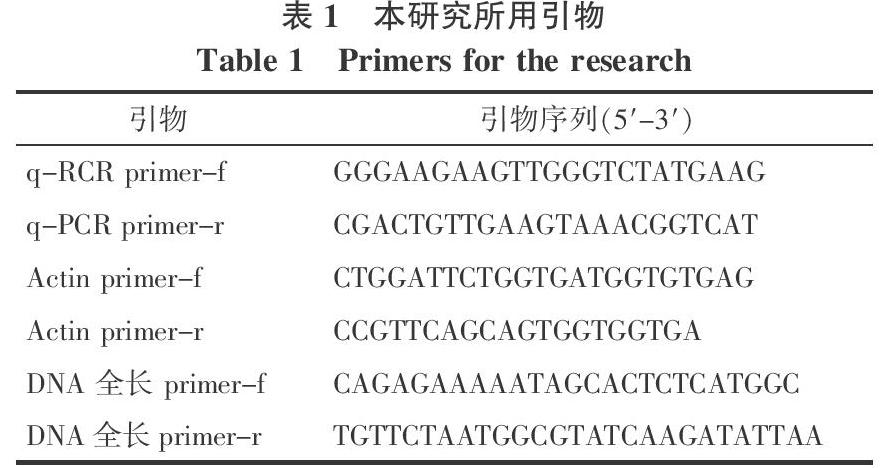
1.2.8 基因结构分析 在JGI数据库phytozome10(http://phytozome.jgi.doe.gov/pz/portal.html)的木薯基因组序列,获得木薯品种AM560的MeGSTU7基因的CDS序列(coding sequence)以及DNA序列(genomic sequence),用NCBI的Spidey(http://www.ncbi.nlm.nih.gov/IEB/Research/Ostell/Spidey/)分析其基因结构,并用DNAMAN软件绘制基因结构图。
1.2.9 序列多样性分析 利用MEGA4.0软件进行序列比对,对齐序列之后输出.MEG格式文件,然后导入DnaSPv5.0软件[21]分析MeGSTU7基因DNA序列的核苷酸多样性,包括SNP和Indel的数目及其在外显子,内含子,保守结构域的分布,同义突变和非同义替换。并统计氨基酸的极性变换及对蛋白质理化性质的影响。
1.2.10 外显子区单倍型分析 根据NCBI的Spidey工具分析的MeGSTU7基因的基因结构,使用BioEdit软件[22]批量去除5′-UTR和3′-UTR序列以及内含子序列,获得MeGSTU7的CDS序列之后,导入DnaSPv5.0软件进行sliding windows单倍型分析,windows长度设为45 bp,step长度设为3 bp,并导出NRF文件。使用Network软件(Fluxus Technology, Ltd)绘制单倍型网络。
1.2.11 SNP与干旱表型的关联分析 使用31对随机分布于木薯基因组上的多态性SSR标记对60个品种的DNA进行扩增,扩增PCR程序参照Lin等[23]的方法,毛细管电泳检测,片段统计方法参照Wang等[18]的方法。最终得到83个多态性片段。将SSR基因型数据导入Structure软件[18]进行群体结构分析,burnin和MCMC分别设为100 000和100 000,K值从1到10,每个K值重复3次,根据随着K值的变化,LnP(D)值大小及△K的拐点判断K=6,然后用CLUMPP软件[24]合并K=6对应的3个Q值矩阵,输出结果作为协方差导入TASSEL2.1软件进行关联分析。同时利用31个SSR标记的基因型信息导入TASSEL软件计算Kinship矩阵。
单个SNP位点与干旱表型导入TASSEL软件,利用SSR分型的数据计算家系效应和群体结构将两者作为协方差进行Q+K+MLM的关联分析,分析结果参照Benjamin的方法[18]进行P值纠正,纠正后的P值<0.05时,就表示该SNP位点是与干旱表型显著关联。SNP位点优等位变异表型值的计算参照文自翔等[25]的方法。单倍型间干旱表型的方差分析使用SPSS18.0软件进行分析。将MeGSTU7基因区的SNP数据导入TASSEL,利用Q+K+MLM混合线性模型进行关联分析,剔除MAF<5%的SNP位点,并将P值用FDR方法纠正。
2 结果与分析
2.1 基因结构与蛋白保守结构域分析
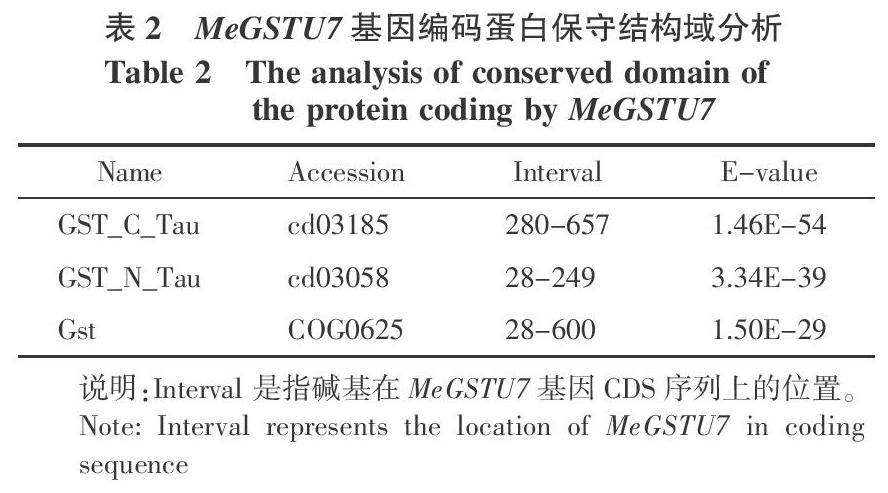
JGI收录的MeGSTU7基因区全长985 bp,该基因含有2个外显子和1个内含子,2个外显子被1个87 bp的内含子隔开。其CDS序列长度为702 bp,编码233个氨基酸。本研究克隆的DNA序列包括20 bp 5′-UTR、23 bp 3′-UTR和2个外显子区及1个内含子,总长为832 bp。利用NCBI保守结构域网站对其氨基酸序列进行保守结构域分析,MeGSTU7所编码蛋白总长为233个氨基酸,含有3个保守结构域(表2),是一个典型的tau类的GST家族蛋白成员,包括了2个GST亚基。
2.2 表达模式
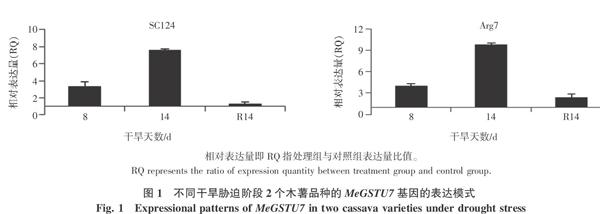
干旱胁迫条件下,两个木薯品种的MeGSTU7基因表达量如图1所示。干旱胁迫条件下,MeGSTU7基因表达量均上调表达,且在同一干旱胁迫时间点,MeGSTU7基因在2个木薯品种表达量RQ值相近。在干旱14 d并复水24 h后,MeGSTU7基因在2个木薯品种中的表达量迅速下调,回复到与对照组表达量相当的水平。这表明:MeGSTU7响应干旱胁迫信号,可能参与了木薯干旱胁迫响应信号途径。
2.3 单核苷酸多态性分析
测序区间覆盖了20 bp的5′-UTR区和23 bp的3′-UTR區,共有27个单核苷酸多态性变异位点(SNP),和2个Indel变异,其中MAF>5%的SNP位点有11个,稀有SNP有16个。Indel变异全部位于5′-UTR区。总体27个SNP位点中,5个位于UTR区,内含子中只含有1个SNP位点。SNP类型以A/G突变为主,其次是C/T,颠换突变有20个,转换突变有6个。在起始密码子ATG的第24个核苷酸处,有A/T/G 3种碱基变异(表3)。使用DnaSPv5.0软件的Sliding windows方法分析MeGSTU7基因核苷酸多样性,结果如图2所示,外显子区Pi值在100 bp前后、200 bp前后、550 bp前后、720 bp前后和800 bp达到较高值,其余部分均在较低水平。这些高Pi值区域均分布在外显子区域,其中前2个在外显子1上,后3个区域分布在外显子2上(图2)。
2个外显子区总计10个同义突变,12个非同义突变。保守结构域包括6个同义突变和5个非同义突变(表3)。总体11个2种碱基变异的SNP位点导致10个氨基酸变异,SNP24有3种碱基变异,导致其所在的密码子编码3种不同的氨基酸。总体12个氨基酸位置的氨基酸变异中,8个位置的氨基酸种类发生变异,但不改变氨基酸的极性;4个位置的氨基酸存在种类变异和极性差异,保守结构域内有4个氨基酸变异,其中1个氨基酸种类和极性变异位于其tau类GST C端保守结构域内,其余3个仅氨基酸种类发生变异,并不改变氨基酸的亲水性。2个氨基酸的座位有3种氨基酸种类变异。
2.4 外显子区单倍型分析及其分子进化分析
对60份干旱处理木薯品种的MeGSTU7基因进行单倍型分析,结果表明60个品种共分为28种单倍型,包括4种主要单倍型(P>0.05)(图3和表4),分为两大类TypeⅠ和TypeⅡ。TypeⅠ包括Hap7、Hap15及其衍生的9种单倍型;TypeⅡ包括Hap1、Hap2及其衍生的15种单倍型。Hap2、Hap15、Hap7和Hap1包括的品种数占总体群体大小的比例分别为48.3%、20%、16.7%和15%。4种主要单倍型之间存在4个SNP变异,其中3个同义突变,1个非同义突变。60个木薯品种的MeGSTU7基因包括2种单倍型杂合和仅1种单倍型的品种数各占总体的50%。对单倍型的两大类型进行分子进化分析(Ka/Ks),结果如图4所示,在MeGSTU7的cDNA的5′端40~45 bp碱基处和3′端679~687 bp碱基处均检测到Ka/Ks>>1,说明在这两个位置,受到极显著的正选择作用。
2.5 MeGSTU7基因区SNP与干旱表型关联分析
经关联分析得到了1个Indel标记和2个SNP标记与地上部鲜重的耐旱系数显著关联。结果如表5所示,Indel10是位于5′-UTR区的单碱基插入/缺失多态性位点,其对表型变异解释率达到了12.0%,优等位变异为A单碱基插入,其表型值为0.139;SNP93位于第1外显子的A/T变异,但是该位点的SNP为同义突变,不导致氨基酸变异。SNP93对表型变异解释率为11.26%,优等位变异为A,其表型值为0.047;SNP525位于第2外显子,该位点为非同义突变,编码氨基酸为谷氨酰胺/组氨酸,对表型变异解释率为10.25%,优等位变异为G,其表型值为0.06。本研究还比较了4种主要单倍型,发现4种主要单倍型的平均值不存在显著性差异,方差分析和多重比较均未达到显著性水平。
3 讨论与结论
实验结果显示MeGSTU7蛋白包含了一个C端tau类谷胱甘肽转移酶α螺旋结构域;一个N端硫氧还蛋白折叠结构域。2006年, 杨海灵等[26]对谷胱甘肽转移酶的结构进行了总结,C端的谷胱甘肽转移酶α螺旋结构域和N端的硫氧还蛋白折叠结构域正是谷胱甘肽转移酶的典型三级结构。由此可知,木薯MeGSTU7基因是一个典型的谷胱甘肽转移酶編码基因。
本研究荧光定量PCR结果表明MeGSTU7基因响应干旱胁迫,且对水分信号十分敏感,在复水24 h后其表达量迅速下调。说明了MeGSTU7的表达受逆境诱导,与前人研究结果相符[10]。而复水24 h后其表达量迅速下调至正常水平的原因,可能是因为复水过后木薯生理生化反应改变,体内自由基等有害物质减少,从而刺激信号传导,引起内源调节基因对MeGSTU7表达进行调节。2012年,梁明[27]的研究显示,桑树干旱复水后,体内主要保护酶如超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性回复到正常浇水水平。MeGSTU7基因表达的响应机理有可能如上述所说。2000年,Loyall等[6]的研究显示,GSTs可作为胁迫信号蛋白,在植物受到胁迫时起到信号传导作用。因此,对于MeGSTU7基因在木薯干旱复水后表达量迅速下调回复到正常浇水水平的另一种可能的解释是MeGSTU7在木薯受到干旱胁迫时是作为胁迫信号蛋白行使功能。但确切的解释和内在机制有待进一步的研究。
MeGSTU7基因变异丰富,SNP位点多且主要集中在CDS序列两端的外显子上。非同义突变在总SNP位点中所占比例大,可能会影响到所编码蛋白的理化性质及高级结构,从而对酶活性产生影响。MeGSTU7基因在60份木薯品种中存在4种主要单倍型,4种主要单倍型之间只有4个SNP的差异,其中两个SNP与干旱胁迫下木薯地上部鲜重耐旱系数显著关联,但是在4种主要单倍型之间,地上部鲜重耐旱系数平均值差异不显著。4种主要单倍型分为两大类,分子进化分析显示,在这两大类单倍型基因区两端会受到正向选择作用,人们在培育高抗旱性木薯过程中,对表型的筛选可能会将这些优等位基因变异固定下来。在所有SNP中,只有2个SNP和一个Indel与干旱表型有关联。Indel位于5′UTR区,可能是无意义的关联,也可能是由于与其他功能SNP处于单倍型之中,也可能是具有功能的插入/缺失突变,但具体的原因需要重复实验和基因功能方面的研究证据。2个关联SNP有1个是同义突变,1个非同义突变,SNP93可能是与SNP525处于强连锁不平衡状态,所以被一起检测到。SNP525是位于第二外显子区的非同义突变,并且位于C端GST亚基上,可能是具有功能的SNP突变位点。总之,本研究的结果为进一步研究MeGSTU7基因自然变异与木薯抗旱的关系,深入研究碱基变异与基因表达和功能之间的联系提供了证据。
参考文献
[1] 胡延章. 植物的谷胱甘肽转移酶家族[J]. 重庆三峡学院学报, 2004, 5(20): 121-124.
[2] Moons A. Regulatory and functional interactions of plant growth regulators and plant glutathione-S-transferases(GSTs)[J]. Vitamins and Hormones, 2005, 72: 155-202.
[3] Nutricati E, Miceli A, Blando F, et al. Characterization of two Arabidopsis thaliana glutathione-S-transferases[J]. Plant Cell Reports, 2006, 25(9): 997-1 005.
[4] Shimabukuro R H, Swanson H R, Walsh W C. Glutathione conjugation: atrazine detoxification mechanism in corn[J]. Plant Physiol, 1970, 46: 103-107.
[5] Mueller L A, Goodman C D, Silady R A, et al. A petunia glutathione S-transferase required for anthocyanin sequestration, is a flavonoid-binding protein[J]. Plant Physiol, 2000, 123: 1 561-1 570.
[6] Loyall L, Uchida K, Braun S. et al. Glutathione and a UV light-induced glutathione S-transferase are involved in signaling to chalcone synthase in cell cultures[J]. Plant Cell 2000, 12: 1 939-1 950.
[7] Kampranis S C, Damianova R, Atallah M, et al. A novel plant glutathione Stransferase/peroxidase suppresses Bax lethality in yeast[J]. J Biol Chem, 2000, 275: 29 207-29 216.
[8] Danielson U H, ESterbauer H, Mannervik B. Structure-activity relationships of 4-hydroxyalkenals in the conjugation catalysed by mammalian glutathione transferases[J]. Biochem J, 1987, 247: 707-713.
[9] Tan K H, Meyer D J, Coles B, et al. Thymine hydroperoxide, a substrate for rat Se-dependent glutathione peroxidase and glutathione transferase isoenzymes[J]. FEBS Lett, 1986, 207: 231-233.
[10] 胡延章, 周大祥, 罗 凯. 植物谷胱甘肽转移酶的结构与功能及其基因表达[J]. 植物生理通讯, 2007, 43(1): 195-200.
[11] Dixon D P, Lapthorn A, Edwards R. Plant glutathione transferases[J]. Genome Biology, 2002, 3(3): reviews3004.1-reviews3004.10.
[12] Bhavanath Jha, Anubha Sharma, Avinash Mishra.Expression of SbGSTU(tau class glutathione S-transferase)gene isolated from Salicornia brachiata in tobacco for salt tolerance[J]. Mol Biol Rep, 2011, 38: 4 823-4 832.
[13] 赵凤云, 王晓云, 赵彦修, 等. 转入盐地碱蓬谷胱甘肽转移酶和过氧化氢酶基因增强水稻幼苗对低温胁迫的抗性[J]. 植物生理与分子生物学学报, 2006, 32(2): 231-238.
[14] 戚元成, 张世敏, 王丽萍, 等. 谷肤甘肤转移酶基因过量表达能加速盐胁迫下转基因拟南芥的生长[J]. 植物生理与分子生物学学报, 2004, 30(5): 517-522.
[15] 戚元成, 张小强, 刘卫群, 等. 过量表达谷胱甘肽转移酶基因对转基因拟南芥抗旱能力的影响[J]. 植物生理通讯, 2008, 44(2): 268-270.
[16] 赵凤云, 徐忠俊. 干旱高温 胁迫下转基因水稻的生理变化[J]. 西北植物学报, 2009, 29(2): 240-248.
[17] 黄 洁, 陈三鲁, 李开绵, 等. 沙地木薯的抗旱栽培技术[J]. 中国热带农业, 2007(6): 60-61.
[18] Wang B, Nie Y C, Lin Z X, et al. Molecular diversity, genomic constitution, and QTL mapping of fiber quality by mapped SSRs in introgression lines derived from Gossypium hirsutum × G. darwinii Watt[J]. Thero Appl Genet, 2012, 126: 1 263-1 274.
[19] 阮孟斌, 李文彬, 于晓玲, 等. 一种适用于多糖多酚植物的高质量RNA快速提取方法[J]. 热带作物学报, 2011, 32(9): 1 704-1 707.
[20] 王关林, 方宏筠. 植物基因工程原理与技术[M]. 北京: 科学出版社, 1998.
[21] Librado P, Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics, 2009, 25: 1 451-1 452.
[22] Hall T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucl Acids Symp Ser, 1999, 41: 95-98.
[23] Lin Z X, He D H, Zhang X L. Linkage map construction and mapping QTL for cotton fiber quality using SRAP, SSR and RAPD[J]. Plant Breed, 2005, 124: 180-187.
[24] Mattias Jakobsson, Noah A Rosenberg. CLUMPP: a cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure[J]. Genetics and Population Analysis, 2007, 14(23): 1 801-1 806.
[25] Wen Z X, Zhao T J, Zheng Y Z, et al. Association analysis of agronomic and quality traits with SSR markers in Glycine max and glycine soja in China: II[J]. Exploration of Elite Alleles, Acta Agronomic a Sinaca, 2008, 34(8): 1 339-1 349.
[26] 楊海灵, 聂力嘉, 朱圣庚, 等. 谷胱甘肽硫转移酶结构与功能研究进展[J]. 成都大学学报(自然科学版), 2006, 25(1): 19-24.
[27] 梁 明. 土壤干旱复水后桑树补偿生长的光合机理研究[D]. 哈尔滨: 东北林业大学, 2012.

