鲅鱼蛋白水解产物功能性质分析
孙协军,李秀霞,蔡路昀,冯彦博,田 鑫,李佳伟
(渤海大学化学化工与食品安全学院,辽宁省食品安全重点实验室,辽宁省高校重大科技平台“食品贮藏加工及质量安全控制工程技术研究中心”,辽宁锦州121013)
鲅鱼蛋白水解产物功能性质分析
孙协军,李秀霞*,蔡路昀,冯彦博,田鑫,李佳伟
(渤海大学化学化工与食品安全学院,辽宁省食品安全重点实验室,辽宁省高校重大科技平台“食品贮藏加工及质量安全控制工程技术研究中心”,辽宁锦州121013)
研究了鲅鱼酶解产物水溶性、持油持水能力、粘度等特性及抗氧化活性等功能性质。研究结果表明,鲅鱼蛋白在被木瓜蛋白酶酶解后(水解度25%),酶解液在pH3~11条件下具有很好的水溶性,水解物分子质量多集中在1350u以下,其TCA-NSI在46.0%~76.8%之间,但亲油能力和水合能力均有所下降,由于较高的水解度和木瓜蛋白酶的酶切特性的影响,鲅鱼蛋白水解液的起泡性和起泡稳定性均不理想,在蛋白质浓度10~80mg/mL范围内,鲅鱼蛋白水解液20℃运动粘度为1.14~1.82mm2/s,具有较好的流动性。鲅鱼蛋白水解产物具有较好的还原力、自由基清除能力和抗脂质过氧化能力,抗氧化活性随着浓度的增加而升高,鲅鱼蛋白水解液的抗氧化能力和其浓度间呈现剂量效应关系。本文对鲅鱼蛋白水解产物的功能性质方面的研究可为其在食品加工中的应用提供技术支持。
鲅鱼,木瓜蛋白酶,酶解产物,功能性质
鲅鱼(Scomberomorus niphonius)学名为蓝点马鲛,属于鲈形目鲅科,俗称燕鱼、青箭等。鲅鱼肉富含蛋白质、维生素A和多种矿物质等营养成分。鲅鱼是我国北方海区重要的经济鱼类,资源丰富,2012年我国的鲅鱼年捕获量为45.9万t[1],捕捞产品主要以鲜食为主,加工水平较低。
鱼肉蛋白质主要由肌原纤维蛋白质组成(50%~70%)[2],而肌原纤维蛋白不溶于水,因此,鱼肉蛋白质的水溶性较差,而加热、酶解、酸溶和碱溶是改善鱼肉蛋白质水溶性的主要方法,其中酶解作用条件温和,对鱼肉蛋白的营养价值和功能特性有很好的改善作用[3],酶解后的鱼蛋白水溶性得到改善,一定酶解程度的鱼蛋白乳化性和流动性也得到了提高,更适合作为食品加工的原料[4]。利用酶解技术进行蛋白高值化改性多集中在海产低值鱼,一些小鲅鱼由于体积小、肉薄、风味差,在市场上不受欢迎,浪费情况严重。本实验以小鲅鱼为原料制备鲅鱼蛋白水解产品,对鲅鱼水解蛋白的理化性质和抗氧化活性进行研究,为低值小鲅鱼的开发利用提供借鉴。
1 材料与方法
1.1材料与仪器
鲅鱼购于锦州市水产品批发市场;木瓜蛋白酶(食品级,40万U/g) 郑州皇朝化工产品有限公司;标准牛血清白蛋白北京普博斯生物科技有限公司;蓝色葡聚糖2000美国Sigma-aldrich公司;氧化性谷朊甘肽、还原型谷朊甘肽和维生素B12(分量为614.307、1355u) 瑞典Rharmacia公司;其他试剂均为分析纯。
SZF-06A型脂肪测定仪上海新嘉电子有限公司;微量凯氏定氮装置泉州市万达化玻仪器设备公司;PB-10型酸度计北京赛多利斯公司;JB-90-2型定时磁力搅拌器上海衡平仪器仪表厂;FJ-200型高速分散均质机上海标本模型厂;HH数显恒温水浴锅金坛市金城国盛实验仪器厂;101B-2型电热鼓风干燥箱上海申光仪器仪表有限公司;FA2004型电子分析天平上海恒平科学仪器有限公司;TD5A-WS型台式低速离心机长沙湘仪离心机仪器有限公司;KQ-400KDE型超声波清洗器昆山市超声仪器有限公司;721型分光光度计上海菁华科技仪器有限公司;RE-2000型旋转蒸发仪上海亚荣生化仪器厂;SHZ-D(Ⅲ)型循环水真空泵上海申光仪器有限公司;乌氏粘度计(0.5~0.6mm) 台州市椒江区玻璃仪器厂;labconco free zone 2.5L型真空冷冻干燥机上海汇分电子科技有限公司。
1.2实验方法
1.2.1鲅鱼蛋白粉和水解粉的制备选择新鲜度良好的冷冻小鲅鱼,加冰运到实验室后,流水解冻,取鱼肉经绞肉机绞碎成肉糜,取少量鱼糜冷冻干燥后粉碎即为鲅鱼蛋白粉;另取适量鱼糜置于大烧杯中,按照底物浓度5%加入一定量去离子水,烧杯置于水浴中加热至50℃,按照5000U/g底物的酶浓度加入适量木瓜蛋白酶,搅拌酶解6h,煮沸灭酶5m in,酶解液冷却至室温后,4000r/m in离心15m in,收集上清液于磨口平底烧瓶中,60℃旋转蒸发掉大部分水分后,冻干成粉,真空封装后冷藏备用。
1.2.2水解产物基本成分分析蛋白质的测定参照GB 5009.5-2010《食品安全国家标准食品中蛋白质的测定》,采用微量凯氏定氮法测定;脂肪含量测定参照GB/T 5009.6-2003《食品中脂肪的测定》,采用索氏抽提法测定;水分测定参照GB 5009.3-2010《食品安全国家标准食品中水分的测定》,采用直接干燥法测定;灰分测定参照GB 5009.4-2010《食品安全国家标准食品中灰分的测定》所述方法测定。
1.2.3三氯乙酸氮溶指数(TCA-NSI)测定
1.2.3.1蛋白质含量和分子量测定鲅鱼蛋白水解液蛋白质含量测定参照陈毓荃所述考马斯亮蓝G250法测定[5]。
鲅鱼蛋白水解液分子量测定采用Sephadex G-15凝胶层析进行。Sephadex G-15凝胶填料按照说明进行前处理后,湿法装柱,柱体积为600mm×16mm,凝胶沉积到距离柱顶端约10cm处停止装柱,去离子水洗脱6h后0.1mg/m L葡聚糖2000检查装柱质量。Sephadex G-15分离的分子量范围为500~1500u,分别将牛血清白蛋白(分子量≈66,800u)、维生素B12(分子量1355u)、氧化型谷胱甘肽(分子量614u)和还原型谷胱甘肽(分子量307u)配制成浓度为1mg/m L的溶液,分别进样1m L,去离子水洗脱,流速0.5m L/m in,每3m in收集一管,280nm测定各管收集液的吸光度,绘制分子量对数对洗脱体积的标准曲线,鲅鱼蛋白水解冻干粉稀释成蛋白质浓度为1mg/m L的溶液,相同条件下进样,测定鲅鱼蛋白水解液的分子量分布情况。
1.2.3.2水解度的测定游离氨基态氮的测定:甲醛滴定法[5]。

1.2.3.3TCA-NSI的测定将鲅鱼蛋白粉和水解冻干粉分别溶解于适量去离子水中,配制成蛋白质浓度为5mg/m L的水溶液,分别量取该水溶液10m L,均加入1mol/L盐酸溶液或1mol/L氢氧化钠溶液调节水解液pH分别为3、4、5、6、7、8、9、10和11,再各加入10m L 10%三氯乙酸(TCA)溶液,混合后放置10m in,于4000r/m in离心20min,采用考马斯亮蓝法测上清液中蛋白质含量,计算TCA氮溶指数。

1.2.4起泡性和起泡稳定性测定参考陈志军实验方法[3],分别称取2g鲅鱼蛋白粉和鲅鱼蛋白水解冻干粉,各溶于200m L的去离子水中,分别加入1mol/L盐酸溶液或1mol/L氢氧化钠溶液调节水解液pH分别为2、4、6、8和10,1600r/m in分散1m in,静置2m in后量取起始泡沫体积,计算起泡性,起泡溶液室温放置5、10、15m in后量取放置后的泡沫体积,计算起泡稳定性。

1.2.5亲油能力和水合能力的测定参考陈志军[3]和张涛等[6]实验方法,称取0.5g鲅鱼蛋白粉和蛋白水解冻干粉,分别与10m L大豆色拉油或去离子水一起置于离心管中,涡旋混合1m in后,静置1m in,于4000r/m in离心30m in,量取游离油或水的体积,体积减少量即为样品亲油量或亲水量。以每g样品吸收的油或水的体积分别表示蛋白质亲油能力和水合能力。
1.2.6粘度测定在室温(20℃)条件下采用乌氏粘度仪(0.5~0.6mm内径)测定。参照使用说明,将乌氏粘度计先使用洗液浸泡,丙酮、自来水和蒸馏水依次清洗后,调节恒温槽的温度为(20±1)℃,在粘度计中加入10m L样品溶液,然后将加了样品溶液的粘度计垂直挂于恒温槽的支架上,恒温10min后测定。
1.2.7抗氧化活性测定
1.2.7.1还原力测定参考荣建华等测定方法并略加改动[7],将鲅鱼蛋白水解浓缩液及VC溶液(标准参照物)分别稀释为0.05、1、5、10、15、20、30mg/m L的溶液。精确吸取不同浓度的样品溶液及VC溶液各2.0m L,并加入2.0m L pH6.6的磷酸盐缓冲液(0.2mol/L)及2.0m L 1%(w/v)的铁氰化钾溶液,混合均匀后,于50℃恒温水浴20m in后,向混合液中加入2.0m L 10%(w/v)的三氯乙酸溶液,混匀后以3000r/m in离心10m in。取上清液2.5m L,加入2.5m L蒸馏水和0.5m L 0.1%(w/v)的三氯化铁溶液,混合均匀,待室温下反应10m in后,于700nm处测定吸光度值。吸光值越高则表示样品还原能力越强,比较不同浓度的鲅鱼蛋白水解液还原力的大小。各浓度样液重复处理3次,求其平均值。以相同浓度VC标准溶液作为对照。
1.2.7.2羟自由基清除能力采用邻二氮菲-亚铁化学法测定比较不同浓度的鲅鱼蛋白水解液清除羟自由基能力[8]。将鲅鱼水解蛋白冻干粉分别配制成为蛋白质含量分别为10、20、30、40、50、60、70、80mg/m L的样品溶液。精确吸取1.5mmol/L邻二氮菲溶液1.0m L于试管中,依次加入0.2mol/L的pH 7.4磷酸缓冲液2.0m L和不同浓度鲅鱼蛋白水解稀释液1.0m L,充分混合后,再加入1.5mmol/L硫酸亚铁溶液1.0m L,混匀,再加入1.0m L 0.1%H2O2,混匀后置于恒温水锅中,38℃保温60m in后于波长536nm处测吸光度值,记为As;再用1.0m L去离子水代替1.0m L H2O2,测得吸光度值为Ab。空白管以1.0m L蒸馏水代替1.0m L样液作为参照。各浓度样液重复处理3次,求其平均值。以相同浓度VC标准溶液作为对照。按下式计算羟自由基清除率:
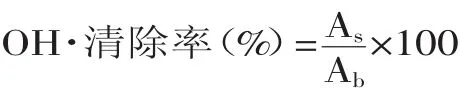
1.2.7.3超氧阴离子自由基(O2·-)清除能力将鲅鱼蛋白水解冻干粉分别配制成蛋白质含量为10、20、30、40、50、60、70、80mg/m L的样品溶液。精密量取50mmol/L的pH 8.2 Tris-HCl缓冲溶液4.5m L及0.1m L样品液于试管中,混匀后在室温下放置4m in,然后于325nm处测定吸光值Aj;精密量取Tris-HCl缓冲溶液4.5m L,向其中加入7mmol/L的邻苯三酚溶液3.0m L,待反应平衡4min后,于325nm处测定吸光值A0。按上述方法,精密量取Tris-HCl缓冲溶液4.5m L及0.1m L样品液于试管中,混匀后在室温下放置4m in,立即加入3.0m L邻苯三酚并开始计时,以10mmol/L HCl为参比,于325nm处每隔30s测定吸光值A,共记录前6min;各浓度样液重复处理3次,求其平均值。以相同浓度VC溶液作为对照。
按下式计算超氧阴离子自由基O2·-清除率:
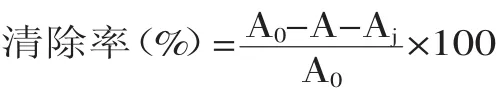
1.2.7.4DPPH自由基清除能力参照李红实验方法[9],精密量取蛋白质含量为2.0g不同样品溶液于试管中,加入0.2mmol/L的DPPH溶液2.0m L,混合均匀后,于室温下暗处放置20m in,以样品提取溶剂,无水乙醇溶液为参比调零,于517nm处测定其吸光度值Ai;精密量取蛋白质含量为2.0g的不同浓度鲅鱼蛋白水解稀释液于试管中,加入蒸馏水2.0m L,混合均匀后,于室温下暗处放置20m in,后于517nm处测定其吸光度值Aj;精密量取0.2mmol/L的DPPH溶液2.0m L,加入蒸馏水2.0m L,混合均匀后,于室温下暗处放置20min,后于517nm处测定其吸光度值Ac。各浓度样液重复处理3次,求其平均值。以相同浓度VC标准溶液作为对照。
按下式计算DPPH自由基清除率:
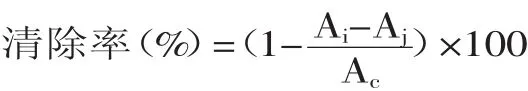
1.2.7.5抗脂质过氧化能力的测定[10]试液的配制:脂质体PBS(磷酸缓冲液)分散系(LLS):300mg卵磷脂溶解于30m L 10mmol/L pH 7.4 PBS中,冰水冷却条件下超声处理一段时间,制得人工脂质体;三氯乙酸(TCA)-硫代巴比妥酸(TBA)-盐酸混合液:15g TCA、0.37g TBA和2.1m L浓盐酸依序放入100m L水中。
测定步骤:分别于样品管中依次加入1m L卵磷脂溶液(LLS)、1m L 0.4mmol/L硫酸亚铁和1m L样品,混匀。避光于37℃水浴60m in,加入2m L TCA-TBA-HCl混合液,90~100℃水浴15min,迅速冷却,以3000r/min离心10m in,取上清液在535nm测定吸光度As。对照管以1m L超纯水代替1m L样品,操作方法同样品管,可测得对照管的吸光度Ac,参比管中以1m L超纯水代替1m L卵磷脂,以相同浓度的BHT溶液为对照。
按下式计算抑制脂质过氧化能力:
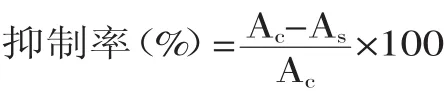
1.2.8数据处理实验所得数据采用Excel 2003及SPSS 10.0数学软件进行分析。
2 结果与分析
2.1基本成分分析
鲅鱼蛋白粉原料与水解冻干粉成分分析结果见表1,水解后的冻干粉蛋白质含量略有增加,水解液中主要含可溶性蛋白、多肽和氨基酸类、可溶性糖、水分及可溶的盐类等,而一些不易溶解于水中的组分在离心等步骤中去除。经酶解后,冻干粉中蛋白质含量达到80%以上,木瓜蛋白酶适合pH在7.0附近,酶解过程没有调节pH,减少了无机盐的残留,灰分增加很小,因此,水解后的蛋白粉适合作为蛋白质原料来利用。
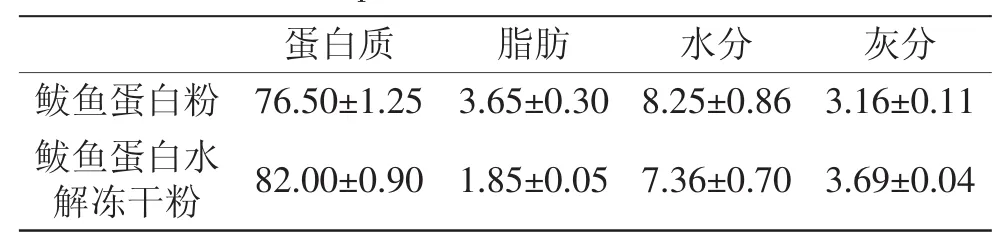
表1 鲅鱼蛋白酶解前后主要成分分析(%)Table 1 Analysis of protein components and hydrolysis from spanishmackerel(%)
2.2TCA-NSI测定结果
2.2.1蛋白质标准曲线的建立及鲅鱼蛋白水解液分子量分布测定结果牛血清白蛋白溶液浓度在0~5mg/m L范围内线性关系良好,其回归方程为y= 0.0517x+0.0577(式中y为吸光度;x为蛋白质含量,单位为mg),R2=0.9996。
采用SephadexG-15对鲅鱼蛋白水解液进行了初步分离,结果如图1所示,各分子量标准品的洗脱体积见表2,超过1500u的物质直接走凝胶间隙出来,不能分离,牛血清白蛋白的分子量为66800u,其分子量可校正为1500u。以标准品分子量的对数对洗脱体积作图,得到回归方程如下:y=-29.16x+129.24,其中x为分子量对数,y为洗脱体积(单位:m L),R2=0.9928。从图1可以看出,绝大部分鲅鱼蛋白水解液的洗脱体积在38~60m L之间,由回归方程计算出相对应的分子量分别为237~1346u之间,说明鲅鱼蛋白水解液中多肽的分子量片段多数在1350u以下。

图1 鲅鱼蛋白水解液SephadexG-15凝胶层析谱图Fig.1 Elutein profiles of protein hydrolysates of spanish mackerel using Sephadex G-15 chromatography
2.2.2TCA氮溶指数测定结果鲅鱼蛋白酶解前后随pH变化的TCA氮溶指数测定结果见图2所示,在pH 3~11的范围内,酶解后的鲅鱼蛋白溶解度远大于未酶解时,随着pH增加,酶解前后蛋白质溶解度的差距逐渐加大,当pH为11时,鲅鱼蛋白中仅有少量小分子蛋白能够不被TCA沉淀,溶解度为20.8%,而水解液溶解指数已经达到76.8%,这与酶解产物分子量较低有关,水解产生大量小肽和氨基酸,水溶性显著增加(p<0.05)。鱼体肌肉蛋白质可分为肌原纤维蛋白质、肌浆蛋白质和肌基质蛋白质,而肌原纤维蛋白由肌动蛋白(等电点5.4)和肌球蛋白(等电点4.7)组成,鱼肉蛋白质沉淀量最大时pH应在肌球蛋白等电点附近[11]。在本实验中,鲅鱼蛋白在碱性条件下溶解度更好,在pH 5.0附近溶解度最低,推测鲅鱼蛋白质等电点在pH 5.0左右,当溶液pH>5.0后,鲅鱼蛋白原液的溶解度随着pH增加而变大[12]。蛋白质经酶水解后,水解液中蛋白质和多肽的结构和性质都发生了变化,等电点对蛋白水解液溶解度的影响变小,从实验结果看,鲅鱼蛋白水解液的溶解度随着pH的增加而增加,没有出现明显的沉淀现象,这与鲢鱼为原料的实验规律相一致[3]。
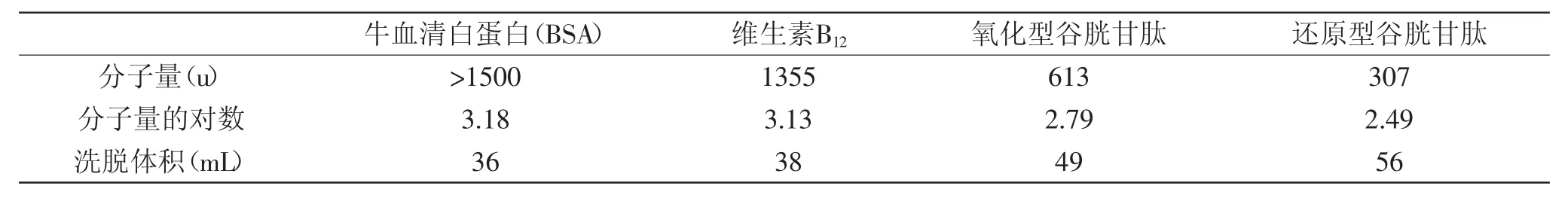
表2 标准物质的分子量及洗脱体积Table 2 Themolecularweightand elution volume of peptide standards
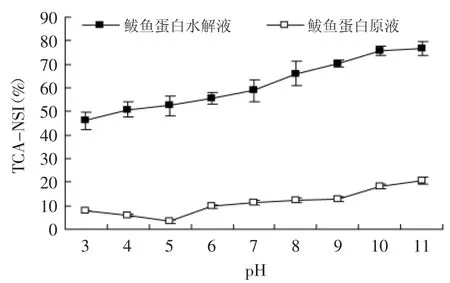
图2 鲅鱼蛋白酶解前后在不同pH条件下溶解性的变化Fig.2 Solubility of spanishmackerel protein under different pH before and after hydrolyzing

图3 pH对鲅鱼蛋白酶解前后起泡性的影响Fig.3 Effectof foaming ability of spanishmackerel protein before and after hydrolyzing
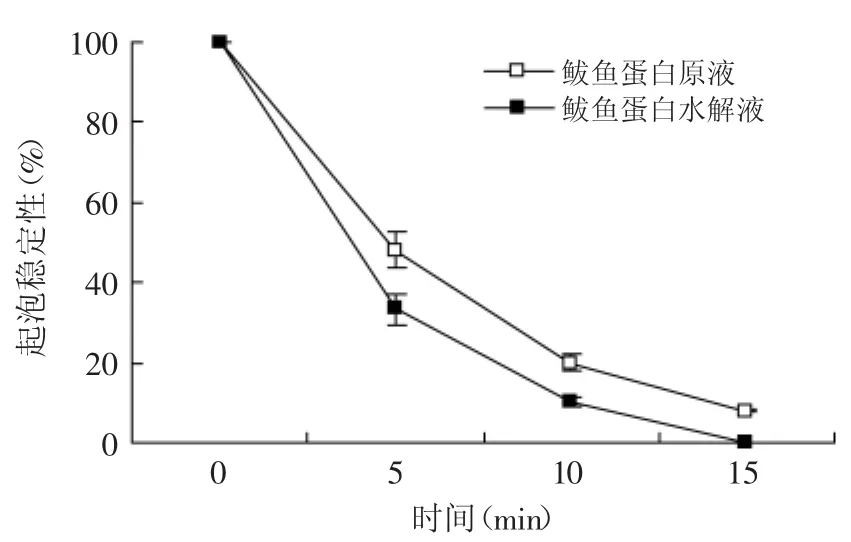
图4 鲅鱼蛋白酶解前后的起泡稳定性的变化Fig.4 Foaming stability of spanishmackerel protein before and after hydrolyzing
2.3起泡性和起泡稳定性的测定结果
鲅鱼蛋白酶解前后起泡性和起泡稳定性测定结果见图3和图4。良好的溶解性是蛋白质溶液形成泡沫的基础,木瓜蛋白酶为内肽酶,它可以水解蛋白质内部的肽键,生成相对分子质量较小的短肽,所以,酶解后的鲅鱼蛋白水解液主要由可溶性蛋白、多肽和游离氨基酸组成,水解液的氮溶解指数和粘度均高于未酶解的鲅鱼蛋白原液,但由于本实验中鲅鱼蛋白水解度较高(甲醛滴定法测定DH为25%),影响了水解液的起泡性[13],因此,酶解后的鲅鱼蛋白起泡性只是略有提高(见图3)。从图3可以看出,酶解前后的鲅鱼蛋白起泡稳定性均迅速下降,在放置15m in后泡沫基本消失,说明鲅鱼蛋白起泡稳定性较差,而酶解则加速了起泡稳定性的降低,这可能与木瓜蛋白酶专一性切除非疏水氨基酸组成的肽键有关[14],水解液相对分子量较低,可溶性酶解产物含量高,水溶性较好,而粘度较低,起泡稳定性差。
2.4亲油能力和水合能力测定结果
酶解对鲅鱼蛋白亲油能力和水合能力的测定结果见图5。由图5可知,鲅鱼蛋白水解后亲油能力由2.5m L/g降为1.8m L/g,鲅鱼水解蛋白液的亲油能力低于番茄籽蛋白和汉麻籽蛋白等植物种籽蛋白[6],但酶解后的鲅鱼蛋白水解液亲油能力高于鲢鱼蛋白水解液(1.2m L/g)[3]。经木瓜蛋白酶水解后,鲅鱼蛋白水解液中产生大量小肽和氨基酸,小分子量物质增加,水溶性增加,疏水性减弱,亲油能力降低。由于鲅鱼蛋白水解液溶解于水,没有计算酶解后的水合能力,而酶解前鲅鱼蛋白的水合能力为2.0m L/g。
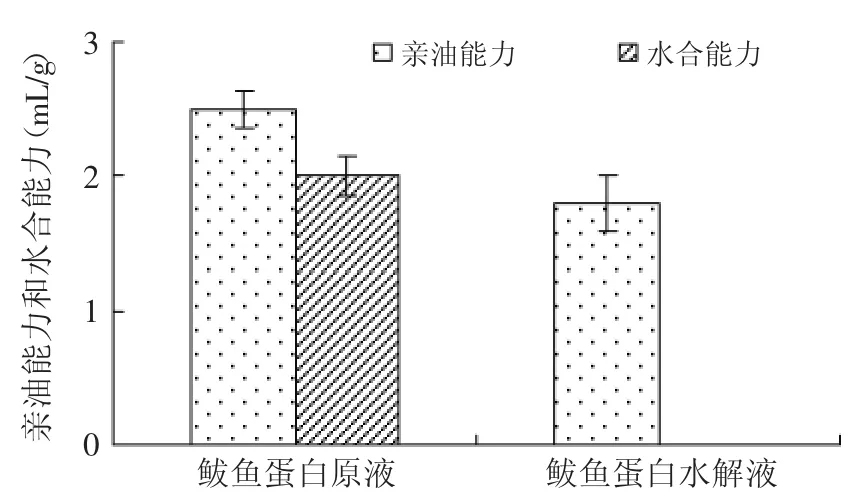
图5 鲅鱼蛋白酶解前后的亲油能力和水合能力Fig.5 Hydrophilic-lipophilic ability of spanishmackerel protein before and after hydrolyzing
2.5粘度测定结果
鲅鱼蛋白粉在水中溶解性很差,形成的是悬浮液,取其上清液测得的粘度很低,因此,本实验中只测定了鲅鱼蛋白水解液的粘度。测定结果见图6,从图6可知,随着鲅鱼蛋白水解液浓度从10~80mg/m L,20℃运动粘度从1.14m2/s升高到1.82m2/s。酶解增加了鲅鱼蛋白的水溶性[4],从而增加了粘度,随着浓度的增加,蛋白水解液的粘度逐渐增加。鲅鱼蛋白水解液的流动性很好,实验过程中观察到,在受热情况下,蛋白水解物不发生胶凝变性,所以其粘度在一定浓度内可能不受温度的影响。这主要是因为蛋白质水解后的疏水性降低了,且净电荷量增加,肽与肽之间的静电排斥,防止了蛋白水解物的胶凝,因此即使高浓度的蛋白水解液,也具有低粘度[15]。这种性质的改变,使蛋白水解物在加工过程中泵输送、搅拌、喷雾干燥、热杀菌等工艺更易实施,比鱼蛋白粉更适合作食品加工原料。

图6 鲅鱼蛋白水解液粘度Fig.6 Viscosity of spanishmackerel protein hydrolysates
2.6还原力测定结果
作为电子供体的还原剂通过提供电子给自由基,从而起到淬灭自由基的作用,还原力高低反应自由基清除能力的大小。由图7可见,鲅鱼蛋白水解液还原力随着浓度的增加而线性增加,表明其还原力和浓度间呈现剂量效应关系,且鲅鱼蛋白水解液还原力与浓度之间存在线性关系,回归方程为:y= 0.2194x-0.2487(R2=0.9934),其中x为吸光度,y为水解液浓度(mg/m L)。鲅鱼蛋白水解液的还原力始终低于同浓度的维生素C,与斑鰶鱼蛋白酶解产物的还原力测定结果和变化规律相近[16],在水解液蛋白质浓度为10mg/m L时,还原力为0.389,当水解液蛋白质浓度为30mg/m L,还原力为1.350。
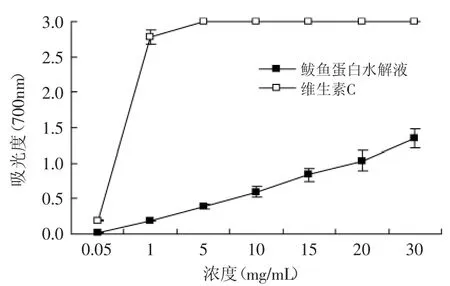
图7 鲅鱼蛋白水解液还原力Fig.7 Reducing power of spanishmackerel protein hydrolysates
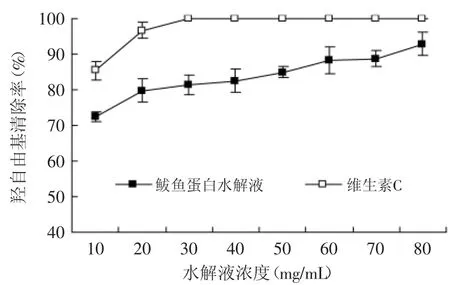
图8 鲅鱼蛋白水解液羟自由基清除能力Fig.8 Hydroxyl radical(OH·)scavenging activities of spanishmackerel protein hydrolysis
2.7羟自由基清除能力测定结果
羟自由基是高度活泼的一种自由基,在脂质过氧化的早期阶段中发挥作用,羟自由基清除能力部分是由于金属螯合作用[17]。由图8可见,水解液蛋白质浓度从10~80mg/m L时,羟自由基清除率从72.28%增加到92.28%,30mg/m L维生素C的清除率已经达到了100%,在铁氰化钾体系中,羟自由基是由Fe2+和H2O2反应而产生的,而鲅鱼蛋白酶解产物对Fe2+螯合能力较强[12],因此,鲅鱼蛋白水解液的羟自由基清除作用可能与其能够很好地螯合金属离子有关。
2.8超氧阴离子自由基清除能力测定结果
O2·-是生物活性最高的氧中心自由基之一,由于产生时间早、寿命长,可继发氧化损伤等反应,危害较大。从图9可见,鲅鱼蛋白水解液对超氧阴离子自由基O2·-有一定的清除作用,其清除作用较相同浓度维生素C溶液弱,且随着蛋白质浓度的增加,其蛋白质对超氧阴离子自由基O2·-的清除能力增强。当水解液蛋白质浓度在10~50mg/m L时,随浓度的增加超氧阴离子自由基清除率上升幅度较大,但当蛋白质浓度超过50mg/m L时,清除率上升幅度变慢,仍低于维生素C的清除能力。

图9 鲅鱼蛋白水解液超氧阴离子自由基清除能力Fig.9 Superoxide anion(O2·-)scavenging activities of spanishmackerel protein hydrolysis
2.9DPPH自由基清除能力测定结果
DPPH(1,1-二苯基苦基苯肼)是一种早期合成的稳定的以氮为中心的质子自由基有机自由基,含有奇数个电子,常用来评估抗氧化物的供氢能力[18]。鲅鱼蛋白水解液对DPPH自由基清除能力的测定结果见图10,从图10中可以看出,鲅鱼蛋白水解液对DPPH自由基有一定的清除作用,随着蛋白质浓度的增加,蛋白水解液对DPPH自由基的清除能力增强。当蛋白质浓度从10~80mg/m L时,DPPH自由基清除率从16.3%增加到63.7%,清除率低于同浓度的维生素C溶液。

图10 鲅鱼蛋白水解液DPPH自由基清除能力Fig.10 DPPH radical scavenging activities of spanishmackerel protein hydrolysis
2.10抗脂质过氧化能力测定结果
由图11可见,鲅鱼蛋白水解液对于Fe2+引发的卵磷脂体系中脂质体氧化有明显的抑制作用,抑制率随蛋白质浓度的增加而增大。不同浓度蛋白质对脂质过氧化的抑制率差异较小,当鲅鱼蛋白质浓度为2mg/m L时,对脂质过氧化的抑制率为23%,当鲅鱼蛋白质的浓度为4mg/m L时,对脂质过氧化的抑制率为42%。鲅鱼蛋白水解液抗脂质过氧化能力明显低于BHT(二丁基羟基甲苯)的抗脂质过氧化能力。
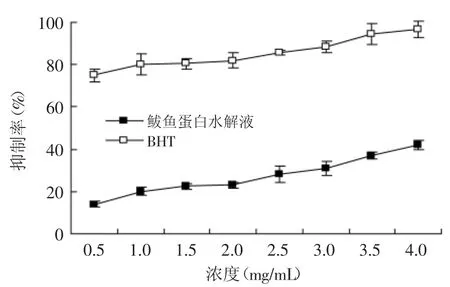
图11 鲅鱼蛋白水解液抗脂质过氧化能力Fig.11 Antioxidantactivities on lipid peroxidation of spanishmackerel protein hydrolysis
3 结论
研究了小鲅鱼木瓜蛋白酶酶解产物的体外抗氧化功能及性质,以甲醛滴定法为测定水解度方法,鲅鱼蛋白水解度在25%条件下,鲅鱼蛋白水解产物冻干粉中蛋白质含量为82.00%、水分含量7.36%、灰分含量3.69%和少量脂肪(1.85%)。酶解显著增加了鲅鱼蛋白的溶解度,且水解液的溶解度随着pH的增加而增加;酶解后,鲅鱼蛋白分子量多数集中于1350u以下,水解产物中小分子的多肽和游离氨基酸含量较高,水解产物的起泡性没有得到很好的改善;酶解也不利于改善鲅鱼蛋白的亲油能力和水合能力;鲅鱼蛋白水解液的流动性很好,较高浓度的蛋白水解液(蛋白质浓度40.0~80.0mg/m L)也具有较低粘度(20℃运动粘度为1.14~1.82mm2/s);鲅鱼蛋白水解产物具有较好的还原力、自由基清除能力和抗脂质过氧化能力,随着浓度的上升,鲅鱼蛋白水解液的抗氧化能力和其浓度间呈现剂量效应关系。对鲅鱼蛋白水解产物的功能性质方面的研究可为其作为食品基料添加到食品中提供技术支持和理论依据。
[1]农业部渔业局编制.2013中国渔业统计年鉴[M].北京:中国农业出版社,2013.
[2]郭晓风,邹胜祥译.水产利用化学[M].北京:中国农业出版社,1994.
[3]陈志军,李向红,刘永乐,等.鲢鱼蛋白酶法水解产物的功能性质[J].食品科学,2012,33(5):62-65.
[4]杨东,王慥.水解鱼蛋白及其功能特性的研究[J].食品科学,1999,20(11):23-26.
[5]陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002.
[6]张涛,卢蓉蓉,钱平,等.汉麻籽蛋白的提取及性质研究[J].食品与发酵工业,2008,34(8):173-179.
[7]荣建华,李小定,谢笔钧.大豆肽体外抗氧化效果的研究[J].食品科学,2002,23(11):118-120.
[8]谢海玉,纪银莉,高维东,等.邻二氮菲-Fe2+法测定牦牛乳酪蛋白酶解产物的抗氧化性[J].食品与发酵工业,2012,38(11):175-178.
[9]李红,郅洁,马彦梅,等.沙枣黄酮的提取及其抗氧化作用的研究[J].时珍国医国药,2010,2(1):35-36.
[10]张尔贤,俞丽君,周意林,等.Fe2+诱发脂蛋白PUFA过氧化体系及对若干天然产物抗氧化作用的评价[J].生物化学与生物物理学报,1996,28(2):218-292.
[11]陈申如,张其标,倪辉.酸法提取鲢鱼鱼肉蛋白质技术的研究[J].海洋水产研究,2004,25(5):61-64.
[12]史策,韩烽烽,刘鹏,等.鳕鱼和鲅鱼鱼肉蛋白酶解产物功能特性及抗氧化性[J].肉类研究,2013,27(8):5-7.
[13]刘骞,施雪,孔保华.鲤鱼鱼肉蛋白酶水解物抗氧化性及功能特性[J].食品科学,2012,33(5):19-24.
[14]王镜岩.生物化学[M].北京:高等教育出版社,2007.
[15]赵玉红,孔保华,张立钢,等.鱼蛋白水解物功能特性的研究[J].东北农业大学学报,2001,32(2):105-110.
[16]肖月娟,李润丰,郑立红,等.斑鰶鱼蛋白控制酶解及其酶解物抗氧化活性研究[J].中国食品学报,2010,10(5):91-97.
[17]Feng T,Du Y M,Wei Y A.Antioxidant activity of half N-acetylated water-soluble chitosan in vitro[J].Eur Food Res Technol,2007,225(1):133-138.
[18]Soares JR,Dins TCP,Cunha A P,etal.Antioxidantactivity of some extracts of Thymus zygis[J].Free Radical Res,1997,26(5):469-478.
Functional properties of protein hydrolysate abstained from spanish mackerel
SUN Xie-jun,LIXiu-xia*,CAILu-yun,FENG Yan-bo,TIAN Xin,LI Jia-wei
(College of Chemistry,Chemical Engineering and Food Safety,BohaiUniversity,Food Safety Key Lab of Liaoning Province,Engineering and Technology Research Center of Food Preservation,Processing and Safety Control of Liaoning Province,Jinzhou 121013,China)
Founctional p roperties of solubility,hyd rophilic and lipophilic ability,viscosity,and antioxidant activity of p rotein hyd rolysates from spanish mackerel were investigated in this paper.The results showed that when spanish mackerel p rotein was hyd rolyzed by papain(DH 25%),high solubility of the hyd rolysates was observed w ithin pH range of 3.0~11.0(TCA-NSIwas between 46.0%and 76.8%),most fractions Mw of hyd rlysates were lower than 1350u,but hyd rophilic and lipophilic ability were all reduced,due to the high degree of hyd rolysis and d igestion characterization of papain,foam ing ability and foam ing stability ofmackerel p rotein hyd rolyzates was undesirab le.Itwas observed that hyd rolates had high p rotein content(10~80mg/m L)and low viscosity which was of 1.14~1.82mm2/s of kinematic viscosity under 20℃.It was p rovided that mackerelp rotein hyd rolyzate had good reducing power,free rad icalscavenging and anti-lip id peroxidation,the antioxidant capacity increased w ith the inc rease of hyd rolysate concentration in a dose-effect relationship.The research of this paper about the functional p roperties of p rotein hyd rolyzates from spanish mackerelwould be useful for p roviding technicalsupporton its app lication in food p rocessing.
spanish mackerel;papain;hyd rolysate;founctinalp roperties
TS219
A
1002-0306(2015)06-0179-07
10.13386/j.issn1002-0306.2015.06.032
2014-07-02
孙协军(1969-),男,本科,实验师,主要从事食品资源开发利用方面的研究。
李秀霞(1973-),女,博士,副教授,主要从事水产品贮藏加工方面的研究。
“十二五”国家科技支撑计划(2012BAD29B06);辽宁省食品安全重点实验室开放课题(LNSAKF2011015)。

