黑曲霉液态发酵制备没食子酸的工艺研究
熊进 何顺荣 吴鑫颖 邱树毅 简辉 马威

摘要:采用高效液相色谱测定黑曲霉B0201制备的没食子酸,对底物添加方式、底物浓度、转化方式及转化条件等因素进行研究。最终确定较佳工艺条件为:用五倍子直接作为产酶的诱导物及转化底物,底物分4次添加,每次间隔12h,最终总浓度达6%,转化过程中搅拌速度优化为200r/min,温度为35℃,没食子酸浓度可达到39.78mg/mL,转化率达最大值73.05%。在对菌丝重复转化试验过程中补加营养物质及调节pH值均能提高转化产物浓度。
关键词:黑曲霉;液态发酵;五倍子;生物转化;没食子酸;工艺优化
中图分类号:TQ920.1 文献标志码:A 文章编号:1002-1302(2015)05-0250-04
没食子酸(gallicacid,GA)又名五倍子酸,为白色或淡黄色针状结晶,化学性质活泼,能形成多种酯类、酰卤和酰胺,可以通过氧化耦合反应制得鞣花酸、脱氢二鞣花酸等联苯型化合物,是一种重要的精细化学品,广泛应用于矿产、化工、农业、食品、制药等行业。目前,没食子酸的制备方法可分为化学法与生物法,工业上没食子酸主要是由化学法经酸或碱水解五倍子制得,其工艺存在对环境污染严重、副反应多、杂质含量较高等问题。而生物法因具有反应条件相对温和、对设备要求低、副产物较少、对环境友好以及岳续提纯工艺较为简单等诸多优点,近年来受到国内外相关学者的广泛关注。五倍子富含单宁酸,研究表明单宁酸诱导黑曲霉液态发酵产胞内单宁酶,单宁酶可高效、专一、定向裂解单宁酸分子,生成没食子酸;故直接将五倍子投入发酵系统中,利用菌体内的单宁酶将之转化为没食子酸。当转化趋于平衡后,分离菌丝体并洗涤,可反复转化五倍子制备没食子酸。此过程不需要将酶从菌体中分离,将酶的生成与五倍子单宁酸转化没食子酸的过程相耦合,简化了没食子酸的生物转化过程。与酶法转化相比,此方法转化底物浓度有很大倍数的提高,产物浓度也有很大提高。同时,分光光度法与高效液相色谱法相比,测定没食子酸是前者由于单宁酸和没食子酸结构相近,最大吸收峰波长也较近产生累加效应,因此产生的干扰比较大,实际测量值会偏大。本试验通过对底物添加方式、底物浓度、转化方式及转化条件等因素进行研究,以提高没食子酸相对于五倍子中单宁酸的转化率,为生物法制备没食子酸的工业化应用奠定基础。
1.材料与方法
1.1试验材料与仪器
1.1.1菌株黑曲霉B0201(Aspergillusniger),由笔者所在实验室保藏。
1.1.2培养基斜面培养基:察氏培养基;液态基础培养基:蔗糖2.0g,NaNO30.2g,K2HPO4·3H2O0.1g,KCl0.05g,MgSO4·7H2O0.05g,FeSO4·7H2O0.001g,溶于100mL蒸馏水中,pH值自然。
1.1.3主要试剂五倍子,购于贵州省遵义市余庆县;单宁酸C76H52O46,分析纯,购于天津福晨化学试剂厂;没食子酸C7H6O5·H2O,分析纯,购于贵州迪大生物有限公司,其他化学试剂均为国产分析纯。
1.1.4主要试验仪器722S分光光度计(上海精密科学仪器有限公司);FA-1004电子天平(上海良平仪器仪表有限公司);MJ-160B-II霉菌培养箱(上海跃进医疗器械厂);Anke TDL-5离心机(上海安亭科学仪器厂);XMTD-204双功能蒸汽振荡器(金坛市文华仪器制造有限公司);岛津LC-10AVP高效液相色谱仪(岛津有限公司)。
1.2试验方法
1.2.1产酶
1.2.1.1菌种的活化将保存的黑曲霉B0201转接到察氏斜面培养基后,放入霉菌培养箱中,于30℃条件下培养3~4d后,保存备用。
1.2.1.2种子悬浮液的制备斜面试管加入10mL生理盐水,洗脱并充分振荡、稀释后获得108个/mL左右的孢子悬浮液。
1.2.1.3黑曲霉B0201发酵产酶在灭菌的液态基础培养基中添加4%的五倍子,接种量2%,装液量100mL/250mL,摇匀后用纱布封口置于140r/min、30℃的摇床中培养72h,完成发酵产酶过程。
1.2.2没食子酸的制备
在产酶系统中直接添加底物转化五倍子单宁酸制备没食子酸。
1.2.3单宁酸转化率的测定
1.2.3.1没食子酸相对于单宁酸的转化率计算
1.2.3.2
单宁酸的测定
参考国家标准GB/T15686-1995,用紫外分光光度法测定单宁酸含量。(1)单宁酸标准曲线的绘制。配制不同浓度的标准溶液,再加入2.0mL磷钼钨酸试液和10.0mL饱和碳酸钠溶液,定容到50mL,静置30min后于4000r/min离心5min,720nm下光谱扫描。以吸收峰值D为纵坐标,样品浓度C(mg/mL)为横坐标,绘制标准曲线,得回归方程为:D=1.325C+0.113,r=0.9990。(2)五倍子中单宁酸含量的测定。取10.0g五倍子于三角瓶中,按1:12的比例加入蒸馏水,于140r/min、40℃下振荡浸提,每隔12h,取少量浸提液,过滤后按照单宁酸的测定方法测定其含量,最后计算五倍子中单宁酸总的浸出量。
1.2.3.3没食子酸的测定
(1)液相色谱条件。色谱柱为Waters Symnletryc18(5μm,4.6mm×150mm);流动相:A相甲醇(85%),B相0.5%乙酸溶液(15%);检测波长:273nm;柱温:40℃;流速:0.8mL/min。(2)没食子酸标准曲线的绘制。配制不同浓度的标准溶液,在上述液相色谱条件下,各进样20μL,平行测定5次。以峰面积A为纵坐标,样品浓度c(μg/mL)为横坐标,绘制标准曲线,得回归方程为:A=65453.13C-163771.09,r=0.9998。说明没食子酸在0.0506~O.406μ/mL范围内有良好的线性关系。(3)样品中没食子酸含量的测定。取1mL样品滤液,稀释到适当倍数,在上述液相色谱条件下进样20μL,平行测定5次,根据回归方程计算没食子酸的平均含量。
2.结果与分析
2.1单宁酸浸提率与浸提时间的关系
按照五倍子中单宁酸含量的测定方法,所得到单宁酸的浸提率(浸提液中单宁酸的生成量与五倍子的添加量的比值)与浸提时间的关系见图l。由图1看出,随着浸提时间的不断延长,单宁酸不断从五倍子中浸提出来,浸提时间72h时,浸提率达到55%,之后浸提率达到平稳。这说明单宁酸随浸提时间的延长,不断从五倍子中浸提出来,最终达到稳定值55%左右。单宁酸的浸提曲线可以反映实际可利用的单宁酸量,故可为单宁酸转化率的计算提供依据。
2.2不同转化方式对转化率的影响
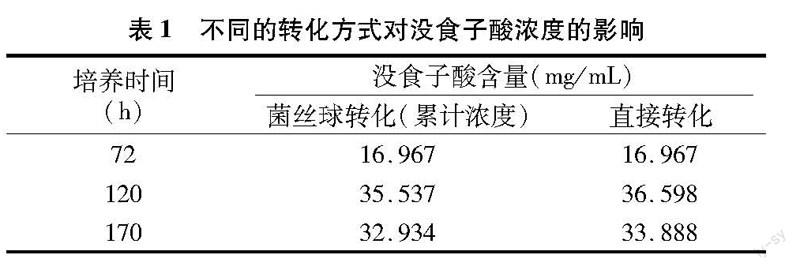
转化方式分2种:(1)将产酶菌丝分离,并用蒸馏水反复洗涤后,转入100mL含4%五倍子的溶液中,140r/min、30℃条件下转化,一定时间后测定转化液中没食子酸含量。(2)直接在发酵产酶系统中补加4%的五倍子,140r/min、30℃条件下继续转化,测定转化液中没食子酸的含量。按不同的转化方式,在120h和170h时没食子酸含量见表1。从表1可以看出,用相同量的诱导物和转化底物,转化120h和170h时菌丝球转化产物总质量分别为3.5537、3.2943g,而直接转化产物总质量分别为3.6598、3.3888g。2种转化方式所得到的没食子酸总质量差别不大。故从节省操作工序的角度考虑,选择直接添加五倍子粉转化的方式。
2.3不同的诱导物、底物形式对转化率的影响
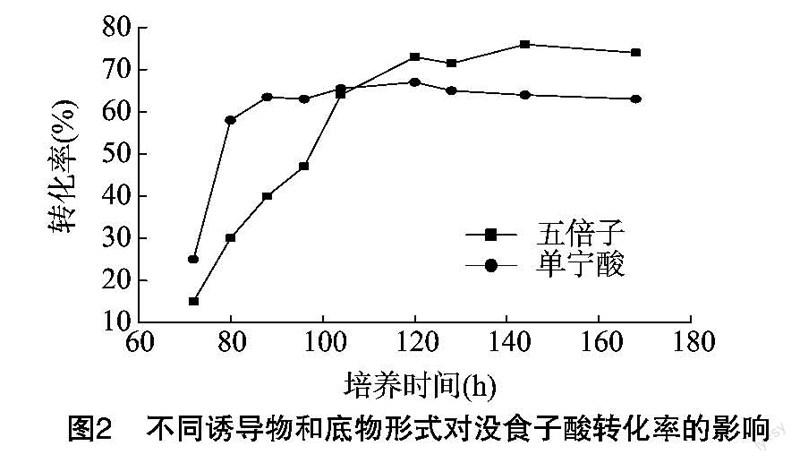
分别在液态基础培养基加入4%五倍子和2%单宁酸(相当于4%的五倍子中单宁酸量),培菌产酶结束后,再分别在相应的培养基中添加4%五倍子和2%单宁酸作为底物,于140r/min、30℃条件下转化,然后每隔8h测定转化液中没食子酸的含量,结果见图2。由图2看出,利用五倍子作为诱导物和底物时,转化到120h时趋于平衡,转化率可以达到73%以上;而利用单宁酸作为诱导物和底物时,刚开始得率相对较高,转化到90h时,转化趋于平衡,转化率为63.5%,平衡时用五倍子转化转化率明显偏高。这可能是由于用单宁酸转化时底物与酶结合空间阻碍小,转化速度快,其先达到底物饱和浓度,过量的单宁酸又会抑制产物的生成;而用五倍子作为底物时单宁酸是缓慢浸提出来的,前期转化速度慢,且低浓度的底物不会产生抑制效应,一定时间后才会达到饱和浓度,同时也能减少单宁酸制备过程。故选用五倍子作为诱导物和底物。
2.4底物添加方式对转化率的影响
培菌产酶结束后,采用分批补料方式,在上述相同的转化条件下转化,在转化过程中每隔12h添加2.0%的五倍子,与在相同的转化时间内一次性补料添加相同量的五倍子对照,2种底物的添加方式对没食子酸生产的影响情况见图3。在分批添加底物的过程中,pH值的变化情况见图4。由图3和图4可以看出,对于相同的转化时间分批补料有利于提高没食子酸的产量,随着转化时间延长,没食子酸浓度增大,最高达43.85mg/mL;但转化率先增大后降低,浓度最大时转化率只有56.95%,且pH值不断降低,最后都趋于稳定。这可能是因为分批补料有利于底物的持续供给,有利于转化,且pH值的下降可能对酶活起抑制作用,不利于转化。故分批补料对转化起积极作用;需在转化过程中加强调节pH值,以利于酶的稳定及作用的发挥。
2.5底物分批添加累积浓度对转化率的影响
培菌产酶结束后,按每隔12h分别添加1.0%、1.5%、2.0%、2.5%的五倍子底物,共添加4次,考察五倍子累积添加量分别为4.0%、6.0%、8.0%、10.0%时对没食子酸产量的影响,不同底物浓度对产物浓度及转化率的影响见图5和图6。由图5和图6可以看出,随着底物浓度增大,没食子酸浓度从32.29mg/mL增加到41.46mg/mL;转化率从75.64%降低到58.56%。底物浓度累积量为4%和6%时,两者转化率相差不大,但后者没食子酸浓度较前者高出很多,最大浓度为39.78mg/mL时,转化率为73.05%。故选择最佳终浓度为6%,添加4次,每次1.5%,浓度为39.78mg/mL时,转化率为73.05%。
2.6转化条件对转化率的影响
培菌产酶结束后,在分批补料的条件下,转化过程中采用不同的转速140、160、180、200、220r/min,对没食子酸的影响见图7;采用不同的转化温度25、30、35、40、45℃,对没食子酸产量的影响见图8。由图7可知,随着转速提高,转化率先增加后降低,当达到200r/min时转化率达到最大值。主要原因可能是转速直接影响发酵环境均匀性,转速太小,原料沉降与菌体分离,酶与底物结合空间受阻碍不利于转化;转速过大,对菌丝的剪切力较大,损伤菌丝,不利于菌丝的稳定生长及产酶。故200r/min是最佳的转化转速。由图8可知,温度对转化率的影响不显著,在30~40℃均有较高的转化率。温度对转化率的影响主要体现在2个方面:其一可能是温度升高时有利于单宁酸的提取溶出;其二酶是具有生物活性的大分子,在酶的最适作用的温度范围内,较高温度有利于提高酶反应速度。故选用35℃作为转化温度。
2.7菌丝转化次数对转化率的影响
培菌产酶结束后,按上述优化条件进行第一次转化结束后,即最后一次投料后继续转化12h,将菌丝球分离洗涤,重新按上述方法添加五倍子粉重复4次转化试验;并直接将菌丝转移到含有50%剂量的察氏培养基中添加五倍子粉进行转化或用稀氨水调节pH值,使之维持在4.5左右的方式来考察对转化率的影响,其转化情况见表2。由表2可以看出,随着转化次数的增加,相同的底物所得到的没食子酸的浓度越来越低。这可能是由于洗涤过程中导致酶的损失,使酶量减少,导致转化率不断下降。同时可以看出,添加少量的营养物质和调节pH值条件下没食子酸的浓度都比对照高。这可能是因为转化过程中更换发酵培养基,菌体环境变化,补充营养物质有利于维持菌体活性,保证酶活;随着没食子酸的不断积累pH值下降,添加氨水保证了酶作用的pH值,提高了酶活,同时也为菌体补充氮源,从而提高了转化率,且效果比单纯添加营养物质的好。故在对菌丝重复转化试验过程中补加营养物质及调节pH值使转化产物浓度均有所提高。
3.结论
目前,有关生物法制备没食子酸的报道,国内外都取得了一定的进展。杨亚力等以五倍子为底物用黑曲霉进行转化试验,其发酵液中没食子酸累积浓度达到25.6mg/mL,以五倍子中提取物单宁酸来计算没食子酸相对转化率为51.1%;Beena等报道了以单宁酸作为诱导物,利用菌株(AspergillusawamonBTMFW032)进行深层液态发酵,通过发酵84h,没食子酸的浓度可以达到372.6μg/mL;Seth等以单宁酸作为底物,利用Aspergillusawamoni,持续发酵60h,没食子酸的浓度可以达到19g/L,发酵作用100h左右,所积累的没食子酸浓度达到最大,为40.3g/L。
本试验利用黑曲霉B0201菌株产单宁酶,研究在不同条件下转化五倍子制备没食子酸,最终确定液态发酵产酶转化没食子酸的工艺条件为:采用不分离菌体直接转化方式,将五倍子作为产酶的诱导物及转化底物,采用分批补料方式,分4次添加,每次间隔12h,底物累积浓度6%,转化过程搅拌速度为200r/rain,转化温度为35℃,该试验在转化液中没食子酸浓度达到39.78mg/mL时,没食子酸相对于单宁酸的得率达到最高(73.05%),与以上报道的相比,在现有的报道中最高。但菌丝连续多次转化后转化能力下降,添加少量营养物质和调节pH值对菌丝球重复转化起积极作用,调节pH值的积极转化效果比添加少量营养物质的转化效果明显。

